金丝桃苷对帕金森病模型小鼠小胶质细胞M1/M2极化和LPS诱导的BV2细胞极化的调节作用研究
2022-08-26徐幸杰潘涛樊慧杰肖琪和璐璐李艳荣贾璐王利然尉杰忠肖保国马存根张波柴智
徐幸杰 潘涛 樊慧杰 肖琪 和璐璐 李艳荣 贾璐 王利然 尉杰忠肖保国 马存根 张波 柴智
帕金森病的发病率仅次于阿尔茨海默病,是第二大中枢神经系统变性疾病,其病理特征是黑质纹状体多巴胺能神经元的丢失和神经元蛋白质内含物“路易小体”的形成[1]。目前,帕金森病尚不能完全治愈,现代药物治疗副作用大,手术治疗风险高。中医药治疗帕金森病疗效确切,近期临床研究也表明中医药与现代治疗相结合,能够提高治疗效果,减少不良反应的发生[2]。课题组前期研究表明中医补肾方五子衍宗丸可以有效改善1-甲基-4-苯 基-1,2,3,6-四 氢 吡 啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的帕金森病小鼠的步态紊乱,减轻神经炎症和氧化应激反应,保护多巴胺神经元[3-5]。进一步的研究表明,五子衍宗丸主要活性成分金丝桃苷能够减轻鱼藤酮诱导的大鼠多巴胺神经元丢失和鱼藤酮诱导的SH-SY5Y人神经母细胞瘤细胞损伤,其机制与抑制多巴胺神经元凋亡和自噬有关[6]。在此基础上,本研究进一步探讨金丝桃苷对帕金森病模型小鼠小胶质细胞和LPS诱导的小胶质细胞(简称BV2细胞)M1/M2极化的调节作用,观察炎性细胞因子水平和极化相关蛋白表达变化,聚焦小胶质细胞极化,探究金丝桃苷对帕金森病模型的新机制。
1 材料与方法
1.1 金丝桃苷对帕金森病模型小鼠小胶质细胞M1/M2极化的影响研究
1.1.1 实验动物 30只体质量为18~22 g的雄性C57BL/6小鼠(8周龄)由北京维通利华实验动物有限公司提供,合格证号:[SCXK(京)2016-0006]。小鼠在温度为20~25℃、湿度为40%~60%的条件下饲养1周后开始实验。
1.1.2 试剂与仪器 金丝桃苷(分析标准品,≥98%,北京索莱宝科技有限公司,货号SH8310);MPTP(美国Sigma公司,货号M0896);肿瘤坏死因子α(tumor necrosis factorα,TNF-α)ELISA试剂盒、白介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(上海酶联生物科技有限公司,货号ml002095、ml301814);酪氢酸羟化酶(tyrosine hydroxylase,TH)、磷酸化蛋白激酶B(phosphorylase B kinase,p-AKT)抗体(美国Cell Signaling Technology公司,货号58844、4685);离子钙接头蛋白抗原(ionized calcium bindingadapter molecule 1,Iba-1)、精氨酸酶-1(Arginase-1,Arg-1)、诱导型一氧化氮合酶(inductible nitric oxide synthase,iNOS)、驴抗小鼠IgG Alexa Fluor®647、驴抗兔IgG Alexa Fluor®555抗体(英国Abcam公司,货号ab5076、ab96183、ab49999、ab150107、ab150074);驴抗山羊IgG Alexa FluorTMPlus 488抗体(美国invitrogen公司,货号A32814);β-actin抗体(南京Bioworld公司,货号AP0060);辣根过氧化物酶(Horse Radish Peroxidase,HRP)羊抗兔IgG(武汉BOSTER生物工程有限公司,货号BA1055)。多功能酶标仪(美国Molecular Devices公司,型号SpectraMax Plus384),凝胶成像仪(美国Azure Biosystems公司,型号C300),荧光显微镜(德国Leica公司,型号DM4000B)。
1.1.3 动物分组、造模及给药 按照随机分配原则将小鼠分成三组:正常组、MPTP组和MPTP+金丝桃苷组,每组10只。除正常组外,其余小鼠腹腔注射MPTP建立帕金森病模型,每日1次,连续注射7天,注射剂量参考课题组前期实验[4-5]。将金丝桃苷与聚乙二醇400按5 mg∶100μL的比例,于37℃超声30分钟溶解,再用生理盐水稀释至所需用量,现用现配。自MPTP注射第1天起,金丝桃苷组小鼠每日腹腔注射25 mg/kg的金丝桃苷溶液,每只0.2 mL,共注射2周。
1.1.4 Western blot检测TH蛋白表达 使用10%水合氯醛腹腔注射麻醉小鼠,生理盐水灌注后取脑,脑组织加入蛋白裂解液在冰上研磨并裂解30分钟,在12000 g,4℃条件下离心15分钟,取上清液,使用二喹啉甲酸(Bicinchoninic acid,BCA)法测定蛋白浓度。每孔加30μg蛋白样品,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离后,200 mA湿转2小时至聚偏氟乙烯(poly vinylidene fluoride,PVDF)膜,室温下使用5%脱脂牛奶封闭45分钟,使用TH(1∶2000)和β-actin(1∶5000)4℃孵育过夜。次日,使用加入Tween-20的Tris缓冲液洗膜后,用HRP羊抗兔IgG(1∶5000)室温孵育2小时,使用ECL化学发光液显影,条带灰度值使用Image J软件进行分析。
1.1.5 ELISA检测TNF-α和IL-1β蛋白含量 使用10%水合氯醛腹腔注射麻醉小鼠,冰上快速分离脑组织,称重后加入9倍质量的生理盐水,冰上研磨后3000 r/15分钟,离心取上清液,用ELISA法检测小鼠脑组织上清液中TNF-α和IL-1β蛋白含量。
1.1.6 免疫荧光检测小鼠脑组织Arg-1、iNOS、Iba-1和p-AKT表达 使用10%水合氯醛腹腔注射麻醉小鼠,先使用生理盐水,再使用4%多聚甲醛灌注后取脑,脑组织在4%多聚甲醛中固定4小时后浸入30%蔗糖溶液中脱水48小时,脑组织沉底后取出,吸干表面水分,使用包埋剂包埋脑组织,用液氮速冻组织,使用冰冻切片机进行切片,切片厚度为10μm。先使用5%BSA封闭冰冻切片,后使用Arg-1、iNOS、Iba-1和p-AKT一抗(1∶500)在4℃条件下孵育过夜,次日洗涤后使用荧光二抗(1∶500)室温孵育切片2小时,甘油封片后于荧光显微镜下观察,使用Image J软件进行光密度分析。
1.2 金丝桃苷对LPS诱导的BV2细胞的极化的调节作用研究
1.2.1 实验细胞 BV2细胞购买于北纳生物,使用含10%FBS的DMEM高糖培养基,置于37℃,5%CO2的细胞培养箱中培养,3天传代一次。
1.2.2 试剂与仪器 金丝桃苷(分析标准品,≥98%,北京索莱宝科技有限公司,货号SH8310),LPS(北京索莱宝科技有限公司,货号L8880);TNFαELISA试剂盒,IL-1βELISA试剂盒(上海酶联生物科技有限公司,货号ml002095、ml301814);AKT、p-AKT抗体(美国Cell Signaling Technology公司,货号4060、4685);APC-CD16/32和PE-CD206抗体(美国BioLegend公司,货号101325、141705);βactin抗体(南京Bioworld公司,货号AP0060);HRP羊抗兔IgG(武汉BOSTER生物工程有限公司,货号BA1055)。多功能酶标仪(美国Molecular Devices公司,型号SpectraMax Plus384),凝胶成像仪(美国Azure Biosystems公司,型号C300),流式细胞仪(美国BD公司,型号BD Accuri C6 Plus)。
1.2.3 细胞分组、造模及给药 BV2细胞分为正常组、LPS组和金丝桃苷组。LPS组使用1μg/mL的LPS刺激BV2细胞24小时,建立BV2细胞的炎症模型,金丝桃苷组使用1μg/mL的LPS刺激BV2细胞24小时后,再使用浓度为20μg/mL的金丝桃苷干预24小时[7]。
1.2.4 流式细胞术检测BV2细胞CD206、CD16/32阳性细胞比例 BV2细胞以1.5×106个/mL的密度接种于6孔板,用LPS刺激24小时后再加入金丝桃苷处理24小时后刮下细胞,离心后使用CD206、CD16/32抗体避光室温染色20分钟,洗涤3次后使用流式细胞仪检测CD206、CD16/32阳性细胞比例。
1.2.5 ELISA检测TNF-α和IL-1β蛋白含量 BV2细胞以1.5×106个/mL的密度接种于6孔板,用LPS刺激24小时后再加入金丝桃苷处理24小时后,取各组BV2细胞上清液;用ELISA检测各组BV2上清液中TNF-α和IL-1β蛋白含量。
1.2.6 Western blot检测AKT与p-AKT表达 BV2细胞以1.5×106个/mL的密度接种于6孔板,用LPS刺激24小时后再加入金丝桃苷处理24小时,胰酶消化各组BV2细胞,离心后加入蛋白裂解液,置于冰上裂解30分钟后在12000 g、4℃条件下离心15分钟,取上清液,使用BCA法测定蛋白浓度。每孔加30μg蛋白样品,经10%SDS-PAGE电泳分离后,200 mA湿转2小时至PVDF膜,室温下使用5%脱脂牛奶封闭45分钟,细胞蛋白使用AKT、p-AKT(1∶2000)和β-actin(1∶5000),动物蛋白使用TH(1∶2000)和β-actin(1∶5000)4℃孵育过夜。次日,使用加入Tween-20的Tris缓冲液洗膜后,用HRP羊抗兔IgG(1∶5000)室温孵育2小时,使用ECL化学发光液显影,条带灰度值使用Image J软件进行分析。
1.3 统计学方法
采用GraphPad Prism 8.0软件进行统计学分析,实验数据为计量资料呈正态分布,且方差齐,以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较使用Tukey检验,P<0.05认为差异有统计学意义。
2 结果
2.1 金丝桃苷对小鼠脑TH蛋白表达的影响
Western blot结果显示,与正常组相比,MPTP组小鼠脑组织TH表达显著降低(P<0.01),而MPTP+金丝桃苷组小鼠TH表达显著增加(P<0.05)。表明金丝桃苷改善了帕金森病小鼠多巴胺能神经元的丢失。见表1、图1。
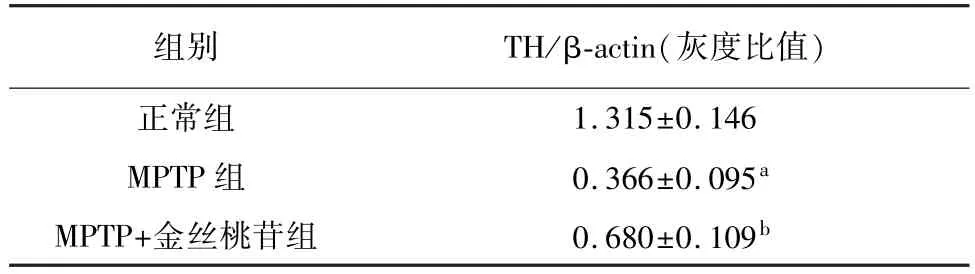
表1 各组帕金森模型小鼠脑TH蛋白相对表达比率

图1 各组帕金森模型小鼠脑TH蛋白表达
2.2 金丝桃苷对小鼠脑Iba-1/iNOS、Iba-1/Arg-1的免疫荧光表达和TNF-α、IL-1β蛋白含量的影响
免疫荧光结果显示,与正常组比较,MPTP组小鼠脑黑质纹状体区Iba-1/Arg-1双阳性细胞数量显著降低(P<0.01),而Iba-1/iNOS双阳性细胞显著增加(P<0.01)。与MPTP组比较,金丝桃苷+MPTP组小鼠脑黑质纹状体区Iba-1/Arg-1双阳性细胞显著增加(P<0.05),而Iba-1/iNOS双阳性细胞显著减少(P<0.01)。ELISA结果显示,与正常组比较,MPTP组小鼠脑TNF-α、IL-1β蛋白含量显著升高(P<0.05,P<0.01)。与MPTP组比较,MPTP+金丝桃苷 组小鼠脑TNF-α、IL-1β蛋白含量显著降低(P<0.01,P<0.01)。表明金丝桃苷能够调节帕金森病小鼠小胶质细胞由M1型向M2型极化,改善炎症反应。见表2、3,图2。

图2 各组帕金森模型小鼠脑炎症因子表达和脑黑质纹状体区Iba-1、Arg-1、iNOS共染
表2 各组帕金森模型小鼠黑质纹状体区Iba-1/Arg-1和Iba-1/iNOS双阳性细胞数比较(n=6,±s)

表2 各组帕金森模型小鼠黑质纹状体区Iba-1/Arg-1和Iba-1/iNOS双阳性细胞数比较(n=6,±s)
注:与正常组相比,a P<0.01;与MPTP组相比,b P<0.05,c P<0.01。
组别 Iba-1+Arg-1+细胞数(个)Iba-1+iNOS+细胞数(个)28.67±5.51 5.67±2.52 MPTP组 5.33±3.06a 27.33±5.03a MPTP+金丝桃苷组 20.33±3.51b 11.67±2.52正常组c
表3 各组帕金森模型小鼠脑匀浆炎症因子含量比较(n=6,±s)
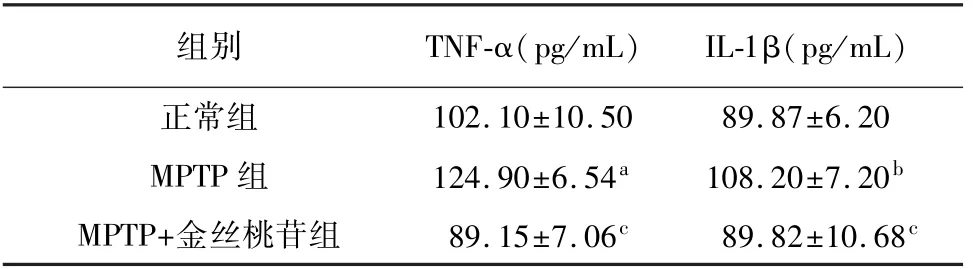
表3 各组帕金森模型小鼠脑匀浆炎症因子含量比较(n=6,±s)
注:与正常组相比,a P<0.05,b P<0.01;与MPTP组相比,c P<0.01。
组别 TNF-α(pg/mL) IL-1β(pg/mL)102.10±10.50 89.87±6.20 MPTP组 124.90±6.54a 108.20±7.20b MPTP+金丝桃苷组 89.15±7.06c 89.82±10.68正常组c
2.3 金丝桃苷对小鼠Iba-1/p-AKT免疫荧光表达的影响
免疫荧光结果显示,与正常组比较,MPTP组小鼠脑黑质纹状体区Iba-1/p-AKT双阳性细胞的比例显著降低(P<0.05)。与MPTP组比较,MPTP+金丝桃苷 组小鼠脑黑质纹状体区Iba-1/p-AKT双阳性细胞的比例显著升高(P<0.05)。表明金丝桃苷能够增加帕金森病 小鼠脑黑质纹状体区小胶质细胞的p-AKT蛋白表达。见表4、图3。

图3 各组帕金森模型小鼠脑黑质纹状体区Iba-1和p-AKT共染
表4 各组帕金森模型小鼠黑质纹状体区Iba-1/p-AKT双阳性细胞比例比较(n=6,±s)
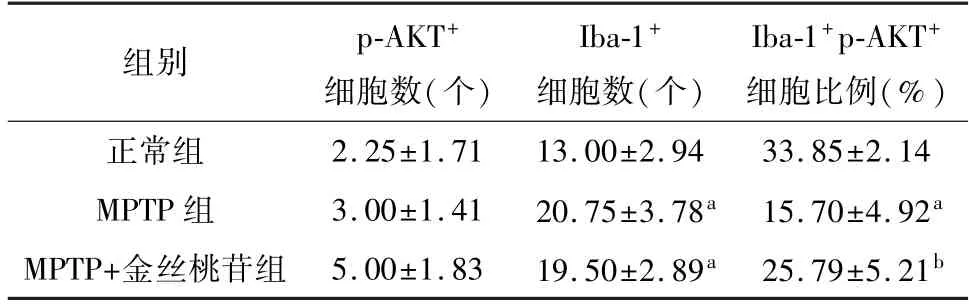
表4 各组帕金森模型小鼠黑质纹状体区Iba-1/p-AKT双阳性细胞比例比较(n=6,±s)
注:与正常组相比,a P<0.05;与MPTP组相比,b P<0.05。
组别 p-AKT+细胞数(个)Iba-1+细胞数(个)Iba-1+p-AKT+细胞比例(%)2.25±1.71 13.00±2.94 33.85±2.14 MPTP组 3.00±1.41 20.75±3.78a 15.70±4.92a MPTP+金丝桃苷组 5.00±1.83 19.50±2.89a 25.79±5.21正常组b
2.4 金丝桃苷对BV2细胞CD16/32和CD206阳性细胞比率和TNF-α、IL-1β蛋白含量的影响
流式细胞检测结果显示,与正常组比较,LPS组BV2细胞CD16/32阳性细胞比例显著上升(P<0.01),CD206蛋白表达显著降低(P<0.01)。与LPS组比较,金丝桃苷组BV2细胞CD16/32阳性细胞比例显著下降(P<0.01),CD206蛋白表达显著上升(P<0.05)。ELISA结果显示,与正常组比较,LPS组BV2细胞上清液中TNF-α、IL-1β蛋白含量显著升高(P<0.01)。与LPS组比较,金丝桃苷组BV2细胞上清液TNF-α、IL-1β蛋白含量显著降低(P<0.01,P<0.05)。表明金丝桃苷可减轻LPS诱导的BV2细胞的炎症反应,调节细胞极化。见图4,表5、6。
表5 各组BV2细胞CD16/32阳性细胞和CD206阳性细胞比例比较(n=3,±s)
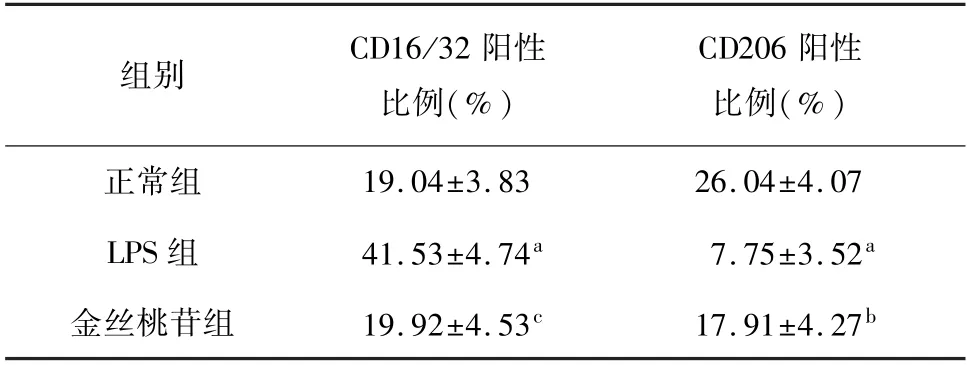
表5 各组BV2细胞CD16/32阳性细胞和CD206阳性细胞比例比较(n=3,±s)
注:与正常组相比,a P<0.01;与LPS组相比,b P<0.05,c P<0.01。
组别 CD16/32阳性比例(%)CD206阳性比例(%)19.04±3.83 26.04±4.07 LPS组 41.53±4.74a 7.75±3.52a金丝桃苷组 19.92±4.53c 17.91±4.27正常组b

图4 各组BV2细胞上清液中炎症因子表达和CD16/32、CD206阳性细胞比例
表6 各组BV2细胞上清液炎症因子含量比较(n=3,±s)
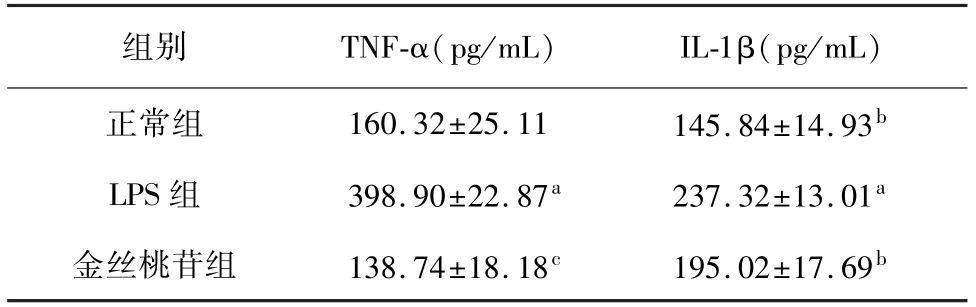
表6 各组BV2细胞上清液炎症因子含量比较(n=3,±s)
注:与正常组相比,a P<0.01;与LPS组相比,b P<0.05,c P<0.01。
组别 TNF-α(pg/mL) IL-1β(pg/mL)正常组 160.32±25.11 145.84±14.93 b LPS组 398.90±22.87a 237.32±13.01a金丝桃苷组 138.74±18.18c 195.02±17.69 b
2.5 金丝桃苷对BV2细胞AKT、p-AKT表达的影响
与正常组比较,LPS组BV2细胞p-AKT/AKT的表达显著降低(P<0.01);与LPS组比较,金丝桃苷组BV2细胞中p-AKT/AKT的表达显著升高(P<0.01),表明金丝桃苷能够增加LPS诱导的BV2细胞的p-AKT蛋白表达。见表7、图5。
表7 各组BV2细胞p-AKT/AKT蛋白相对表达比率(n=3,±s)

表7 各组BV2细胞p-AKT/AKT蛋白相对表达比率(n=3,±s)
注:与正常组相比,a P<0.01;与LPS组相比,b P<0.01。
组别 p-AKT/AKT(灰度比值)1.207±0.054 LPS组 0.489±0.069a金丝桃苷组 0.671±0.051正常组b
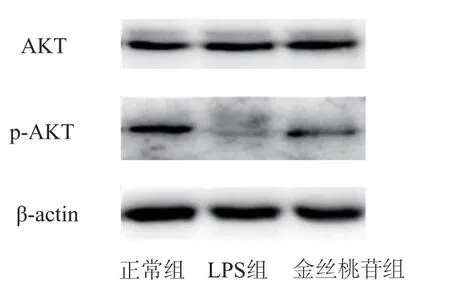
图5 各组BV2细胞AKT、p-AKT蛋白表达
3 讨论
目前,帕金森病的发病机制尚不明确。众多研究认为,帕金森病的发生是环境因素、氧化应激、炎症等因素共同作用的结果。神经炎症反应对帕金森病的发生发展具有不容忽视的作用。小胶质细胞是定居在中枢神经系统的巨噬细胞,通过分泌细胞因子和吞噬功能发挥固有免疫作用,小胶质细胞介导的炎性反应是中枢神经系统炎症反应的重要来源[8]。当组织受损或病原体入侵时,小胶质细胞会被激活并向不同的表型分化,发挥不同的作用。M1型小胶质细胞是促炎型细胞,高表达iNOS和CD16/32,吞噬能力较弱,并释放TNF-α、IL-1β等炎症因子;M2型小胶质细胞是抗炎型小胶质细胞,高表达Arg-1和CD206,吞噬能力较强,并释放IL-10等抗炎细胞因子[9-10]。研究发现,帕金森病患者血液、纹状体和脑脊液中的炎性细胞因子水平较正常人群显著增加[11-13]。同时,帕金森病患者的纹状体和嗅球中也存在大量活化的小胶质细胞,主要表型为M1型[14-15]。而促进小胶质细胞由M1型向M2型转化,能够减轻中枢神经炎症,保护多巴胺神经元,改善运动功能紊乱[16]。因此,靶向小胶质细胞M1向M2转化,进而抑制其介导的神经炎症反应,是保护多巴胺神经元的有效方案之一。
金丝桃苷是一种黄酮类化合物,在帕金森病模型中被证实具有多巴胺神经保护作用和抗炎抗氧化作用。Seung-Hwan Kwon等[17]研究发现,金丝桃苷能够通过激活Nrf2/HO-1通路保护6-OHDA诱导的SY5Y细胞的损伤。Wang Kai等[18]研究发现金丝桃苷通过激活MPTP诱导的帕金森病小鼠模型中的PACAP-CREB途径减弱NLRP3炎性体介导的神经炎症。但金丝桃苷能否调节帕金森病模型中小胶质细胞的极化从而治疗帕金森病仍是未知。MPTP是一种神经毒素,能够透过血脑屏障,随后被单胺氧化酶B代谢为1-甲基-4-苯基吡啶(1-methyl-4-phenylpyridine,MPP+),MPP+会被多巴胺转运体错误识别并转运进入多巴胺能神经元线粒体,与线粒体复合物I结合,随后阻断线粒体呼吸链,最终导致细胞死亡,因此被广泛用于帕金森病的研究[16]。本研究首先使用金丝桃苷干预MPTP诱导的帕金森病小鼠模型,结果显示金丝桃苷能够显著减少帕金森病小鼠黑质纹状体多巴胺能神经元的丢失,且显著减少了小胶质细胞M1型(Iba-1+iNOS+)的数量,增加了M2型(Iba-1+Arg-1+)的数量,并降低了炎性细胞因子的表达,表明金丝桃苷能够促进小胶质细胞由M1型向M2型转化,进而抑制中枢神经炎症。
PI3K/AKT/mTOR通路调节巨噬细胞的存活,迁移和扩散,但也协调响应巨噬细胞中的不同代谢和炎症信号。PI3K/AKT/mTOR通路可被TLR4、Fc受体、细胞因子等激活,进而激活下游信号分子产生细胞因子[19]。激活或过表达AKT激酶可减少小胶质细胞的活化;AKT激活可促进小胶质细胞M2型编码基因的上调[20]。此外,抑制AKT2可以减少巨噬细胞的吞噬作用[21]。动物实验显示金丝桃苷显著提高了帕金森病小鼠小胶质细胞AKT的磷酸化水平,这表明金丝桃苷调节小胶质细胞极化或许与促进AKT蛋白磷酸化有关。
为了进一步明确金丝桃苷促进小胶质细胞极化的作用,在证实金丝桃苷对帕金森病小鼠的治疗作用后,课题组使用金丝桃苷干预LPS诱导的BV2细胞炎症模型。BV2细胞是一种永生化小胶质细胞系,实验中常用LPS诱导BV2细胞活化模拟中枢神经小胶质细胞炎症反应。课题组的研究结果显示,金丝桃苷显著抑制了LPS诱导的BV2细胞M1型标记物CD16/32的表达,并促进M2型标记物CD206的表达,ELISA结果显示金丝桃苷显著减少了促炎细胞因子TNF-α和IL-1β的蛋白含量。此外,Western blot结果金丝桃苷显著增强了LPS诱导的BV2细胞AKT蛋白的磷酸化水平。这些结果表明,金丝桃苷能够靶向小胶质细胞表型由M1型转化为M2型,减轻小胶质细胞介导炎症反应,其作用机制可能与促进AKT蛋白磷酸化有关。
综上所述,研究证实金丝桃苷能够调节小胶质细胞极化,减轻小胶质细胞炎症反应,可能与其激活AKT信号有关,为金丝桃苷治疗帕金森病的机制研究提供了新思路。但金丝桃苷对于小胶质细胞吞噬能力及整个AKT信号通路的影响还有待进一步研究。
