乳腺浸润性导管癌超声弹性成像评分及其与血清SF、CT、CA153、CEA、Hcy 水平的相关性研究
2022-08-26李红波郭桂兰
李 臻,李红波,郭桂兰
(郴州市第一人民医院超声医学中心,湖南郴州423000)
0 引言
乳腺癌的发病率正逐年攀升,在中国每年以3%~5%的速度增长,已经成为威胁我国女性生命健康的主要疾病之一[1]。乳腺浸润性导管癌(invasive ductal
作者简介:李 臻(1985—),男,主治医师,主要从事心血管及甲状腺、乳腺浅表超声诊断方面的研究工作。
通信作者:李红波,E-mail:lihongbo64@163.com carcinoma,IDC)是乳腺癌中常见的病理分型,该类型乳腺癌的癌细胞分化程度低,一般预后较差[2]。目前,临床主要通过体检以及常规超声和钼靶X 射线等方法来筛查乳腺癌,但上述方法也存在不足,如常规体检触诊只能判断基本的症状,对于肿瘤的性质无法鉴别,误诊率高;常规超声对于具有良性肿瘤声像图表现的恶性病灶的诊断也具有一定困难;钼钯检查具有放射性危害。近年来,超声弹性成像(ultrasonic elastography,UE)发展迅速,其利用IDC 在分子水平发生的微观结构变化来反映病灶组织的弹性和硬度等病理改变。UE 在常规超声的基础上对图像进行处理,提高了诊断准确率。但单纯的影像学检查并不足以鉴别肿瘤的良恶性,故学者们将乳腺癌的影像学研究与分子生物学相结合,并取得了一定的成果[3]。血清肿瘤标志物检测是恶性肿瘤早期常用的筛查方法,包括血清铁蛋白(SF)、降钙素(CT)、糖类抗原153(CA153)、癌胚抗原(CEA)、同型半胱氨酸(Hcy)等,但上述指标单独检测诊断效能较低,临床上通常联合影像学检测来提高诊断效能[4]。本文对IDC 患者的超声弹性成像表现及上述血清学指标进行分析,以期为IDC 的早期诊断及预后提供参考。
1 资料与方法
1.1 一般资料
回顾性选取2019 年4 月至2021 年10 月我院收治的164 例乳腺肿瘤患者,将92 例经术后病理确诊为IDC 的患者设为IDC 组,均为女性,年龄43~74岁,平均年龄(52.4±9.6)岁,病灶最大直径范围8~34.2 mm,平均病灶最大直径(18.2±5.7)mm;72 例乳腺良性病变者设为对照组,均为女性,年龄35~76岁,平均年龄(48.4±10.1)岁,病灶最大直径范围6~30.5 mm,平均病灶最大直径(15.2±6.1)mm。2 组患者的性别、年龄、病灶最大直径等一般资料的差异无统计学意义(P>0.05)。纳入标准:(1)所有患者均经手术治疗且经术后病理确诊;(2)术前行常规超声及超声弹性成像检查,临床资料完整;(3)术前无任何治疗史;(4)乳腺单侧病灶。排除标准:(1)合并心、肺、脑、肝、肾等系统严重疾病及重要脏器功能障碍者;(2)既往有肿瘤史;(3)乳腺内有假体及备孕期、妊娠期和哺乳期妇女。本研究经本院伦理委员会批准。
1.2 方法
1.2.1 影像学检查
采用GE(美国)生产的LOGIQ E9 多普勒超声诊断仪,配置ML6-15-D 高频探头(频率6~15 MHz),并采用ElaXto 超声弹性成像软件进行图像分析。嘱患者取仰卧位,双手上举过头顶,使双侧乳房及腋窝充分暴露后行超声检查。(1)常规超声检查。在乳房表面行放射状探查,观察并记录病灶方位、大小、形态、边界情况、内部回声、有无钙化灶及血供等特征,根据乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)分级标准进行评估[5]。(2)UE 检查。切换至UE 模式,将探头轻置于皮肤表面,调整感兴趣区为病灶大小的2~3 倍,使之包含病灶及病灶附近的部分腺体组织,通过改变施加在探头上的压力获取稳定清晰的超声弹性图像,最后保存图像并记录患者的弹性评分。评分标准采用Itoh改良五分法[6]:1 分,病灶区域及周围组织全部覆盖绿色;2 分,病灶区域主要覆盖绿色,间有少许蓝色;3 分,病灶区域主要覆盖蓝色,间有少许绿色;4 分,病灶区域以蓝色为主;5 分,病灶区域及周边组织全部覆盖蓝色。1~5 分代表硬度由软至硬。UE 评分<4分判定为良性病变,≥4 分判定为恶性病变。
1.2.2 血清学检测
所有受试者于晨起空腹抽取外周静脉血5 mL,将标本于室温静置2~4h 后离心(离心机转速3000r/min),离心10min 后收集血清2mL 置于-20°C 贮存待检测。采用化学发光免疫分析法测定血清中SF、CT、CA153、CEA、Hcy 的含量。检测仪器:罗氏(瑞士)Cobas e601全自动电化学发光免疫分析仪。人SF 试剂盒、人CT试剂盒、人CA153 试剂盒、人CEA 试剂盒、人Hcy试剂盒均购于北京杰辉生物技术有限公司,实验步骤均严格依照说明书进行。
1.3 统计学方法
采用SPSS 25.0 统计学软件进行数据处理,计量资料采用均数±标准差(x¯±s)表示,2 组间均数比较应用t 检验;计数资料采用n(%)表示,组间比较应用卡方检验;应用Pearson 相关分析法进行因素间相关性分析。绘制ROC 曲线,计算AUC 值,以评估不同指标的诊断价值。P<0.05 为差异具有统计学意义。
2 结果
2.1 2 组患者常规超声特征比较
经常规超声检查发现IDC 组(92 例)中病灶≥2 cm 的有73 例、边界不清的有76 例、形态不规则的有81 例、内部回声不均的有64 例、微小钙化灶的有37 例、血流分级≥Ⅱ级的有80 例,对照组(72 例)中病灶≥2 cm 的有33 例、边界不清的有15 例、形态不规则的有21 例、内部回声不均的有24 例、微小钙化灶的有7 例、血流分级≥Ⅱ级的有10 例,2 组相比差异具有统计学意义(P<0.05),见表1。ROC 曲线分析显示,常规超声诊断IDC 的AUC 值为0.749(95%CI:0.674~0.825),敏感度为71.2%,特异度为77.5%,诊断准确率为74.6%,如图1 所示。
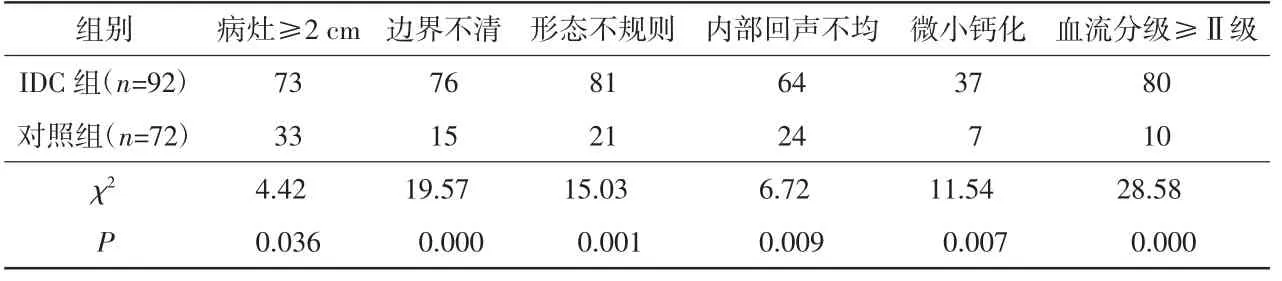
表1 2 组患者常规超声特征比较 单位:例
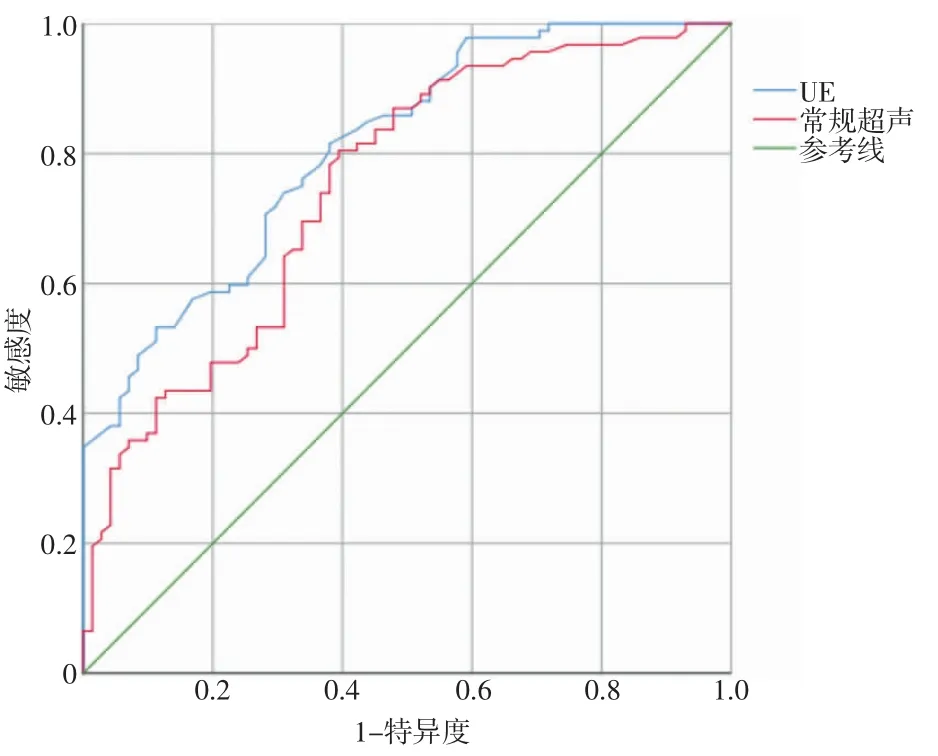
图1 常规超声和UE 诊断IDC 的ROC 曲线
2.2 2 组患者血清SF、CT、CA153、CEA、Hcy 水平比较
2 组患者血清标志物检测发现,IDC 组患者的SF、CT、CA153、CEA、Hcy 水平均显著高于对照组,差异具有统计学意义(P<0.05),见表2。

表2 2 组患者血清SF、CT、CA153、CEA、Hcy 水平比较(x¯±s)
2.3 IDC 组患者UE 评分与血清SF、CT、CA153、CEA、Hcy 水平的相关性分析
2 组患者UE 评分结果显示,IDC 组中UE 评分≥4 分的有75 例(81.5%),显著高于对照组的15例(20.8%),差异具有统计学意义(P<0.05),见表3。ROC 曲线分析显示,UE 诊断IDC 的AUC 值为0.810(95%CI:0.746~0.874),敏感度为81.5%,特异度为79.2%,诊断准确率为80.5%,如图1 所示。2 组患者UE 图像如图2、3 所示。通过对IDC 组患者的UE 评分与血清SF、CT、CA153、CEA、Hcy 水平进行Pearson相关性分析,结果显示UE 评分与血清SF、CT、CA153、CEA、Hcy 水平均呈正相关(r>0,P<0.05),见表4。

表4 IDC 组患者UE 评分与血清SF、CT、CA153、CEA、Hcy 水平的相关性分析(n=92)
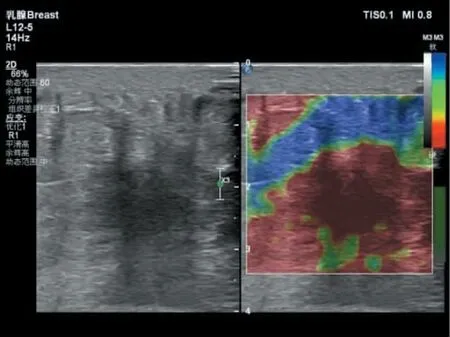
图2 IDC 组患者UE 图像

表3 2 组患者UE 评分比较[n(%)]
3 讨论
IDC 是乳腺癌中较为常见的一种类型,据研究统计[7],IDC 发病率占乳腺癌的80%以上,且近些年发病年龄趋向年轻化。因此,早期筛查、早期诊断和早期治疗对于IDC 患者具有重要意义。乳腺常规超声是筛查乳腺癌最常用的影像学方法,其具有操作简单方便、无创伤、价格低廉的优势,但是常规超声的假阳性率较高,导致许多良性病变患者进行了不必要的活检[8],而UE正好可以弥补这一不足。UE 是在常规超声的基础上对组织施加更多的压力,根据组织硬度与受到外力后的变形程度将组织受压前后的信号强度转变为实时弹性图像。研究认为,肿瘤的声像图表现与其肿瘤标志物有一定的相关性[9]。目前,国内外多项研究将影像学检查与肿瘤标志物检测联合应用于乳腺癌的诊断,提高了乳腺癌的诊断效能[10-11]。
本研究对IDC 患者进行了UE 检查及血清肿瘤标志物检测,并分析了两者之间的关系,认为两者之间存在一定相关性。IDC 组中UE 评分≥4 分的有75 例(81.5%),显著高于对照组的15 例(20.8%),说明IDC 组患者的病灶硬度更高。研究显示[12],IDC 患者的UE 评分与组织学分级呈正相关,即病灶恶性程度越高,则UE评分越高。ROC 曲线分析显示,UE 和常规超声诊断IDC 的AUC 值分别为0.810 和0.749,虽然两者均超过0.7,具有一定的诊断效能,但UE 诊断IDC 的敏感度显著高于常规超声(81.5%vs 71.2%),这可能与IDC 的组织硬度有关,恶性肿瘤纤维细胞大量增殖,间质密度大,而良性病灶内黏多糖成分多,乳腺结构疏松,硬度明显低于IDC[13]。UE 不仅具备常规超声的特征,还能从乳腺肿物的软硬程度以及大小等方面提供更加直观、准确的诊断信息,提高了诊断的准确率。
SF 的主要功能是调节铁代谢,而恶性肿瘤可以促进SF 异构体的生成与分泌,从而导致血清SF 水平显著上升。本研究中,IDC 组患者SF 水平显著高于对照组,这与Von Holle 等[14]的研究结果一致。研究报道[15],当恶性肿瘤患者体内的铁含量还未变化时,就能检测出SF 水平呈升高趋势,因此,监测IDC 患者的SF 水平对于评估病情具有重要意义。除此之外,本研究中IDC 组患者CT、CA153、CEA、Hcy 水平均显著高于对照组。CT 是人体滤泡旁C 细胞分泌的一种激素,CT升高主要见于乳腺癌、肺癌等导致的内分泌综合征。研究显示[16-17],乳腺癌发生骨转移时,CT 水平显著升高,且随病情进展升高更加明显。CA153 是乳腺癌诊断特异性较高的肿瘤标志物之一,当细胞癌变时,细胞内的糖化转移酶激活,使CA153 水平升高,且不同分期的乳腺癌患者CA153 水平也有差异。CA153 已被证实为是能够独立预测乳腺癌复查的因子,对于晚期病情评估具有重要价值,但其对于早期乳腺癌诊断的灵敏度较低。Lian 等[18]发现,乳腺癌患者CA153水平显著高于乳腺良性肿瘤,且与肿瘤大小和临床分期有关,这与本研究结果相似。CEA 是存在于人体内胚层肿瘤细胞内的酸性糖结构蛋白,作为一种广谱肿瘤标志物,有15%~50%的乳腺癌患者呈现阳性[19]。CEA 水平与乳腺癌恶化程度存在相关性,肿瘤恶性程度越高则CEA 水平越高。研究显示[20],在年轻患者和复发患者中CA153 升高明显,但在老年患者和雌激素受体阳性患者中则是CEA 升高明显。除了上述常规的肿瘤标志物,近年来发现Hcy 具有细胞毒性、基因毒性和神经毒性,可能在IDC 的发生发展过程中起重要作用。研究报道[21],高水平Hcy、长期叶酸不足与罹患乳腺癌风险高度相关,因此,监测Hcy 水平对于诊断IDC 具有重要价值。本研究结果显示,IDC患者的UE 评分与血清SF、CT、CA153、CEA、Hcy 水平均呈正相关,即IDC 患者血清肿瘤标志物水平越高,可能UE 评分也越高。本文推测这与病情发展程度有关,IDC 患者的临床分期越晚、组织学分级越差,则病灶硬度越大,其血清肿瘤标志物水平也越高。研究显示[22],UE 评分与IDC 患者的肿瘤分级、淋巴结转移以及Ki67 表达情况相关,这与本研究猜想一致。这提示我们对于早期诊断IDC 灵敏度较低的肿瘤标志物,可以结合UE 检查以提高诊断效能。
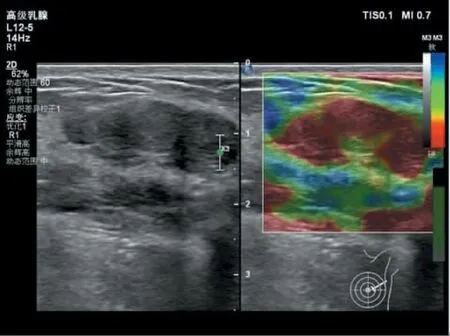
图3 对照组患者UE 图像
综上所述,IDC 患者的UE 评分与血清SF、CT、CA153、CEA、Hcy 表达水平相关,血清肿瘤标志物水平可以帮助临床工作者更好地理解影像学征象,两者结合可为IDC 的早期诊断与病情评估提供重要参考价值。由于本研究病例数和研究时间的局限性,且未对IDC 的不同组织分级进行分析,数据存在偏倚可能,有待进一步深入研究。
