哈萨克斯坦褐煤腐植酸与金属离子的相互作用
2022-08-26DauletbaySerikbayevKhKamysbayevKudreeva著尹玉婷侯翠红关红玲
A. Dauletbay,B. A. Serikbayev,D. Kh. Kamysbayev,L. K. Kudreeva 著尹玉婷 侯翠红* 关红玲 译
1 哈萨克斯坦阿里-法拉比国立大学化学与化学工程系 哈萨克斯坦阿拉木图 050012
2 郑州大学化工学院 郑州 450001
腐植酸(HA)结构中存在给电子官能团,> C=O、-COOH、-C-OH、ArOH、-NH-、-NH2,在与金属阳离子的相互作用过程中,金属阳离子的各种组合和自由轨道有助于形成配位化合物。造成这种结果的机理为:离子交换,与给电子官能团的络合作用;由于HA 表面自由π 电子的存在,金属离子与腐植酸络合形成Men+-HA。
腐植酸的络合性能受结构(功能)特征、高分子内部的介观效应和诱导效应、酸碱特性、体系的一般理化特性等多种因素的影响。
Murugan 等人研究了各种碳化合物制备不同结构的电化学传感器的应用。从天然来源获得的碳材料催化性能是完全可替代的。腐植酸是从含有碳水化合物、氨基酸、脂类、羧酸和醇、醛、酮和醌以及醚等官能团的天然资源中获得的。腐植酸具有亲水性和亲脂性,因此它可以成胶束状结构,称为伪胶束。Zhou 等人也发现腐植酸和金属离子形成络合物获得纳米粒子,从而使得它们在电催化体系中具有重要应用。
研究不同来源的HA 与铜离子的相互作用。研究结果表明,铜的吸附量取决于腐植酸的功能和结构组成以及介质的pH 值,几种机制对吸附过程有不同程度的影响。阳离子Fe(III)与腐植酸类物质(HS)的相互作用表明,取代芳环侧链上的羧基和含氧烷基最有可能参与其中的反应,它们以能结合多种金属和类金属而闻名,其中包括可致毒的元素如稀土元素,Al(III),Pb(II),Ca(II),Mn(II),Mg(II),Fe(III)和少量As(V),As(III),Sb(V),Sb(III)。含氧官能团(羧基、酚基、羰基)的表面密度较大,而含氮或含硫官能团的表面密度较小,因而导致HS 的结合能力较高。
许多研究者认为,腐植酸类物质结构的复杂性给其性质的研究带来了一定的困难,这也是对腐植酸类物质解释模糊的原因。因此,研究人员做出了一个关于Cu2+和腐植酸类物质复合的严谨假设,并强调在腐植酸吸附铜阳离子的过程中,有几种机制在不同程度上起作用。
本研究的目的是利用红外光谱、分光光度法和循环伏安法研究重金属离子(Fe3+、Cu2+、Ni2+、Co2+)与从哈萨克斯坦埃基巴斯图兹盆地的褐煤中分离出来的腐植酸的相互作用,并建立相互作用机制。
1 实验部分
1.1 试剂
FeCl3,CuSO4,NiSO4,CoSO4,Na2SO4,NaOH,HCl 和H2SO4,这些试剂均购自Lapborpharma化学试剂贸易公司(哈萨克斯坦阿拉木图);5%Nafion 溶液(全氟磺酸基聚合物溶液),购自Sigma-Aldrich 和Merck KgaA(德国达姆施塔特);实验中使用水都是双蒸馏水,所有的试剂和化学品都是分析纯。
金属盐的储备溶液(0.1 mol/L)是通过将适量的金属盐溶解于双蒸馏水中制备而成。用硫酸固定工作电解液的pH 值。
1.2 腐植酸的合成
腐植酸类物质来自埃基巴斯图兹盆地开采的褐煤。为获得腐植酸并研究其理化性质,我们采用了“亚洲康宝资源”公司的腐植酸钠样品。使用氢氧化钠处理和盐酸沉淀的方法分离出腐植酸。最初的样本小心保存在瓷质研钵中,用热蒸馏水清洗,放入离心玻璃管中,然后以每5 g 样品50 mL 的比例,加入0.1 mol/L 盐酸溶液。接着,该悬浮液用磁力搅拌器搅拌30 min,离心20 min。在这种情况下,盐和碳水化合物进入溶液。离心后,将沉淀物置于薄型分段式烧瓶中,并溶解在0.1 mol/L 的氢氧化钠溶液中。然后,在搅拌条件下,溶液持续通入氮气,密闭24 h 提取黄腐酸和腐植酸。
在提取之后,悬浮液离心20 min,把溶液置于带有细长颈的烧瓶中,逐渐添加6 mol/L 的盐酸溶液,将pH 值调节至1.5,以将黄腐酸和腐植酸分离。通氮气,静置20 h 后,待规定时间后,离心20 min,将沉淀的腐植酸从液体中分离出来。用稀释溶液洗涤腐植酸沉淀物,在真空干燥器或烘箱中60 ~80 ℃下用P2O5干燥至恒重。
1.3 吸附性能、红外光谱和分光光度的研究
吸附实验在室温(25 ℃)下,在250 mL 的螺旋盖锥形瓶中进行。每次测试,从5%的HA 溶液中取出1 至12 mL 的12 种吸附剂剂量,分别放入装有100 mL 浓度为 10-3mol/L 的盐溶液(FeCl3、CuSO4、NiSO4、CoSO4)的烧瓶中。用实验室轨道振动筛将悬浮液振动300 min 后,静置24 h。在其搅拌均匀后,使用沃特曼1 号滤纸过滤,使用紫外-可见分光光度计和络合滴定法测定滤液浓度。用络合滴定法和分光光度法测定了初始溶液和腐植酸吸附后溶液中金属的定量含量。根据金属离子的初始浓度和残留浓度之差计算金属离子的吸附率。
过滤后的悬浮液在60 ~80 ℃的烘箱中干燥至恒重。干燥后样品送红外光谱仪测定红外光谱。
用NaOH 溶液制备5%的HA 溶液,用HCl固定pH 值至2.1。腐植酸溶液和金属离子以金属∶腐植酸的体积比为1 ∶1、2 ∶1、5 ∶1 和10 ∶1 的比例进行制样。获得这些溶液后,用滤纸过滤,用分光光度计研究滤液。
1.4 设备和方法
采用红外光谱、分光光度法、X 射线荧光分析和电位滴定法研究了腐植酸的性质。用Spectrum 65 傅里叶变换红外光谱仪记录样品与KBr 混合压片在450 ~4000 cm-1波数内的红外光谱。分光光度分析在安捷伦科技分光光度计上进行,波长范围为200 ~900 nm。
在自动电位仪系列PGSTAT101/M101 上进行了伏安测量。使用经典的三电极电池系统测量电压和电流。采用腐植酸和全氟磺酸复合体系的玻碳电极(GCE),银/氯化银(Ag/AgClE0=+0.222 V)的参比电极和玻碳电极的对电极进行电化学研究。在每次测量前,向溶液中持续通入氮气10 ~25 min,以去除溶解氧,保证数据采集的一致性。所有实验均在25 ℃的室温下进行。电位扫描范围从+0.7 V 或者+0.5 V 到-0.5 V,扫描速率为50 mV/s。
1.5 修饰电极的制备
将GCE 依次用1.0、0.3 和0.05 μm 的氧化铝浆料在丝绒上抛光。用蒸馏水冲洗残余氧化铝浆料,并将GCE置于无水乙醇和蒸馏水中用超声波(60 kHz,55 ℃)处理10 min。用红外线灯干燥清洗后的GCE。将腐植酸(10 mg)和Nafion 溶液(10 μL)在10 mL 无水乙醇中用超声波(60 kHz,55 ℃)分散30 min,以获得均匀悬浮液。将腐植酸(500 mg)和金属溶液(0.1 mol/L,10 mL)通过超声波(60 kHz,55 ℃)混合10 min,静置24 h。腐植酸-金属沉淀物用双蒸馏水洗涤,在真空干燥器或烘箱中60 ~80 ℃下用P2O5干燥至恒重。
通过将5 mL 悬浮液涂覆在预处理的GCE 上,然后用红外线灯干燥,制备腐植酸-Nafion(HN)和腐植酸-金属-Nafion(HMN)修饰电极。
2 结果与讨论
2.1 用络合滴定法、红外光谱法和分光光度法研究腐植酸与金属离子的相互作用
为了确定腐植酸吸附过渡金属离子的性质,研究了从埃基巴斯图兹盆地褐煤中提取的腐植酸与Fe3+、Cu2+、Ni2+、Co2+的相互作用。为了此项研究,以0.1 mol/L 的FeCl3、CuSO4、NiSO4、CoSO4为原液,采用10-3mol/L 溶液稀释模型进行模拟实验。
初始溶液和使用沃特曼1 号滤纸过滤含有腐植酸的悬浮液后的滤液中金属含量采用络合滴定法和光比色法测定,并根据金属离子初始浓度与残留浓度的差值计算金属离子的吸附率。
图1显示金属离子的吸附程度与腐植酸用量的关系。从图中可以看出,随着腐植酸浓度的增加,金属离子的吸附程度增加。铁(III)的吸附率最高(~90%),铜(II)的吸附率较低,镍(II)和钴(II)的吸附率更低。

图1 金属离子吸附率与HA 体积的关系Fig.1 Dependence of the metal ions’ absorption efficiency from the volume of HA
金属离子与腐植酸络合能力的强弱可以用Pearson 软硬酸碱理论来解释。硬酸是电子受体,其中受体的原子尺寸小,带有大量正电荷,电负性足够高,极化率低。最低的自由分子(MO)轨道(化学键形成的轨道)能量低。Fe(III)就是硬酸的一个实例。
软酸是大尺寸的受体粒子,带有极少正电荷,电负性低,极化率高。最低的自由分子轨道能量很高。软酸含有易极化的空轨道,由于离域或没有离子,原子的正电荷即电子受体很小。
硬碱即供体粒子具有高电负性和低极化率,占据最高的分子轨道,与受体轨道结合的能量最低(最接近原子核)。例如,一个氧原子。
硬酸需要硬碱才能成键,即络合作用的原理是硬酸与硬碱形成配位键,软酸与软碱形成配位键。在这方面,显然Fe3+离子与腐植酸的相互作用效果最好,腐植酸是被研究阳离子中更严格的酸(电荷+3)。铜离子的吸附量大于镍离子和钴离子的吸附量,但是镍离子和铜离子具有相同的电荷和相似的半径,分别为0.069 和0.073 nm,此现象难以用软硬酸碱理论来解释。这完全取决于Me-O 键的共价程度,铜离子(2.3 nm)的共价程度高于镍离子和钴离子(1.92 nm 和1.83 nm)。
所研究的腐植酸中活性羧基的存在决定了离子交换过程,这一点可以通过加入金属盐后溶液的酸度比初始时增加,以及溶液的pH 平均降低两个单位来证实。在这种情况下,羧基的质子按照以下方程式被交换为金属阳离子:2R—COOH + Me2+=(RCOO)2Me + 2H+。
红外光谱中1380~1400 cm-1(羧酸盐离子的对称振动)处可以吸附金属离子的特征峰带的出现也证明了离子交换过程的发生。在1700 ~ 1720 cm-1(C=O 振动)和1230 ~1260 cm-1(O-H 变形振动)区域,络合形成反应显示了吸收带的位移和强度的变化。这两个谱带与pH 值密切相关。随着Fe(III)的不断加入,羧酸盐基相关谱带的相对强度增加,羧酸基相关谱带的相对强度降低。这是由于羧酸与Fe(III)的络合作用以及羧酸基和羧酸盐基之间的平衡置换所致。此外,作为离子交换信号键的Me-O 吸收强度增加(图2)。
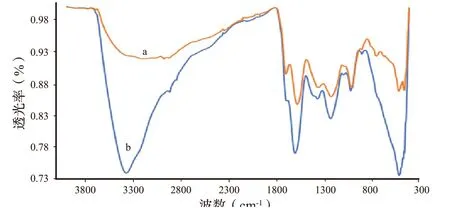
图2 腐植酸样品(a)和含Fe3+腐植酸样品(b)的红外光谱Fig.2 IR spectra of HA (a) and HA with Fe3+ (b)
对这些体系的分光光度研究也证实了腐植酸和Fe3+、Ni2+、Cu2+、Co2+的相互作用(图3 和图4)。图3 ~图5 显示了腐植酸(pH=2.1)及其溶液与金属离子在紫外和可见光区域的光谱,其中金属与腐植酸比例为1 ∶1、2 ∶1、5 ∶1 和10 ∶1。添加盐后,Fe3+、Ni2+、Cu2+、Co2+溶液pH 值分别为2.39、2.45、2.4、2.67。由图可知,随着阳离子浓度的增加,腐植酸在240 nm 处的峰值强度降低。这说明腐植酸与金属阳离子相互作用,导致游离腐植酸浓度降低。

图3 Fe3+及其与腐植酸溶液的分光光度曲线Fig.3 Spectrophotometric curves of Fe3+ ions and their solutions with humic acids
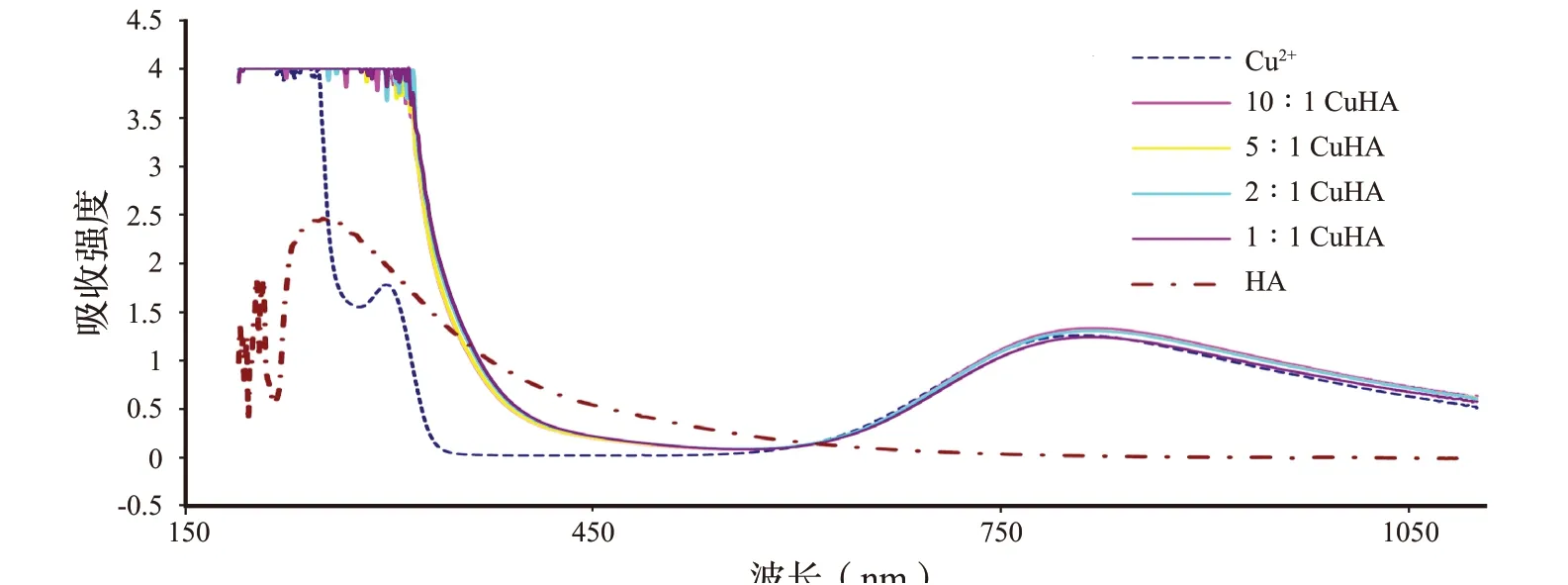
图4 Cu2+及其与腐植酸溶液的分光光度曲线Fig.4 Spectrophotometric curves of Cu2+ ions and their solutions with humic acids

图5 Ni2+及其与腐植酸溶液的分光光度曲线Fig.5 Spectrophotometric curves of Ni2+ ions and their solutions with humic acids
含腐植酸金属盐溶液中没有出现Ni2+(400 nm)和Cu2+(300 nm)的特征峰,这反映了金属盐与腐植酸的相互作用:随着阳离子浓度的降低,这些峰的强度降低。如我们所述,在所研究的金属阳离子中,Fe3+与HAs 的相互作用最强。与其他体系的光谱相比,在Fe3+-HA 体系的光谱上,在230 nm处出现了一个最高的新峰,可能对应于铁(III)与腐植酸的络合物。
因此,根据腐植酸对金属阳离子的吸附程度的数据、红外光谱法和分光光度法的分析结果,我们可以得出结论:Fe3+、Ni2+、Cu2+、Co2+与HA 的相互作用是通过给电子官能团的离子机制和络合机制实现的。
2.2 电化学研究
为了证实金属离子与腐植酸的相互作用,揭示金属-腐植酸体系的电化学特征,对Cu-腐植酸体系进行了电化学研究。
图6显 示了 在pH=3.5 的0.1 mol/L Na2SO4溶液中Cu(II)离子在腐植酸Cu2+溶液、腐植酸、Nafion 修饰的GCE 下获得的积分CVA 曲线结果。GCE 研究中使用的可见表面为S= 3.14×10-2cm2。线性扫描循环伏安图从阳极(+0.5 V)到阴极(-0.5 V/SCE)电位反复扫描,扫描速率为50 mV/s。工作电极的稳态电压Estart=-0.18 V。
在阴极方向从Estart到-0.5 V 范围内进行线性扫描。可观察到在E=-0.5 V 时出现时间延迟。在阳极方向进一步扫描到E=0.5 V。在这种情况下,铜的氧化在E=0.12 V 下进行(图6)。铜在水介质中的行为是从文献中得知的,其中铜的氧化波峰归因于Cu0到Cu+1的电化学转变,然后可以从Cu+1进一步氧化到Cu+2。从E=0.5 V 到E= -0.5 V的阴极反向CVA 过程中,也出现了对应于铜还原的K1、K2两个波峰。我们可以认为K1波峰是铜从Cu2+到Cu+1的还原,而K2波峰是铜从Cu2+到Cu0的还原。
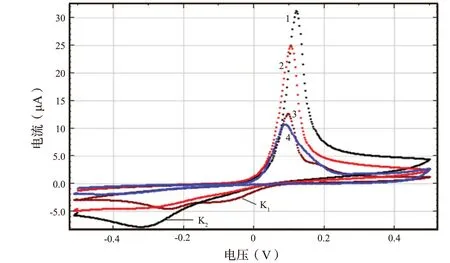
图6 Cu(II)(10-4 mol/L),0.1 mol/L Na2SO4(pH 3.5)溶液在用(1)CuHA;(2)HA;(3)Nafion;(4)GCE 修饰的玻碳电极下的线性扫描循环伏安图Fig.6 Linear sweep cyclic voltammetry of Cu (II) (10-4 mol/L) 0.1 mol/L Na2SO4 (pH 3.5) solution at glassy carbon electrodes modified with: (1) CuHA; (2) HA; (3) Nafion; (4) GCE
根据实验数据,可以测定在电解液存在铜离子的情况下,腐植酸修饰的GEM的电化学活性。此外,修饰后的腐植酸电极表面具有较高的灵敏度。
众所周知,电化学反应的氧化还原电位和速率取决于介质的酸度和电极的特性(电导率、比表面积)。
图7显示了在不同pH 值(pH=3.5、4.5、5.5、6.5)环境下,在10-4mol/L Cu2+存在下,在0.1 mol/L Na2SO4溶液中用Nafion 对腐植酸进行修饰的GCE 表面上获得的电化学研究结果。得到的积分CVA 曲线的形状显示,不同的pH 介质的数据具有显著差异。这些体系中,铜氧化峰的出现表明铜阳离子的形成,已知这些铜阳离子能够与腐植酸相互作用。
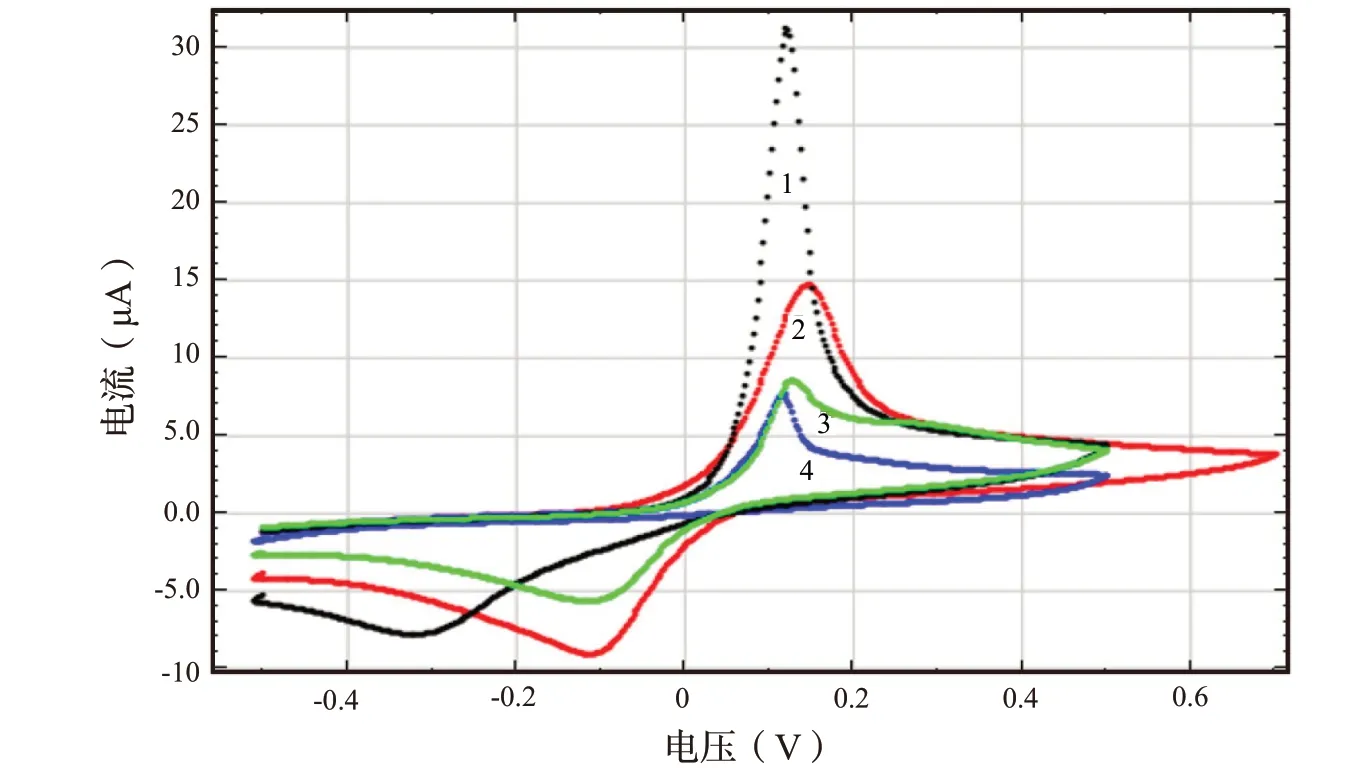
图7 铜(II)(10-4 mol/L)溶液在用CuHA-GCE 修饰的玻碳电极下的线性扫描循环伏安图Fig.7 Linear sweep cyclic voltammetry of Cu (II) (10-4 mol/L) solution at the CuHA-GCE
用铜离子(Cu2+)对腐植酸修饰的研究表明,从分散在大量腐植酸粉末表面的被固定下来的铜具有电化学活性。此外,这些颗粒处于稳定、有序的状态,这对于在修饰的玻碳电极上实现电催化反应具有重要意义。
3 结论
在腐植酸与重金属离子的体系中,最重要的反应过程是吸附和络合。结果表明,随着腐植酸浓度的增加,对金属离子的吸附量增加。腐植酸对铁(III)的吸附率最高(~90%),对铜(II)的吸附率较低,对镍(II)和钴(II)的吸附率更低。
红外光谱法和分光光度法测定的结果以及腐植酸对金属阳离子吸附程度的数据表明,它们通过给电子官能团-COOH、-C-OH、>C=O 发生相互作用,既有离子机制,又有络合机制。
CVA 方法显示了固定在腐植酸表面的一定体积的铜的电化学活性,可用于在修饰电极上进行电催化反应。
参考文献(略)
