C5a/C5aR信号在微小隐孢子虫感染中的免疫调节作用研究
2022-08-26伍雪梅原亚杰尹艳玲宋军科史怀平赵光辉
伍雪梅,杨 新,原亚杰,尹艳玲,赖 鹏,宋军科,史怀平,赵光辉,3*
(1. 西北农林科技大学动物医学院,杨凌 712100; 2. 西北农林科技大学动物科技学院,杨凌 712100; 3. 中国农业科学院兰州兽医研究所,兰州 730046)
隐孢子虫(spp.)是一类重要的人兽共患寄生原虫,主要寄生于人和多种动物的消化道,引起以腹泻为主要症状的隐孢子虫病,严重威胁着人和动物的健康。目前,已报道了47个隐孢子虫有效种和100多个基因型,宿主范围包括人和260余种动物。隐孢子虫主要通过直接接触、食源性和水源性途径传播,使得其在人、动物以及自然环境中广泛存在。隐孢子虫感染对宿主造成的危害与宿主的免疫状态密切相关,免疫功能正常的宿主感染隐孢子虫常可引起急性自限性腹泻,而免疫功能缺陷的宿主(如艾滋病患者和器官移植患者)或免疫功能低下的幼龄儿童和新生动物感染隐孢子虫会出现持续性水样腹泻,引起宿主严重脱水甚至危及生命。针对隐孢子虫病的治疗,目前,仅硝唑尼特获得了美国食品和药物安全局(Food and Drug Administration,FDA)的批准,但该药物对于免疫力低下和幼年易感宿主疗效甚微。鉴于隐孢子虫病的发生和发展与宿主的免疫状况密切相关,弄清宿主抗隐孢子虫感染的免疫防御机制可为发掘新的防控隐孢子虫病药物靶标和疫苗候选分子提供理论指导。
固有免疫和获得性免疫应答在宿主早期防御和后期清除隐孢子虫的过程中发挥着重要作用。在急性感染初期,固有免疫系统中的肠道上皮细胞、免疫细胞(如单核巨噬细胞、树突状细胞和NK细胞)、细胞因子(如γ-干扰素和白细胞介素-18)、趋化因子(如CXCL8和CXCL10)及补体(如MBL和C3b)参与了宿主早期防御和抵抗隐孢子虫的入侵过程。被激活的固有免疫组分还会触发并调节宿主获得性免疫应答。获得性免疫应答是宿主防御和清除隐孢子虫的关键,特别是以CD4T细胞为主的细胞免疫应答,其中,Th1、Th2、Th17和Treg细胞亚群及其产生的IFN-γ、IL-4、IL-17和TGF-β等细胞因子在隐孢子虫感染的早期防御、后期清除、炎症反应和肠道损伤后修复中发挥作用,共同参与宿主的抗隐孢子虫感染。但是截至目前,隐孢子虫感染过程中CD4T细胞的调控、分化和应答机制尚未完全阐明。作为固有免疫应答的重要组成部分,补体分子可以通过3条激活途径(经典途径、替代途径及凝集素途径)在感染局部发挥溶解病原、调理吞噬、介导炎症、免疫黏附及细胞毒等作用。此外,局部激活的补体成分(如C3b、补体受体CD21/35和C5aR)还可以参与调节炎症和获得性免疫应答,特别是以CD4T细胞为主的细胞免疫应答,在一定程度上充当了固有免疫和获得性免疫的枢纽。补体系统激活后,补体C5发生有限的蛋白水解,释放过敏毒素C5a。C5a可通过与抗原提呈细胞(antigen-presenting cell,APC)或/和CD4T细胞上对应的G-蛋白偶联受体C5aR结合,影响抗原的摄取以及共刺激分子、细胞因子、趋化因子等的表达,直接或间接地参与T细胞的激活、增殖、分化和效应过程。例如,在牛分枝杆菌()感染小鼠模型中,被感染小鼠分泌的C5a可与树突状细胞C5aR结合,通过影响IL-12 p70的分泌来参与Th1细胞免疫应答。通过对过敏性哮喘的研究发现,C5aR缺陷小鼠会出现BMDC过敏原的摄取受损,以及Th2和Th17细胞分化相关分子(如CD11b、IL-17A)的表达减少,表明C5aR可通过抑制CD4T细胞向Th2和Th17细胞分化来发挥免疫调节效应。此外,研究发现C5a在病毒(如流感病毒和登革热病毒)、细菌(如李斯特菌)及寄生虫(如疟原虫和克氏锥虫)感染中发挥了一定的T细胞免疫调节作用。
隐孢子虫感染会激活宿主补体系统,进而引起C5a/C5aR的上调表达,并且宿主主要依靠以CD4T细胞为主的细胞免疫应答来抵御隐孢子虫感染,而补体C5a/C5aR信号可以直接或间接调控CD4T细胞免疫反应,但目前对于C5a/C5aR信号在隐孢子虫感染过程中对CD4T细胞免疫反应的调控作用还不清楚。本研究以人兽共患为研究对象,在建立BALB/c乳鼠和C5aR抑制BALB/c乳鼠感染模型的基础上,应用实时荧光定量PCR和免疫组织化学技术检测感染前后乳鼠回肠组织中C5aR的表达变化,并利用实时荧光定量PCR检测隐孢子虫70基因和CD4T细胞亚群Th1、Th2、Th17细胞和Treg细胞主效应细胞因子IFN-γ、IL-4、IL-17和TGF-β的转录变化,通过病理组织切片观察乳鼠回肠黏膜的损伤情况,进而明确C5a/C5aR信号对隐孢子虫致病性的影响,以及C5a/C5aR信号对隐孢子虫感染中宿主CD4T细胞的免疫调节作用。
1 材料与方法
1.1 虫株
IIdA19G1亚型虫株为河南农业大学张龙现教授惠赠,经亚型鉴定后由本实验室保存,并在犊牛体内进行传代。
1.2 实验动物
从成都达硕实验动物有限公司购入100只性成熟(7周龄左右)的BALB/c小鼠,饲养于西北农林科技大学实验动物中心,饲喂SPF级的小鼠饲料,自由饮用无菌水,待其自由交配产出新生小鼠后,取5 d新生乳鼠进行动物试验。
1.3 主要试剂
甲醛溶液(光华科技,中国),二甲苯、氯仿和异丙醇(致远化学,中国),甲醇(华天生物,中国),伊红、苏木素、吐温20和DAB显色试剂盒(索莱宝科技,中国),TRIzol裂解液和DEPC(康为试剂,中国), PrimeScriptRT reagent Kit with gDNA Eraser(TaKaRa,日本),SP-0023 HistostainTM-Plus Kits (博奥森生物,中国),C5aR兔多克隆抗体(三鹰生物,中国),PMX 205(MedChemExpress,美国)。
1.4 微小隐孢子虫感染BALB/c乳鼠模型的建立
1.4.1 动物感染试验 将乳鼠禁食12 h,感染组乳鼠经口接种1×10个卵囊,对照组乳鼠经口灌服相同体积的PBS,并将感染组和对照组乳鼠分区饲养,防止交叉感染。
1.4.2 组织样品的采集和处理 感染后(post infection,pi)6 h、12 h、24 h、36 h、48 h、3 d、4 d、5 d、6 d、7 d、8 d、9 d、10 d、15 d、20 d、25 d和30 d分别随机选取感染组和对照组乳鼠各3只,在无菌条件下使用脱颈椎法处死乳鼠,分离回肠段。用PBS清洗两次后放进无菌研钵,倒入少量液氮速冻后用研磨棒研碎组织,转移至1.5 mL灭菌无RNA酶离心管中,加入800 μL TRIzol,剧烈震荡混匀后保存于-80 ℃用于提取总RNA。此外,收集感染高峰(7 dpi) 的回肠组织,用预冷的PBS洗去残留血迹后,置于4%多聚甲醛溶液中固定后用于组织病理学观察;同时收集7 dpi大肠内容物置于1.5 mL离心管中,保存于4 ℃用于后续的改良抗酸染色。
1.4.3 组织样品总RNA的提取和cDNA的合成 取出保存于TRIzol裂解液中的乳鼠回肠样品,置于冰盒中自然融化10 min;加入160 μL氯仿,涡旋震荡15 s,室温静置3 min;4 ℃,13 200 r·min离心15 min,吸取上清;加入等体积的异丙醇,混匀后,室温静置30 min;4 ℃,13 200 r·min离心15 min,弃上清;加入1 mL无水乙醇,4 ℃,13 200 r·min离心7 min; 弃上清,重复操作两次;室温开盖晾干沉淀,加入适量DEPC水溶解,静置5 min;吸取适量RNA样品,并使用分光光度计和琼脂糖凝胶电泳进行RNA质量检测,剩余样品保存于-80 ℃备用。参照PrimeScriptRT reagent Kit with gDNA Eraser 试剂盒说明书步骤合成样品cDNA,合成的cDNA保存于-20 ℃备用。
1.4.4 荧光定量PCR检测隐孢子虫70的转录情况 本试验采用Garcés等建立的基于隐孢子虫热休克蛋白70(70ku heat shock proteins,HSP70)基因的荧光定量PCR方法对乳鼠回肠组织中的微小隐孢子虫感染情况进行定量分析,以鼠特异性甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,引物由上海生工生物工程有限公司合成(表1)。荧光定量PCR反应体系(20 μL):10 μL 2× UltraSYBR Mixture、1 μL Primer mix、5 μL cDNA模板和4 μL RNase-free ddHO。反应程序:95 ℃预变性10 min;95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸32 s,40个 循环。隐孢子虫70 mRNA的相对转录量用2-ΔΔ表示。

表1 Real-time PCR扩增引物
1.4.5 组织病理学观察 将回肠样品置于4%多聚甲醛溶液中固定24 h后依次进行组织修块、脱水、透明、浸蜡、石蜡包埋和切片。将制作好的石蜡切片经苏木素和伊红染色后封片,待切片干燥后,置于显微镜下进行观察。每张切片选取5根最长的完整肠绒毛,分别测量绒毛长度、绒毛直径、隐窝深度和肠黏膜厚度。
1.4.6 隐孢子虫改良抗酸染色 将保存于1.5 mL 无菌离心管中的大肠内容物用研磨棒碾碎;加入1 mL PBS,3 000 r·min离心10 min,弃上清,重复操作两次;留残液约200 μL,加PBS至1.5 mL,充分涡旋,静置至离心管中大颗粒物沉降至管底;在沉淀上方略微浑浊处吸取20 μL液体,涂抹成“2 cm×2 cm” 的涂片;待涂片室温风干后,滴加甲醇固定5 min, 随后滴加石炭酸复红染色液染色10 min, 水洗去浮色;滴加1%盐酸酒精脱色液,脱色至淡粉色,水洗;滴加10倍稀释的2%的孔雀绿染液,染色30 s,水洗;涂片经室温风干后置于400倍光学显微镜下进行观察。
1.5 乳鼠回肠组织中C5aR的表达水平分析
1.5.1 C5aR的mRNA表达水平分析 在感染后1、2、3、4、5、6、7、9、10、15和30 d分别采集感染组和对照组乳鼠回肠组织样本各3份,回肠组织的采集和处理,组织样品总RNA提取,cDNA合成和荧光定量的反应体系及数据处理详见“1.4.2~1.4.4”。引物序列见表1,引物由生工生物公司合成。
1.5.2 C5aR的蛋白表达水平分析 采集5 dpi乳鼠回肠组织制作石蜡切片,以C5aR兔多克隆抗体(抗体稀释度1∶200)作为一抗,参照SP-0023 HistostainTM-Plus Kits免疫组化染色试剂盒说明书步骤进行免疫组织化学分析,使用Image-Pro Plus对C5aR阳性细胞在乳鼠回肠组织的表达水平进行评估,计算其平均光密度值(平均光密度值=累计光密度值/细胞分布的区域面积)。
1.6 微小隐孢子虫感染C5aR抑制乳鼠模型的建立
对于C5aR抑制组的5日龄BALB/c乳鼠,在接种卵囊前6 h,根据体重经口灌喂3 mg·kg的C5aR抑制剂(即PMX 205),随后经口接种1×10个卵囊,并每隔3 d再依体重补灌PMX 205以建立感染C5aR抑制乳鼠模型。感染后1、2、3、4、5、6、7、9、10、15和30 d,从C5aR抑制组(C5aRa)中随机抽取3只乳鼠,无菌分离回肠组织。组织样品的采集和处理、组织样品总RNA提取和cDNA合成方法详见“1.4.2~1.4.3”。参照“1.4.4”详述的操作步骤检测C5aR抑制组各时间点乳鼠回肠组织中隐孢子虫70的转录情况。同时采集C5aR抑制组5 dpi的回肠组织,参照“1.4.5”操作进行组织病理学观察。
1.7 荧光定量PCR测定CD4+ T细胞亚群细胞因子的mRNA表达量
选取对照组、感染组、C5aR抑制组1、2、3、4、5、6、7 dpi回肠组织cDNA样品,以鼠特异性作为内参基因,采用荧光定量PCR检测Th1、Th2、Th17和Treg细胞主效应细胞因子基因-γ、-4、-17和-β的转录情况。引物序列和退火温度见表1,引物均由生工生物公司合成。反应体系和操作均参照“1.4.4”所述。
1.8 数据处理
使用GraphPad Prism 8.0软件,采用Student’s检验进行统计学差异分析。当>0.05时,差异不显著;当0.01<<0.05时,差异显著;当<0.01时,差异极显著。
2 结 果
2.1 C. parvum感染BALB/c乳鼠模型的建立
利用基于隐孢子虫70基因的实时荧光定量PCR进行感染情况的检测发现,在6 hpi即可检测到70基因的转录,持续到25 dpi,感染高峰出现在7 dpi(图1A)。采集7 dpi的感染组乳鼠大肠内容物进行改良抗酸染色,发现大量玫瑰红色或暗红色卵囊(图1B)。通过对7 dpi的感染组和对照组乳鼠回肠组织进行切片观察,发现与对照组相比,感染组的乳鼠回肠组织中出现隐孢子虫寄生和中性粒细胞及炎性细胞浸润(图1C),并伴随着回肠绒毛脱落、萎缩和断裂,回肠末端黏膜结构完整性被破坏、上皮细胞损伤和细胞间隙变宽(图1D)。

A. C. parvum感染乳鼠回肠组织中微小隐孢子虫HSP70相对转录量分析;B. C. parvum感染乳鼠(7 dpi)大肠内容物抗酸染色结果(400×),箭头所指为微小隐孢子虫卵囊;C. C. parvum感染乳鼠(7 dpi)回肠组织HE染色结果(400×),a,c. 对照组乳鼠,b,d. 感染组乳鼠,感染组回肠纹状缘有微小隐孢子虫(箭头处),固有层有淋巴细胞(星形)和中性粒细胞(三角形)浸润;D. C. parvum感染乳鼠(7 dpi)回肠组织病理变化的统计分析结果。*.P<0.05,**.P<0.01A. Analysis of relative transcription levels of C. parvum HSP70 in ileum tissues of suckling mice infected with C. parvum; B. Acid-fast staining results for contents in large intestines of suckling mice (7 dpi) infected with C. parvum (400×), with the arrow indicating C. parvum oocyst; C. HE staining results of ileum tissues of suckling mice (7 dpi) infected with C. parvum (400×), a, c. Suckling mice in control group, b, d. Suckling mice in infected group, C.parvum (arrow) in the striated border of ileum in infected group, and lymphocyte (star) and neutrophils (triangle) infiltration in lamina propria; D. Statistical analysis of pathological lesions in ileum tissues of suckling mice (7 dpi) infected with C. parvum; *. P<0.05,**. P<0.01图1 微小隐孢子虫感染BALB/c乳鼠模型的建立Fig.1 Establishment of a BALB/c suckling mouse model infected with C. parvum
2.2 C. parvum感染乳鼠回肠组织中C5aR的表达分析
实时荧光定量PCR结果显示,感染引起乳鼠回肠组织中C5aR转录水平的动态变化,感染组C5aR的 mRNA水平在4、5、7、15和30 dpi均显著高于对照组(<0.05),并在5 dpi达到峰值(图2)。同时,采用免疫组织化学技术对5 dpi乳鼠回肠组织C5aR的蛋白水平进行检测,发现C5aR主要分布于肠上皮细胞和血管内皮细胞表面(图3A),并且感染组C5aR的蛋白水平也显著高于对照组(<0.01)(图3B)。
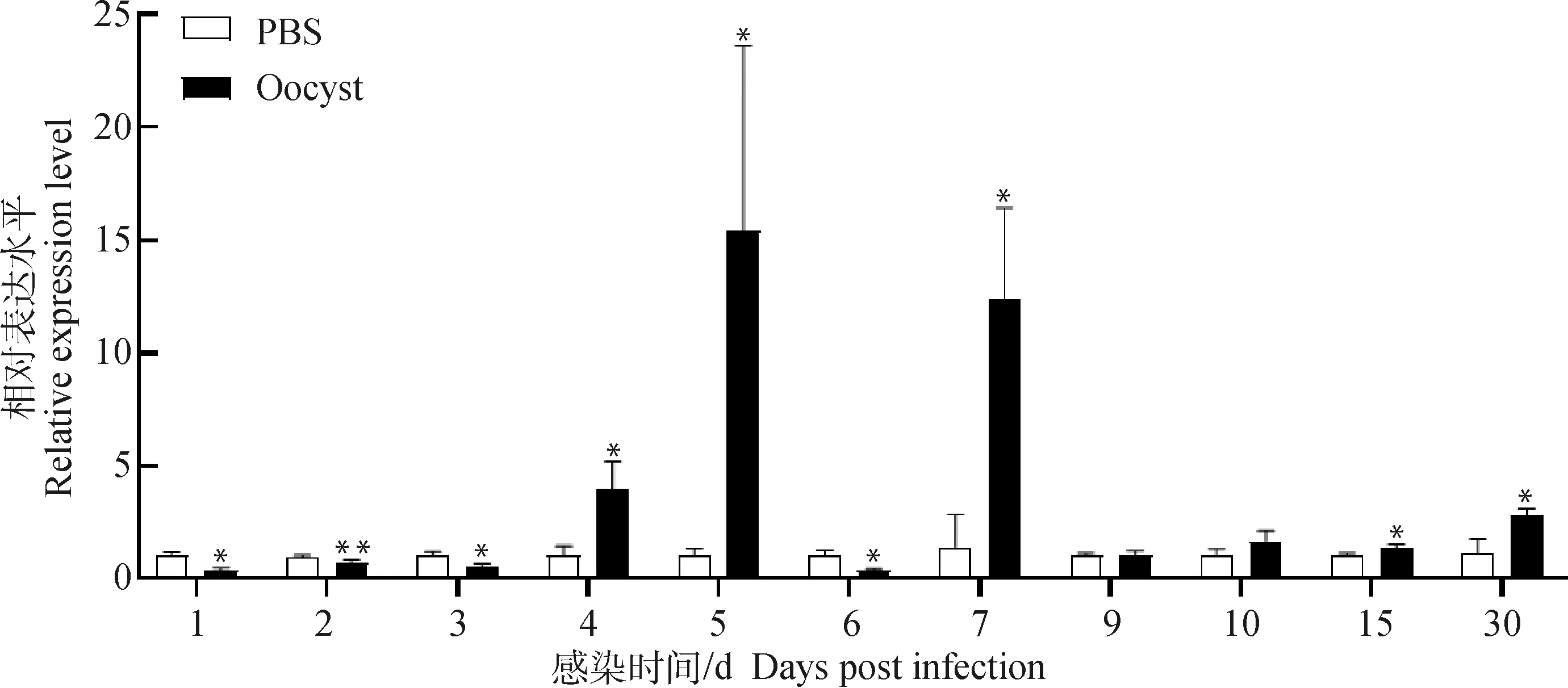
*.P<0.05; **P<0.01图2 C. parvum感染乳鼠回肠组织中C5aR的 mRNA转录分析Fig.2 Analysis of the mRNA expression of C5aR in the ileum tissues of suckling mice infected with C. parvum
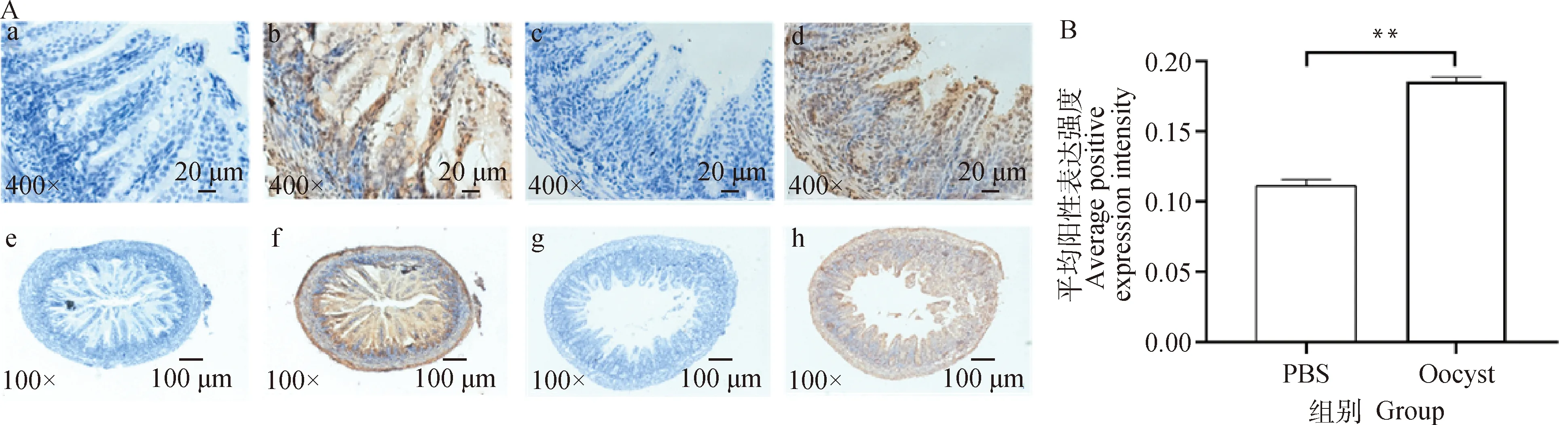
A. 乳鼠回肠组织C5aR的免疫组化染色结果(5 dpi),a和e. 阴性对照组(对照组),b和f. 试验组(对照组),c和g. 阴性对照组(感染组),d和h. 试验组(感染组);B. 乳鼠回肠组织在400倍镜下5个随机视野中C5aR平均阳性强度的统计分析结果(5 dpi),*.P<0.05,**.P<0.01A. Immunohistochemical staining results for C5aR in ileum tissues of sucking mice (5 dpi), a and e. Negative control group (control group), b and f. Experimental group (control group), c and g. Negative control group (infected group), d and h: Experimental group (infected group); B. Statistical analysis of C5aR average positive expression intensity in ileum tissues of suckling mice in five random fields under 400 times microscope (5 dpi), *. P<0.05, **. P<0.01图3 C. parvum感染乳鼠回肠组织中C5aR的表达分析Fig.3 Analysis of C5aR expression in ileum tissues of suckling mice infected with C. parvum
2.3 C5a/C5aR信号对C. parvum感染乳鼠回肠组织中CD4+ T细胞亚群细胞因子转录水平的调节作用
2.3.1 C5a/C5aR信号对Th1细胞主效应因子-γ mRNA转录水平的影响 荧光定量PCR结果显示,感染组乳鼠回肠组织Th1细胞主效应分子-γ mRNA转录水平在多数时间点(2、4、5、6和7 dpi)显著上调转录(<0.05),并在6 dpi达到高峰(图3A)。与感染组乳鼠相比,C5aR抑制组乳鼠回肠组织中-γ mRNA转录水平在2、4、6 dpi出现显著下调转录(<0.05)(图4A)。
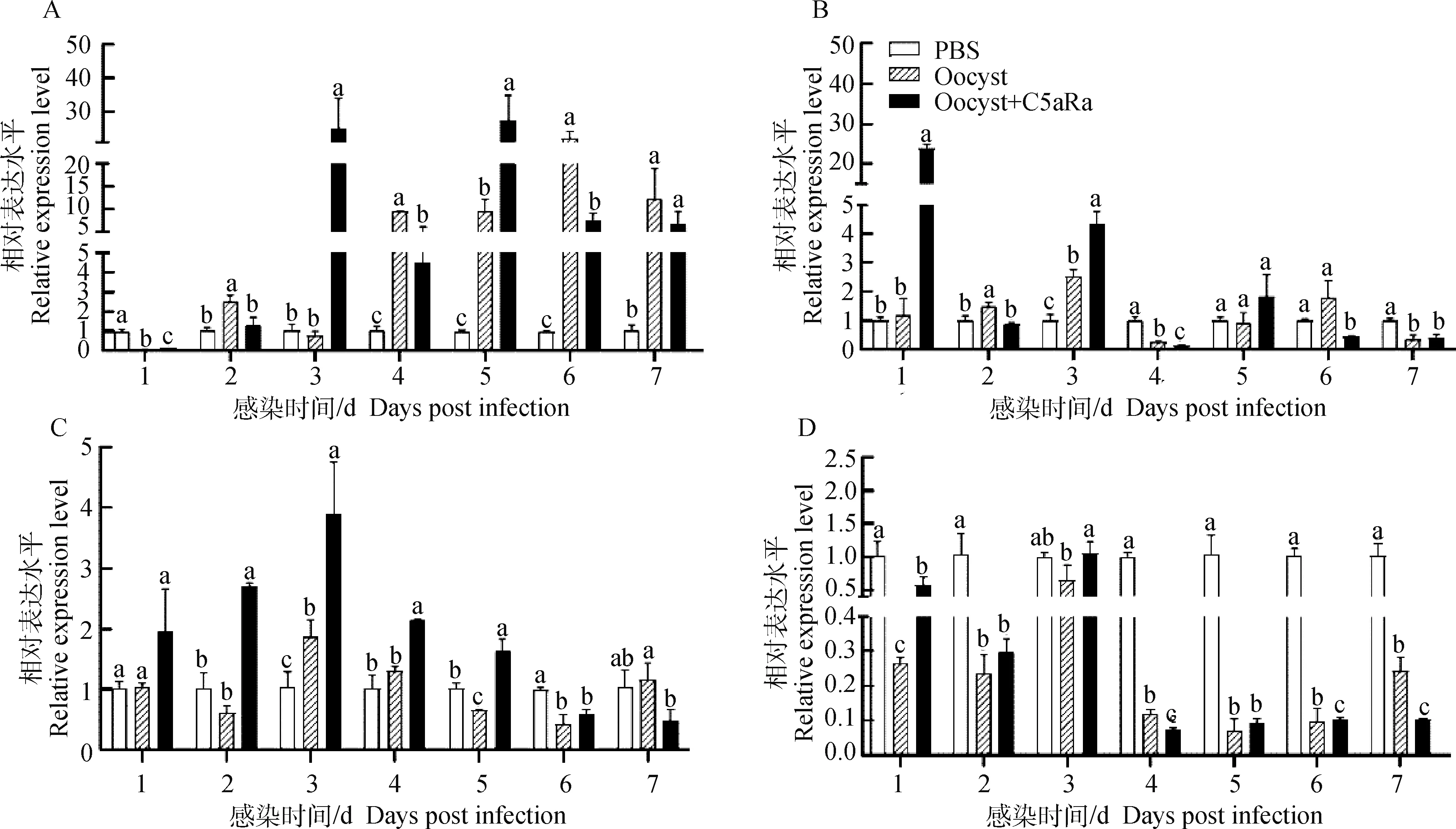
A. C. parvum感染乳鼠回肠组织中IFN-γ转录量的变化情况;B. C. parvum感染乳鼠回肠组织中IL-4转录量的变化情况;C. C. parvum感染乳鼠回肠组织中IL-17转录量的变化情况;D. C. parvum感染乳鼠回肠组织中TGF-β转录量的变化情况。柱上的不同小写字母表示差异显著(P<0.05)A. Changes in the transcription of IFN-γ in the ileum tissues of suckling mice infected with C. parvum; B. Changes in the transcription of IL-4 expression in the ileum tissues of suckling mice infected with C. parvum; C. Changes in the transcription of IL-17 expression in the ileum tissues of suckling mice infected with C. parvum; D. Changes in the transcription of TGF-β expression in the ileum tissues of suckling mice infected with C. parvum. Different lowercase letters above the bars indicated significant differences (P<0.05)图4 C5a/C5aR信号对C. parvum感染乳鼠CD4+ T细胞亚群相关因子的调节作用Fig.4 Regulatory effect of C5a/C5aR signaling on cytokines related to CD4+ T cell subsets in suckling mice infected with C. parvum
2.3.2 C5a/C5aR信号对Th2细胞主效应因子-4 mRNA转录水平的影响 荧光定量PCR结果表明,感染组乳鼠回肠组织中Th2细胞主效应因子-4的mRNA相对转录水平呈现动态变化,在2、3 dpi显著上调转录,但在4、7 dpi又显著下调转录(<0.05)(图4B);C5aR抑制组乳鼠回肠组织中-4转录量相较于感染组在2、4和6 dpi显著下调转录(<0.05)。
2.3.3 C5a/C5aR信号对Th17细胞主效应因子-17 mRNA转录水平的影响 乳鼠回肠组织中Th17细胞主效应因子-17的荧光定量PCR结果显示,感染组-17 mRNA转录量仅在3 dpi显著高于对照组(<0.05),而在5、6 dpi显著低于对照组转录水平(<0.05)(图4C);而C5aR抑制组乳鼠回肠组织中-17 mRNA的相对转录水平在2、3、4和5 dpi显著高于感染组(<0.05)(图4C)。
2.3.4 C5a/C5aR信号对Treg细胞主效应因子-β mRNA转录水平的影响 利用荧光定量PCR测定感染乳鼠回肠组织中Treg细胞主效应因子-β mRNA相对转录水平发现,-β在多数时间点(1、2、4、5、6和7 dpi)显著下调转录(<0.05)(图4D),而有趣的是,C5aR抑制组乳鼠回肠组织中-β在4、6和7 dpi也显著下调转录(<0.05), 仅在1、3 dpi相较于感染组转录量显著上调(<0.05)(图4D)。
2.4 C5a/C5aR信号对C. parvum在乳鼠回肠组织中增殖的影响
利用基于隐孢子虫70基因的实时荧光定量PCR对C5aR抑制组乳鼠回肠组织中的微小隐孢子虫感染情况进行检测发现,与单纯感染组相比,C5aR抑制组乳鼠回肠组织中隐孢子虫70的 mRNA转录量仅在2、3、4和5 dpi显著上调转录,且在3 dpi达到高峰值,而在其余多数时间点(1、6、7、9、10、15和30 dpi)均显著下调转录(图5)。此外,通过采集对照组、感染组和C5aR抑制组的乳鼠回肠组织(5 dpi)进行组织病理学观察,发现感染组和C5aR抑制组乳鼠回肠绒毛刷状缘有隐孢子虫寄生(图6A);同感染组相比,C5aR抑制组回肠绒毛长度显著缩短、萎缩(<0.01),绒毛变细(<0.05)且黏膜厚度明显变薄(<0.05),但绒毛长度与隐窝深度比值差异不显著(>0.05)(图6B)。

*.P<0.05; **.P<0.01图5 C. parvum感染C5aR抑制乳鼠回肠组织中HSP70转录分析Fig.5 Analysis of HSP70 expression level in ileum tissues of suckling mice treated with C5aR inhibitor during C. parvum infection
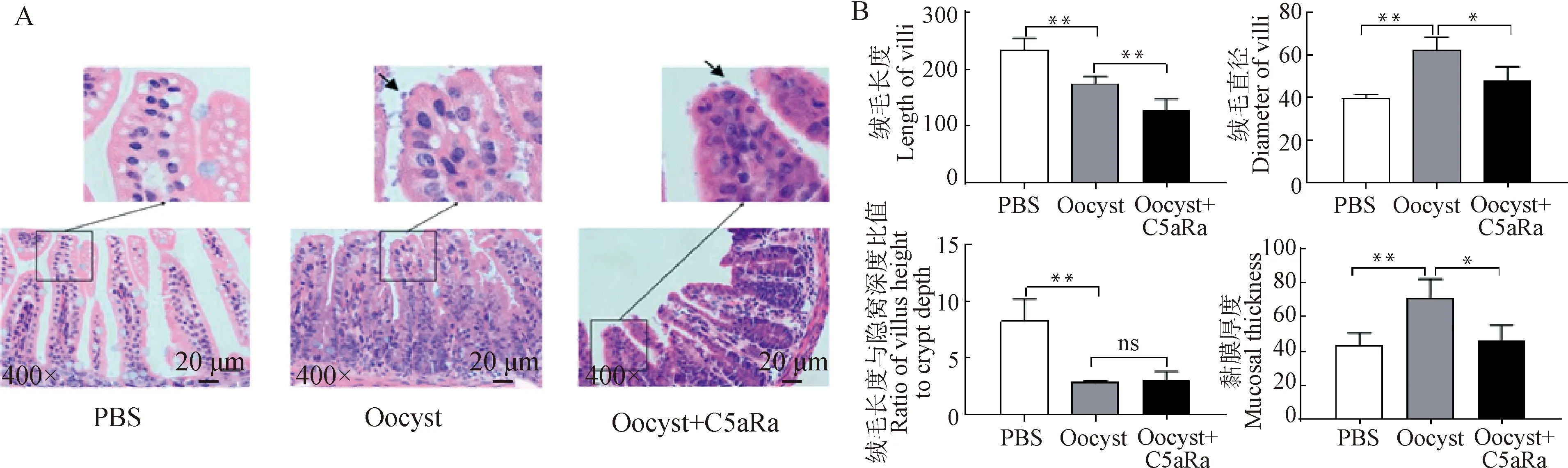
A. C. parvum感染乳鼠(5 dpi)回肠组织HE染色结果(400×);B. C. parvum感染乳鼠(5 dpi)回肠组织病理变化的统计分析结果。*.P<0.05,**.P<0.01,ns.P>0.05;箭头指示的为微小隐孢子虫卵囊A HE staining results of ileum tissues of suckling mice infected with C. parvum at 5 dpi (400×); B. Statistical analysis of changes in ileum tissues of suckling mice infected with C. parvum at 5 dpi. *. P<0.05, **. P<0.01, ns. P>0.05; the arrow indicates C. parvum oocyst图6 C5a/C5aR信号对C. parvum在乳鼠回肠组织中增殖的影响Fig.6 Effect of C5a / C5aR signal on the proliferation of C. parvum in the ileum tissues of infected suckling mice
3 讨 论
隐孢子虫病是由隐孢子虫感染引起的一种人兽共患原虫病,严重威胁着人类的健康和畜牧业的可持续发展。然而,目前尚缺少有效防控隐孢子虫病的药物和疫苗,主要是由于对隐孢子虫致病机制和宿主免疫防御机制的认识有限。为了更有效地阐明虫体与宿主的互作机制,人们构建了多种感染动物模型,包括多品系的小鼠、犊牛、仔猪和羔羊等,其中最常用的动物模型是新生犊牛模型和小鼠模型。近年来,已有多种感染小鼠模型(如地塞米松免疫抑制的SCID小鼠、BALB/c小鼠和KM小鼠模型以及T和B细胞免疫缺陷的SCID小鼠)被成功构建并广泛应用于隐孢子虫病的免疫学研究和抗微小隐孢子虫的药物筛选。本研究针对幼年动物对的高度易感性,构建了一种感染BALB/c乳鼠模型,模型研究结果表明,在6 hpi即可在BALB/c乳鼠的回肠组织中检测到隐孢子虫70基因的表达,一直持续到25 dpi,感染高峰出现在7 dpi,感染可以引起乳鼠的肠道病理损伤和炎症反应。与其他隐孢子虫感染模型相比,本研究建立的BALB/c乳鼠模型在感染过程中不需要使用地塞米松进行免疫抑制,可以模拟幼年动物的自然感染过程,通过对感染结果的定性定量监测,可以更加真实地反映出感染对幼年动物的影响,为深入研究虫体与宿主的互作机制提供了候选模型。
研究表明,固有免疫和获得性免疫应答在宿主抵御和清除隐孢子虫的感染中发挥重要作用,尤其是以CD4T细胞为主的细胞免疫应答。感染可以通过经典途径和凝集素途径来激活宿主的补体系统。当补体系统被激活后,一方面,补体可以作为固有免疫系统的重要成分来发挥免疫效应;另一方面,补体激活后通过有限的蛋白水解释放过敏毒素C5a,C5a通过结合固有免疫细胞或/和获得性免疫细胞上的特异性受体C5aR来调节宿主的炎症反应和获得性免疫应答,进而参与抗感染免疫反应。通过对感染BALB/c乳鼠模型的进一步研究,作者发现感染可以引起BALB/c乳鼠回肠组织中C5aR表达水平的动态改变,并且在大多数时间点呈现上调表达,这与之前报道的感染可以引起小鼠脾和小肠淋巴组织中C5aR表达水平的动态变化相符,提示C5a/C5aR信号可能参与了宿主与隐孢子虫的相互作用过程。
过敏毒素C5a可与C5aR结合启动C5a/C5aR信号,进而诱导CD4T细胞亚群的分化和效应,对T细胞免疫应答起着重要的调节作用。研究发现,隐孢子虫感染引起宿主CD4T细胞分泌IFN-γ、IL-4、IL-17和TGF-β等细胞因子,共同参与宿主抗隐孢子虫感染过程。本研究以感染的BALB/c乳鼠为研究对象,分析了感染对CD4T细胞亚群分化的影响,发现感染主要引起乳鼠回肠组织中Th1细胞主效应因子-γ的显著上调表达,表明隐孢子虫感染乳鼠主要诱导了Th1型免疫效应,而之前的研究表明-γ敲除的C57BL/6小鼠表现出对更易感,这提示感染可以诱导Th1细胞亚群分化,进而在宿主抗隐孢子虫感染中发挥作用。在使用PMX 205抑制C5aR后,感染乳鼠回肠组织中Th1细胞主效应因子-γ和隐孢子虫70均先显著上调转录(1~5 dpi)后显著下调转录(6~7 dpi),提示C5a/C5aR信号在感染乳鼠过程中可能通过调节Th1细胞主效应因子IFN-γ的产生来影响在乳鼠回肠中的增殖,这种调节作用与C5a/C5aR信号通路在脑疟疾和弓形虫感染小鼠模型中引起的Th1细胞主效应因子IFN-γ的上调作用一致。感染可以刺激宿主Th2细胞亚群分泌IL-4,IL-4在后期清除隐孢子虫中有重要作用,但在本研究中感染乳鼠及C5aR抑制乳鼠回肠组织-4 mRNA水平均呈动态变化,无明显变化趋势,表明C5a/C5R信号在微小隐孢子虫感染乳鼠中对Th2细胞主效应因子IL-4的调节作用并不明显。此外,研究发现Th17细胞效应因子-17和Treg细胞效应因子-β在感染中除具有炎症调节和抗感染作用外,还可减轻对宿主肠上皮细胞的损伤。通过口服C5aR抑制剂的方式对BALB/c乳鼠的C5aR进行抑制,发现抑制C5aR可引起感染乳鼠早期(1~5 dpi)回肠组织中Th17细胞和Treg细胞主效应细胞因子-17和-β在多数时间点显著上调表达,同时,抑制C5aR还可显著改善感染引起的乳鼠回肠组织的绒毛直径和黏膜厚度变化,提示C5a/C5aR信号可能通过上调IL-17和TGF-β的产生以改善隐孢子虫感染引起的肠道损伤,降低隐孢子虫感染引起的肠道屏障破坏。综上,C5a/C5aR信号可能通过动态调节CD4T细胞亚群主效应细胞因子的表达来参与宿主与隐孢子虫相互作用的过程,但对其具体的调控机制以及C5a/C5aR信号在隐孢子虫与宿主互作中发挥的作用还需要进一步的深入探讨。
4 结 论
在建立了一种感染BALB/c乳鼠模型的基础上,发现感染可以引起BALB/c乳鼠回肠组织中C5aR的上调表达,并且主要诱发宿主Th1型免疫效应。进一步的研究表明,C5a/C5aR信号可能通过动态调节CD4T细胞亚群主效应细胞因子的表达来参与宿主与隐孢子虫相互作用的过程。
