陆地棉MYB类转录因子基因GhTT2克隆及功能初步分析
2022-08-25慕蓉蓉牛晴晴孙玉强梅俊苗蒙
慕蓉蓉,牛晴晴,孙玉强,梅俊,苗蒙
陆地棉MYB类转录因子基因克隆及功能初步分析
慕蓉蓉,牛晴晴,孙玉强,梅俊,苗蒙
浙江理工大学生命科学与医药学院,植物基因组与彩色纤维分子改良实验室,杭州 310018
原花青素作为植物重要的次生代谢产物,是植物应对生物和非生物胁迫的一种重要防御手段,也是影响植物发育和品质的重要因素。原花青素作为花青素生物合成的一条末端通路在模式植物中已有研究,但是具体代谢和调控机制尚不明确;原花青素作为棕色棉纤维呈色的主要物质,其棉纤维呈色的生化与分子机制仍未完全阐明。本研究从陆地棉()中克隆了一个MYB类转录因子基因(transparent testa 2),并对其基因结构、表达模式、亚细胞定位及功能进行了分析。结果表明:GhTT2转录因子具有典型的MYB结构域,在纤维中优势表达,其转录水平随花青素含量增加而降低;该基因可被原核诱导表达;与GFP融合的重组蛋白定位在细胞核;酵母转化结果表明GhTT2具有转录激活功能;在棉花中沉默基因的表达,导致原花青素含量显著降低,表明其可能参与调控陆地棉原花青素的生物合成。本研究结果为深入阐明MYB类转录因子参与调控植物原花青素生物合成途径的分子机制提供参考。
陆地棉;原花青素;转录因子;;功能分析
原花青素(proanthocyanidins, PAs)又称缩合单宁,是一类通过植物类黄酮次生代谢途径合成的聚多酚类化合物,以单体、寡聚物或多聚物的形式存在[1]。对于植物而言,PAs存在于多种组织和器官中,具有广泛的生物学功能和生态学效应。积累在花器官及果实中的PAs,不仅决定了果实、花卉等五彩缤纷的颜色,而且吸引动物作为传粉者和种子传播者;富集于叶片及营养器官中的PAs,可以保护植物抵抗紫外线、病虫害等非生物和生物胁迫;作为内源性抗氧化剂,PAs不仅可以保护种子内部化学组分, 而且促进种子休眠[2]。对人类而言,PAs作为一种天然自由基清除剂,具有抗氧化、免疫调节活性等多种保健和药理作用[3]。因此,提高对PAs生物合成调控的认识已成为植物颜色改良和基因工程的重要前提。
PAs生物合成途径是花青素合成通路的一个分支,结构基因花青素还原酶ANR (athocyanidin reductase)和无色花青素还原酶LAR (leucoantho-cyanidin reductase)是该分支的关键酶和限速酶,主要负责将花青素转化为PAs生物合成的结构和起始单位,赋予PAs种类多样性[2,4]。谷胱甘肽-S-转移酶、MATE (multidrug and toxic compound extrusion)家族蛋白以及H+-ATPase负责将原花青素单体跨膜转运到液泡中[2]。最后在植物多酚氧化酶、漆酶和植物过氧化物酶等作用下,原花青素单体聚合为具有颜色的多聚体[2]。此外,PAs生物合成途径中结构基因大多通过协同作用发挥功能,而这种协同机制直接受控于调节基因。目前发现的调节基因主要是转录因子家族,如R2R3-MYB、WD40和bHLH等,三者通过形成MYB-bHLH-WD40 (MBW)转录激活三联体,参与对结构基因的表达调控[5]。MBW复合物中特异的组合决定了其调控对象和调控强度。如转录因子基因和可与bHLH基因结合,通过促进部分结构基因表达来提高葡萄() PAs含量[6]。柿子()与结合形成功能复合体,两者靶向并激活的表达,协同正调控柿子PAs生物合成[7]。番茄() WD40基因与bHLH基因结合,通过抑制表达限制黄酮醇的积累并诱导PAs的生物合成[8]。由此可见,关键调控基因的功能分析及调控网络构建,有助于推进对PAs生物合成分子调控机理的解析。
陆地棉是重要的经济作物之一,是天然纤维的主要来源,提供纺织工业90%以上的棉纤维,因此提升棉花品质和保障棉花的有效供给具有重要的战略意义[9]。PAs作为植物重要的次生代谢产物,不仅是植物应对生物和非生物胁迫的一种重要防御手段,还能影响植物发育和品质。虽然PAs生物合成途径在模式植物中已有研究,但在棉花中其调控机制的研究相对较少。本研究在陆地棉()中克隆了一个与拟南芥()同源的MYB类转录因子基因(南京农业大学陆地棉转录组数据库NAU v1.1,编号为Gh_A05G1167)。该基因在纤维中优势表达且其转录水平与花青素含量呈相反趋势,抑制该基因功能导致原花青素含量显著降低,表明其可能参与调控陆地棉PAs的生物合成。本研究结果为深入阐明MYB类转录因子参与调控植物PAs生物合成途径的分子机制提供参考。
1 材料与方法
1.1 实验材料
陆地棉Coker312 (C312)、棕色棉ZX1和彩叶棉C07、C11、C16、HS2种植在浙江理工大学棉花试验地(浙江杭州),按照大田常规栽培管理。采集根、茎、叶及不同发育时期5、10、15和20 DPA (day post anthesis,开花后天数)纤维等组织,液氮速冻,–80℃保存备用。本氏烟()种植于人工气候室,温度22℃、光照16 h/黑暗8 h。用于病毒诱导的基因沉默(virus-induced gene silencing, VIGS)棉花培养于人工气候室,温度28℃、16 h光照/8 h黑暗。
1.2 基因克隆及分析
利用拟南芥TT2蛋白序列,根据公共数据库陆地棉TM-1不同组织表达谱数据及本课题组的彩色纤维发育相关转录组测序数据,从中筛选出1个与类黄酮合成途径相关的MYB类转录因子基因。根据该基因编码序列,利用Primer Premier 6.0设计目的基因扩增引物GhTT2-F/R (表1),分别以C312、ZX1和C11的20 DPA纤维组织的cDNA为模板,经PCR扩增得到基因编码区片段。PCR扩增体系为50 μL:模板1 μL,上下游引物(10 μmol/L)各2 μL,2×PrimeSTAR Max Premix (TaKaRa (大连)有限公司) 25 μL,无菌水20 μL。PCR扩增程序:98℃预变性3 min;98℃ 10 s,55℃ 15 s,72℃ 30 s,35个循环;72℃延伸10 min;4℃保存。回收PCR产物并送至生工生物工程(上海)股份有限公司进行测序鉴定。通过ExPASy (https://www.expasy. org/)在线网站对蛋白保守结构域、相对分子质量等进行分析。
1.3 原核表达分析
设计p28a-GhTT2-F/R引物,借助原核表达载体pET-28(+),构建GhTT2-pET-28a(+)重组载体;分别转化GhTT2-pET-28a(+)及空载体pET-28a(+)至大肠杆菌()感受态BL21(DE3)中,37℃过夜培养12 h,挑选单克隆菌落于灭菌LB液体培养基,37℃培养至600=0.5,然后分别在22℃、28℃、37℃和异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)浓度为1 mmol/L条件下进行诱导。收集诱导表达菌落后,加入50 μL上样缓冲液,100℃煮沸10 min,取10 μL上清液进行SDS-聚丙烯凝胶电泳并经考马斯亮蓝染色[10]。
1.4 组织表达模式分析
利用RNAprep Pure多糖多酚植物总RNA提取试剂盒(北京天根生化科技有限公司)提取棉花根、茎、叶、花及纤维组织RNA,参照cDNA反转录试剂盒NovoScript® Plus All-in-one 1st Strand cDNA Synthesis SuperMix (苏州近岸蛋白质科技股份有限公司)说明书反转录获得cDNA第一条链并进行实时荧光定量PCR,以作为内参基因(表1)。扩增体系和程序按照试剂盒NovoStart® SYBR qPCR SuperMix Plus (苏州近岸蛋白质科技股份有限公司) 说明书进行。PCR扩增体系为20 μL:模板1 μL,上下游引物(10 μmol/L)各0.5 μL,2×SuperMix 10 μL,无菌水8 μL。PCR扩增程序:95℃ 1 min;95℃ 10 s,60℃ 30 s,40个循环。实验进行2次生物重复,每个样品3次技术重复,采用2–ΔΔCt方法分析基因表达模式,所得数据使用SPSS 18.0软件进行显著性分析[9]。

表1 本研究使用的引物
1.5 花青素的提取和含量测定
采用酸化甲醇法提取棉花叶片花青素,取新鲜棉叶0.1 g,液氮速冻研磨;加入酸化甲醇溶液(1%盐酸/80%甲醇),避光浸提1 h;6000 r/min低温离心15 min收集上清液,4℃避光保存12 h;将样品稀释10倍后,分别测定530 nm、620 nm和650 nm吸光度值,利用pH示差法对花青素含量进行测定[9]。
1.6 亚细胞定位鉴定
以带有绿色荧光蛋白标记的pGWB405质粒为骨架,克隆基因片段,构建绿色荧光蛋白瞬时融合表达载体;转化农杆菌()感受态GV3101,单克隆菌落接种于2.5 mL液体YEB中培养12 h;转移0.5 mL菌液到50 mL液体YEB中,培养至600为1.0左右,收集并悬浮菌体,调600到0.5左右,室温静置3.5 h;以35S:GFP载体作为对照,分别注射本氏烟叶片,48 h后观察注射后烟草叶片荧光信号,确定GhTT2的亚细胞定位[11]。
1.7 转录激活功能验证
克隆基因片段,构建-pGBKT7重组载体,转化酵母()感受态AH109菌株;刮取对应的阳性酵母菌株于1.5 mL YPDA液体培养基中,振荡使其混匀;30℃、200 r/min培养20 h;1000 r/min室温离心10 min弃上清,收集菌落,加入500 μL生理盐水重悬;1000 r/min室温离心10 min收集菌落,加入生理盐水对菌落进行梯度稀释,每个浓度取2 μL点在SD/-Trp营养单缺陷型培养基和SD/-Trp/-His/-Ade营养三缺陷型培养基上,培养3 d;以pGBKT7载体作为阴性对照,观察酵母生长状况[12]。
1.8 VIGS侵染
以pCLCrVA载体为骨架,构建VIGS载体pCLCrVA,待棉花子叶完全展开后,活化培养pCLCrVA-、pCLCrVA、pCLCrVB和pCLCrVA-农杆菌菌株,将菌液600值调至1.0左右;选取长势均一的幼苗,在叶片背面进行穿孔,利用注射器将农杆菌菌液注入棉花叶片,黑暗培养12 h后,在温度22℃、光照16 h/黑暗8 h条件下生长;同时注射pCLCrVA-作为对照[13]。当注射pCLCrVA-的幼苗叶片呈现白化现象,进行阳性苗的检测及干涉效率鉴定。
1.9 可溶性原花青素的提取和含量测定
采用正丁醇–盐酸法对可溶性PAs进行测定,取新鲜棉叶0.1 g,液氮速冻研磨;加入0.5%乙酸/70%丙酮溶液,涡旋混匀;6000 r/min低温离心15 min,收集上清液并定容至4 mL;取1 mL上清液加入2 mL 95%正丁醇–盐酸溶液,95℃孵育1 h,待冷却至室温后测定550 nm和600 nm吸光值,以吸光值之差计算可溶性PAs的相对含量[14]。
2 结果与分析
2.1 GhTT2基因结构及原核表达
以C312、ZX1和C11叶片组织的cDNA为模板,通过PCR方法扩增获得基因的开放阅读框,序列长度为582 bp (图1A),测序结果显示该基因在不同陆地棉品种中无差异。通过ExPASy分析发现,该序列编码193个氨基酸,预测蛋白的相对分子质量为22.534 kDa,位于第14-61和67-112位氨基酸处具有2个典型的MYB类结构域(图1B)。此外,以原核表达载体pET-28(+)为骨架,构建GhTT2-pET-28a(+)重组载体,将重组GhTT2-pET- 28a(+)载体转化至BL21(DE3)中。在22℃、28℃、37℃及1 mmol/LIPTG条件下进行诱导表达4 h,结果显示在25 kDa左右有特异性条带产生且在37℃诱导效率最高。由于重组蛋白的His标签蛋白及其相关序列大小约4.5 kDa,故该蛋白条带大小与GhTT2预测的22.534 kDa基本吻合,说明该重组工程菌可以正确表达目的蛋白,为下一步探究其分子功能打下基础(图1C)。
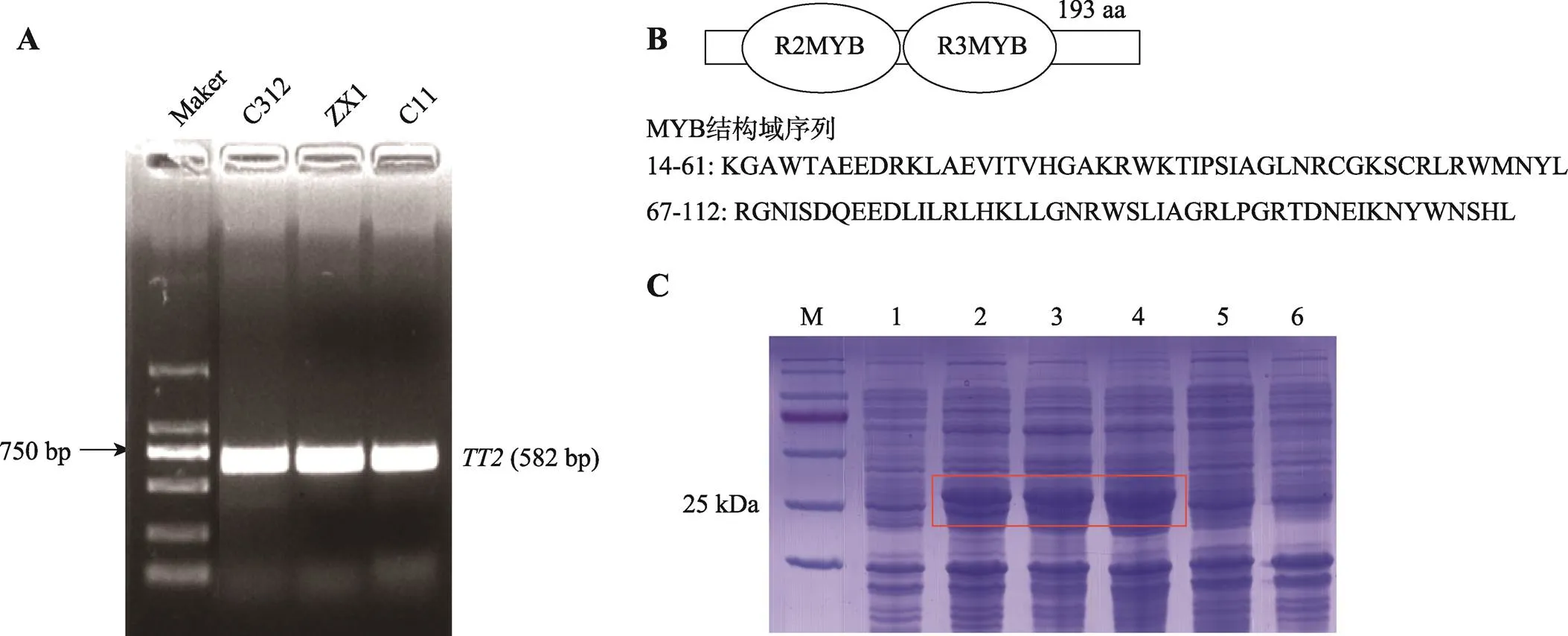
图1 GhTT2基因结构及原核表达分析
A:基因克隆;B:结构分析示意图;C:GhTT2原核表达分析。M:蛋白质标准分子量;1:GhTT2-pET-28a(+)诱导前;2~4:GhTT2-pET-28a(+)分别在22℃、28℃和37℃和1 mmol/L浓度IPTG下诱导4 h;5:pET-28a(+)诱导前;6:pET-28a(+)在37℃、1 mmol/L浓度IPTG下诱导4 h。方框指示诱导GhTT2蛋白。
2.2 GhTT2组织表达模式
为了探究在棉花中的表达特性,利用qRT-PCR方法对棕色棉ZX1的根、茎、叶、花及5~20 DPA的纤维等不同组织中的转录水平进行分析。结果发现,具有一定的组织表达特异性,在根、茎、叶、花中表达水平相对较低,而在纤维中优势表达,尤其在20 DPA的纤维中表达量最高,具有纤维表达特异性(图2),推测可能在棉纤维发育过程中发挥作用。此外,对不同花青素含量的棉花叶片(图3A)检测发现,的转录水平随花青素含量增加而降低。如C11叶片中花青素含量最高,的表达水平最低;C312叶片花青素含量最低,其表达水平最高(图3,B和C)。由此可见,可能参与棉花类黄酮次生代谢途径。
2.3 GhTT2编码蛋白的亚细胞定位及转录激活功能验证
为了研究基因编码蛋白的特征,借助烟草瞬时表达系统,在本氏烟叶片中瞬时表达GhTT2- GFP融合蛋白。结果显示,融合蛋白荧光信号聚集在细胞核区域(图4A),表明GhTT2是一个核定位蛋白,符合转录因子特征。此外,利用酵母转化系统,构建pGBKT7-GhTT2重组载体并转化至AH109酵母细胞中,培养在相应缺陷培养基中。结果显示,阴性对照pGBKT7和pGBKT7-GhTT2重组载体阳性单菌落在单缺培养基SD/-Trp中生长良好。然而在三缺培养基SD/-Trp/-His/-Ade中,阴性对照无法生长,pGBKT7-GhTT2重组载体阳性酵母菌株则正常生长(图4B),表明基因可激活下游报告基因表达使酵母菌株在His和Ade缺陷培养基中正常生长,证实具有转录激活活性,是一个转录激活因子。
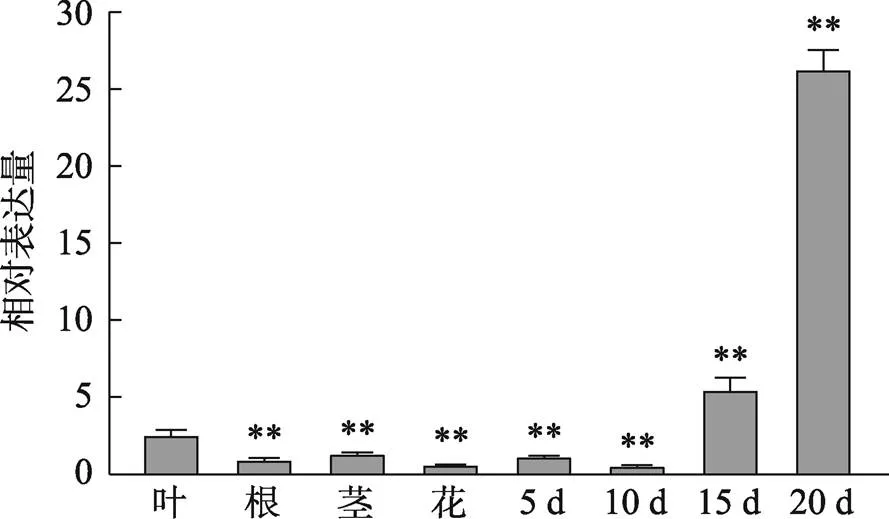
图2 GhTT2在棕色棉ZX1不同组织中的表达模式
显著性分析以叶为对照,以Students’-test确定相对表达量的显著性差异,**< 0.01表示具有显著性差异。5 d、10 d、15 d、20 d为开花后天数。

图3 GhTT2在不同花青素含量棉花中的表达模式
A:不同花青素含量棉花叶片表型;B:棉花花青素含量测定;C:在不同花青素含量棉花中的表达。显著性分析以C312为对照,以Students’-test确定花青素含量及相对表达量的显著性差异,**< 0.01表示具有显著性差异。
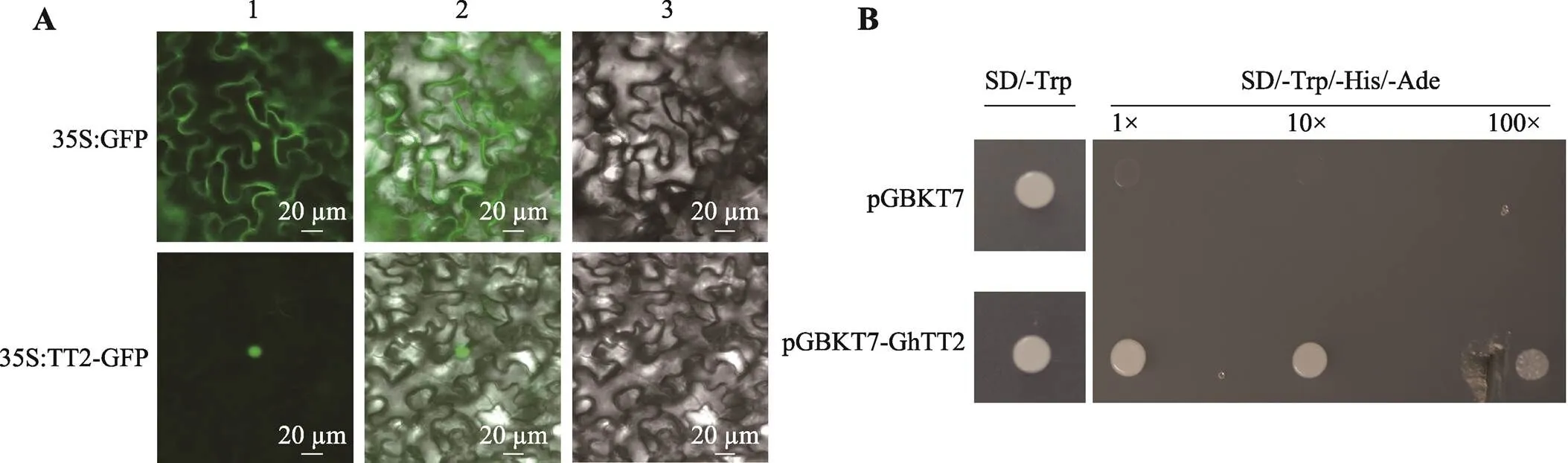
图4 GhTT2的亚细胞定位及转录活性鉴定
A:在烟草细胞中的定位。1:绿色荧光;2:荧光与明场叠加;3:明场。35S:GFP:对照;35S:TT2-GFP:GhTT2-GFP融合蛋白;比例尺为20mm。B:转录激活验证。SD/-Trp:酵母单缺陷型培养基;SD/-Trp/-His/Ade:酵母三缺陷型培养基;pGBKT7-GhTT2:诱饵质粒;pGBKT7:阴性对照。
2.4 GhTT2沉默株系的获得及花青素、原花青素的测定
为了研究的生物学功能,利用VIGS技术对棕色棉ZX1植株基因进行功能干涉。以注射pCLCrVA-的棉花植株作为对照,当注射pCLCrVA-的棉花幼苗叶片呈现白化现象时(图5A),进行阳性苗的干涉效率鉴定。结果表明,阳性植株、-和-中基因显著下调(图5B)。进一步通过干涉效率不同的棉花植株进行花青素和PAs含量测定,结果显示,与对照相比,干涉株系的花青素含量没有明显差异(图5C),而PAs含量显著降低,且与干涉效率的变化趋势相似(图5D)。以上结果表明可能正调控棉花叶片PAs的生物合成。
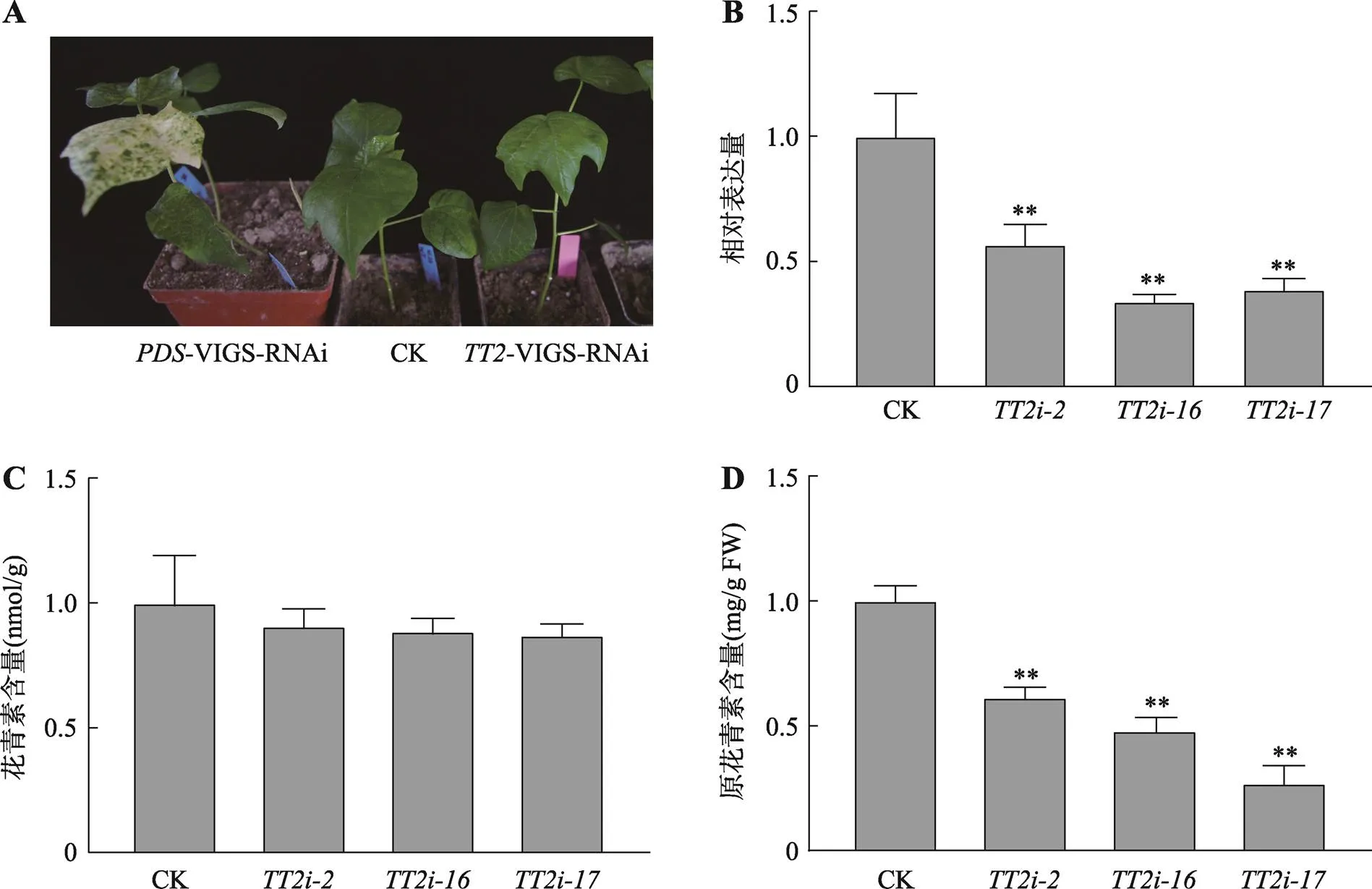
图5 GhTT2沉默株系的获得及花青素、原花青素含量的测定
A:株系表型;B:沉默效率鉴定;C:沉默株系花青素含量测定;D:沉默株系原花青素含量测定。显著性分析以注射空载体pCLCrVA-的棉花植株为对照,以Students’-test确定花青素含量、原花青素含量及相对表达量的显著性差异,**< 0.01表示具有显著性差异。
3 讨论
PAs广泛存在于植物的叶、花、果实和纤维中,不仅在植物生长发育的调节中发挥重要作用,而且参与植物应答各种生物和非生物胁迫[2]。目前PAs生物合成途径是研究最为广泛的植物次生代谢途径之一,其调控机制在转录水平上已基本明确:结构基因和调控基因共同决定PAs的生物合成,调控基因编码的转录因子决定结构基因表达与否及其强弱,而结构基因决定PAs合成的种类和含量。然而要充分理解与认识PAs生物合成途径的分子机制,仅获得转录因子和下游结构基因的对应关系还远远不够,关键基因转录激活和抑制的精确调控机制以及正负调控因子的鉴定及分子机理尚需深入探究。
基因作为典型的R2R3-MYB类转录因子成员,最初在模式植物拟南芥中被鉴定,其在植物次生代谢途径中发挥重要作用[5]。拟南芥基因具有种皮特异性,富集于内表皮及珠孔中,直接结合的启动子区域并激活其表达,从而提高PAs产量[5]。此外,在多个物种中鉴定到同源基因,如杨树(spp)中受真菌诱导表达的型转录因子基因,通过与bHLH和WD40蛋白形成三联体,协同正调控PAs的生物合成且有效提高杨树的抗真菌病能力[15]。玫瑰()中型转录因子基因和协同激活不同结构基因的表达,最终引起PAs积累量增加[16]。棉花型转录因子基因和直接结合和的启动子区域并激活其表达,正调控PAs的生物合成[17]。本研究从陆地棉中克隆了一个拟南芥同源基因(Gh_A05G1167),其转录水平与花青素含量呈相反趋势(图3),抑制该基因功能导致PAs含量显著降低(图5),表明其可能参与调控陆地棉PAs的生物合成。
彩色棉纤维天然具有颜色,是一种生态效益高的特种环保棉[18]。目前彩色棉纤维中具体的色素成分尚未完全解析,已有报道表明彩色纤维主要因不同PAs及其衍生物累积于纤维中腔而呈现不同色泽,而棕色棉纤维色泽形成的前体物质为PAs[19]。棕色棉中与拟南芥高度同源的,在纤维发育过程中,其转录水平显著提高并激活下游结构基因表达,进而调控PAs积累和纤维色泽形成[20]。拟南芥中另一个同源基因协同激活并促进下游结构基因表达从而调控PAs的生物合成和积累,导致棕色棉纤维色泽改变[21]。由此可见,型转录因子基因可作为研究彩色纤维色泽形成的分子靶点,以PAs的生物合成途径作为切入点,探究彩色纤维色泽形成的分子机制。的表达模式分析表明其在棕色棉ZX1纤维中优势表达,具有典型的纤维表达特异性(图2)。利用酵母转化系统,发现该基因编码蛋白具有转录激活功能(图4),然而其在彩色棉纤维色泽形成中是否存在与其他型转录因子基因相似的调控机制,尚需进一步实验证明。
[1] Su QS, Wang S, Sun YQ, Mei J, Ke LP. Advances in biosynthesis and regulation of plant proanthocyanidins., 2021, 43(1): 219–229.
苏全胜, 王爽, 孙玉强, 梅俊, 柯丽萍. 植物原花青素生物合成及调控研究进展. 中国细胞生物学学报, 2021, 43(1): 219–229.
[2] Liu WX, Feng Y, Yu SH, Fan ZQ, Li XL, Li JY, Yin HF. The flavonoid biosynthesis network in plants., 2021, 22(23): 12824.
[3] Dixon RA, Sarnala S. Proanthocyanidin biosynthesis-a matter of protection., 2020, 184(2): 579–591.
[4] Xie DY, Sharma SB, Paiva NL, Ferreira D, Dixon RA. Role of anthocyanidin reductase, encoded by BANYULS in plant flavonoid biosynthesis., 2003, 299(5605): 396–399.
[5] Sharma SB, Dixon RA. Metabolic engineering of proanthocyanidins by ectopic expression of transcription factors in., 2005, 44(1): 62–75.
[6] Vale M, Rodrigues J, Badim H, Gerós H, Conde A. Exogenous application of non-mature miRNA-encoded miPEP164c inhibits proanthocyanidin synthesis and stimulates anthocyanin accumulation in grape berry cells., 2021, 12: 706679.
[7] Gil-Muñoz F, Sánchez-Navarro JA, Besada C, Salvador A, Badenes ML, Del Mar Naval M, Ríos G. MBW complexes impinge on anthocyanidin reductase gene regulation for proanthocyanidin biosynthesis in persimmon fruit., 2020, 10(1): 3543.
[8] Gao YF, Liu JK, Chen YF,Tang H, Wang Y, He YM, Ou YB, Sun XC, Wang SH, Yao YN. Tomatoregulates flavonoid biosynthesis and seed dormancy by interaction with bHLH proteins but not with MYB proteins., 2018, 5: 27.
[9] Yuan JL, Zheng HL, Liang XL, Mei J, Yu DL, Sun YQ, Ke LP. Influence of anthocyanin biosynthesis on leaf and fiber color ofL., 2021, 54(9): 1847–1855.
袁景丽, 郑红丽, 梁先利, 梅俊, 余东亮, 孙玉强, 柯丽萍. 花青素代谢对陆地棉叶片和纤维色泽呈现的影响. 中国农业科学, 2021, 54(9): 1847–1855.
[10] Du QL, Fang YP, Jiang JM, Li XY, Xie X. Cloning, expression analysis and prokaryotic expression of ricegene., 2021, 57(3): 558–568.
杜巧丽, 方远鹏, 蒋君梅, 李向阳, 谢鑫. 水稻基因的克隆、表达分析及原核表达. 植物生理学报, 2021, 57(3): 558–568.
[11] Wang JL, Chen SS, Jiang N, Li N, Wang XY, Li ZP, Li X, Liu HT, Li L, Yang Y, Ni T, Yu CY, Ma JB, Zheng BL, Ren GD. Spliceosome disassembly factors ILP1 and NTR1 promote miRNA biogenesis in., 2019, 47(15): 7886–7900.
[12] Mei J, Jiang N, Ren GD. The F-box protein HAWAIIAN SKIRT is required for mimicry target-induced microRNA degradation in, 2019, 61(11): 1121–1127.
[13] Gao JF, Shen L, Yuan JL, Zheng HL, Su QS, Yang WG, Zhang LQ, Nnaemeka VE, Sun J, Ke LP, Sun YQ. Functional analysis of,andin colored fiber formation ofL., 2019, 19(1): 455.
[14] Yang SC, Zhang M, Xu LQ, Luo ZR, Zhang QL. MiR858b inhibits proanthocyanidin accumulation by the repression ofandin persimmon., 2020, 11: 576378.
[15] Wang LJ, Ran LY, Hou YS,Tian QY, Li CF, Liu R, Fan D, Luo KM. The transcription factorcontributes to the regulation of proanthocyanidin biosynthesis and enhances fungal resistance in poplar., 2017, 215(1): 351–367.
[16] Shen YX, Sun TT, Pan Q, Anupol N, Chen H, Shi JW, Liu F, Deqiang D, Wang CQ, Zhao J, Yang SH, Wang CY, Liu JH, Bao MZ, Ning GG.- and-regulated flavonoid biosynthesis plays a pivotal role in feedback loop responding to wounding and oxidation in., 2019, 17(11): 2078–2095.
[17] Lu N, Roldan M, Dixon RA. Characterization of two TT2-type MYB transcription factors regulating proanthocyanidin biosynthesis in tetraploid cotton,., 2017, 246(2): 323–335.
[18] Sun J, Sun YQ, Zhu QH. Breeding next-generation naturally colored cotton., 2021, 26(6): 539–542.
[19] Liu HF, Luo C, Song W, Shen HT, Li GL, He ZG, Chen WG, Cao YY, Huang F, Tang SW, Hong P, Zhao EF, Zhu JB, He DJ, Wang SM, Huo GY, Liu HL. Flavonoid biosynthesis controls fiber color in naturally colored cotton., 2018, 6: e4537.
[20] Hinchliffe DJ, Condon BD, Thyssen G,Naoumkina M, Madison CA, Reynolds M, Delhom CD, Fang DD, Li P, McCarty J. Thegene is linked to the brown colour and natural flame retardancy phenotypes ofcotton (L.) fibres., 2016, 67(18): 5461–5471.
[21] Yan Q, Wang Y, Li Q, Zhang ZS, Ding H, Zhang Y, Liu HS, Luo M, Liu DX, Song W, Liu HF, Yao D, Ouyang XF, Li YH, Li X, Pei Y, Xiao YH. Up-regulation ofin cotton fibres during secondary wall thickening results in brown fibres with improved quality., 2018, 16(10): 1735–1747.
Cloning and characterization of the MYB transcription factor genein
Rongrong Mu, Qingqing Niu, Yuqiang Sun, Jun Mei, Meng Miao
As one of the important secondary metabolites, proanthocyanidins (PAs) are not only a defense mechanism for plants to cope with biotic and abiotic stresses, but also a key factor affecting the development and quality of plants. Although the biosynthetic and metabolic pathways of proanthocyanidins have been basically clarified in the model plants, the regulatory mechanism in cotton has not been fully elucidated. In this work, a transcription factor gene(transparent testa 2) was cloned from. Its gene structure, expression pattern, subcellular localization, and function were further analyzed. The results show that theGhTT2has a typical MYB domain and is predominantly expressed in fibers. Its transcription level was negatively correlated with anthocyanin content. The GhTT2-GFP fusion protein is located in the nucleus. Moreover, yeast transformation results show that GhTT2 has obvious transcriptional activation characteristics. Furthermore, the content of proanthocyanidins in-silenced cottons is significantly reduced, indicating that GhTT2 may be involved in regulation of the proanthocyanidins biosynthesis in. These results provide a reference for further elucidating the molecular mechanisms of MYB transcription factors involved in the regulation of the biosynthetic pathway of PAs.
; proanthocyanidins; transcription factor;; functional analysis
2022-04-06;
2022-05-24;
2022-06-29
国家自然科学基金青年项目(编号:32001591)和浙江理工大学科学研究资助项目(编号:19042401-Y)资助[Supported by the National Natural Science Foundation of China (No. 32001591) and the Science Foundation of Zhejiang Sci-Tech University (No. 19042401-Y)
慕蓉蓉,在读硕士研究生,专业方向:分子遗传学。E-mail: rongrongmu1020xx@163.com
梅俊,博士,讲师,研究方向:分子遗传学。E-mail: mj2019@zstu.edu.cn
苗蒙,博士,讲师,研究方向:分子遗传学。E-mail: miaom@whu.edu.cn
10.16288/j.yczz.22-100
(责任编委: 孔令让)
