足月子痫前期孕妇胎盘组织中DLX3基因启动子甲基化状态及其差异表达
2022-08-25孙修丽牛三强徐振宇谭宪岩于康军
孙修丽 牛三强 徐振宇 谭宪岩 于康军
子痫前期是一种严重的人类妊娠多系统疾病,其特点是妊娠期高血压和蛋白尿,甚至出现肾功能衰竭、肝功能不全和神经系统表现等[1-2]。尽管子痫前期是导致孕产妇死亡的主要原因之一,但其病因在很大程度上是未知的。先前的研究[3]表明,子痫前期的发病机制与遗传和表观遗传因素有关。后者包括许多方面,例如组蛋白修饰和DNA甲基化[4]。与遗传因素不同,DNA甲基化是可逆的,这为治疗提供可能。远端缺失同源盒3(homeobox gene distal-less3,DLX3)基因是同源异型盒基因家族中的一员,在调控胚胎生长发育方面起到重要作用[5]。据报道[6],DLX3基因在子痫前期胎盘组织中低表达,其低表达的原因尚不明确。为此,本研究分析足月孕妇胎盘组织中DLX3启动子甲基化状态对基因表达和子痫前期严重程度的影响,旨在为子痫前期治疗提供参考。
1 资料与方法
1.1 一般资料 选取2020年1月至2021年1月在亳州市人民医院足月分娩的子痫前期孕妇50例作为观察组(其中重度子痫前期20例)。子痫前期的诊断标准参照2020年中国妊娠期高血压疾病诊治指南[7]。观察组纳入标准:①均为单胎足月妊娠;②不伴有其他妊娠合并症;③不伴有精神异常和智力障碍。排除标准:①孕前患有原发性高血压、慢性肾病、心脏病的孕妇;②孕前吸烟,饮酒和长期吸毒;③辅助生殖妊娠。对照组为同期足月分娩无原发性高血压及其他并发症的孕妇36例。本研究取得亳州市人民医院伦理委员会的批准(伦理编号:2022014),且均签署知情同意书。两组孕妇既往妊娠次数、孕前身体质量指数(body mass index, BMI)、年龄,以及分娩胎龄、新生儿性别、出生体质量以及5分钟 Apgar评分比较,差异均无统计学意义(P<0.05)。见表1。
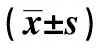
表1 观察组和对照组的临床数据比较
1.2 方法
1.2.1 仪器和试剂 基因组DNA试剂盒(货号:DP331,北京天根生物),CpG甲基转移酶(货号:CB25768516,上海泽叶生物),EZ DNA甲基化试剂盒(货号:D5005,北京天漠科技),Trizol试剂(型号:PH1420,日本TaKaRa),SYBR Green PCR试剂盒(货号:208057,北京诺博莱德科技),ABI Veriti96 PCR扩增仪 (美国ABI公司),甲基化引物及PCR引物合成均由上海生工生物技术有限公司合成。
1.2.2 样品采集 取出胎盘后,30 min内从胎盘的离母体面5 mm的深度收集胎盘绒毛组织样本(0.5 cm×0.5 cm)。这些样品在无菌磷酸盐缓冲盐水中洗涤除去母体血液,并在-80℃环境下保存备用。
1.2.3 DNA分离和甲基化特异性PCR(methylmion specific PCR,MSP) 根据制造商的说明,使用基因组DNA试剂盒从裂解的胎盘绒毛样品中分离基因组DNA。用CpG甲基转移酶处理的人胎盘基因组DNA作为甲基化阳性对照,非甲基化阳性对照购自北京艾德科技公司的A&D fastTM人非甲基化标准品。使用EZ DNA甲基化试剂盒,将基因组DNA进行亚硫酸氢盐处理。对处理后的DNA进行MSP,反应条件: 98℃变性15 s,退火15 s,72℃延伸45 s,35个循环,最后在72℃下延伸3 min,MSP产物参考文献[8]行凝胶电泳进行甲基化判读。DLX3上下游甲基化引物(退火60℃):5’-GTAATGGTGTAAGCGTTTTTCG-3’和5’-ACCACTCATCCTAA CGAACG-3’; DLX3非甲基化上下游引物序列(退火61℃):5’-GGTAATGGTGTAAGTGTTTTTTGG-3’和5’-AACCACTCATCCTA ACAAA CACT-3’。
1.2.4 RNA提取和实时定量逆转录聚合酶链反应(real time quantitative PCR,RT-qPCR) 按照说明书,使用Trizol试剂从胎盘中分离总RNA,然后用不含RNase的DNase I处理,最后评估RNA的浓度和纯度后,通过反转录产生cDNA。通过SYBR Green PCR试剂盒检测DLX3的表达。使用2-ΔΔCt方法评估DLX3基因的相对mRNA表达水平,并以内参对照β-action进行标准化。扩增条件:95℃ 5 min,98℃ 10 s,退火30 s,72℃ 45 s,38个循环,最后在72℃延伸10 min,实验进行3次。DLX3基因的上下游引物(退火55℃):5’-TACACCTACCACCACCAAT-3’和5’-CTCCTTCA CCGACACTG-3’; β-action内参基因上下游序列(退火57℃):5’-AACTCCATCATGAAGTGTGACG-3’和5’-GATCCACATCTGCTGGAAGG -3’。

2 结果
2.1 足月子痫前期孕妇胎盘中DLX3基因启动子甲基化情况 与对照组的胎盘中DLX3基因启动子的甲基化率相比(8/36,22.22%),足月子痫前期孕妇的胎盘中其甲基化率升高(38/50,76.00%),差异具有统计学意义(χ2=24.331,P<0.001)。 见图1。

2.2 DLX3基因mRNA表达情况 RT-qPCR结果显示,对照组胎盘中DLX3基因mRNA高表达(0.98±0.17),而足月子痫前期孕妇胎盘组织中DLX3基因mRNA表达下降(0.41±0.08),差异具有统计学意义(t=17.761,P<0.001)。重度子痫前期较轻度子痫前期孕妇胎盘组织中DLX3基因mRNA表达降低[(0.38±0.08)比(0.43±0.08)],差异具有统计学意义(t=2.547,P=0.014)。
2.3 DLX3基因启动子区甲基化率与子痫前期严重程度的比较 轻度子痫前期孕妇胎盘中DLX3基因启动子区甲基化率为63.33%(19/30),重度子痫为95.00%(19/20),差异具有统计学意义(χ2=4.975,P=0.026)。
3 讨论
子痫前期的病理生理基础是由于胎盘滋养细胞侵袭性缺陷以及胎盘螺旋动脉异常重塑,导致胎盘异常表达的转录因子释放到母体血液循环中,从而诱发母体疾病[9]。基于子痫前期的临床症状在胎盘娩出后迅速消失,胎盘因素在子痫前期发病机制中的作用一直是研究的热点。已有研究[10]通过比较子痫前期和正常孕妇胎盘中基因表达的改变,发现基因甲基化在子痫前期发展中起到一定作用。但是基因组甲基化的变化受各种因素影响。Yuen等[11 ]研究表明,早发型和晚发型子痫前期之间甲基化谱不同,但他们没有讨论胎龄对甲基化水平的影响。因此,本研究通过分析足月子痫前期和足月正常分娩孕妇胎盘组织中基因甲基化情况来消除胎龄的影响,探讨甲基化对基因表达和疾病严重程度的影响。
DLX3基因是一类重要的转录因子,是正常胎盘形成所必需的[5]。胎盘中DLX3通过调节基质金属蛋白酶 9(matrix metalloprotein 9,MMP-9)的表达,导致母体胎盘螺旋动脉重铸不足[12]。MMP-9基因在小鼠模型中的表达缺失导致妊娠晚期的母体出现高血压,类似于子痫前期[13]。Li等[14]研究表明,DLX3可能通过调节胎盘生长因子(placental growth factor,PGF)的异常表达导致子痫前期。与赵先兰等[6]的研究一致,本研究显示,与正常足月妊娠相比,足月子痫前期孕妇胎盘中DLX3基因mRNA表达水平降低,提示胎盘中DLX3基因的下调可能导致了子痫前期的发生。考虑DLX3基因的表达降低可能影响胎盘螺旋动脉及血管床的重铸,进而导致胎盘缺血、缺氧,是子痫前期发病机制之一。
妊娠期胎盘滋养层细胞的异常分化和增殖常涉及胎盘组织表观遗传学状态的变化,其主要通过改变基因组DNA对转录因子的抑制或促进,从而影响基因活性[15]。本研究结果表明,与正常足月妊娠的胎盘中DLX3基因启动子的甲基化率相比,足月子痫前期孕妇的胎盘中甲基化率明显升高,推测子痫前期孕妇胎盘中DLX3基因启动子的异常高甲基化状态可能导致DLX3基因表达受到抑制。Yeung等[16]的研究显示,子痫前期胎盘的WNT2 基因启动子区中DNA 甲基化率增加,在重度子痫前期中甲基化率增加更明显,且在重度子痫前期孕妇胎盘中 WNT2 表达降低。本研究与其相似,重度子痫前期孕妇胎盘组织中DLX3启动子区甲基化率较轻度子痫前期高,与DLX3 mRNA的表达相反,提示DLX3基因表达受甲基化的影响,为临床治疗提供了思路。
综上所述,足月子痫前期孕妇胎盘中DLX3启动子甲基化率升高,且重度子痫前期甲基化率更高。DLX3启动子甲基化可能抑制了DLX3的表达,进一步影响子痫前期的严重程度。但本研究未对非足月子痫前期胎盘组织中DLX3基因启动子区的甲基化情况进行检测,后续有待改进。
