腹腔镜袖状胃切除术经肠-肝轴对肥胖患者NAFLD的影响
2022-08-25何亚伟陈皖京程云生
何亚伟 陈皖京 于 刚 程云生 汪 泳
肥胖是一种由于各种环境和生理因素改变使得机体内出现能量代谢不平衡从而导致脂肪异常堆积的病理状态,已逐渐成为我国医疗体系所面临的重大挑战。目前认为,糖尿病、非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)等疾病的发生与肥胖都有着密不可分的联系。其中NAFLD已经成为全球范围内其他肝脏相关疾病的主要原因,并可能成为终末期肝病的主要诱发因素[1]。相关研究[2]显示,肠道微生物群落参与了NAFLD患者肝脏脂肪变性和纤维化的发生与发展,细菌源性产物进入门脉循环可以诱导先天性免疫的触发,导致大量炎症因子释放,促进肝脏炎性病变。目前认为,肠-肝轴(肠道、微生物群和肝脏通过门静脉循环相互交流的复杂网络)在肝脏疾病的发展及预后中可能具有一定的作用。然而在肥胖患者中,长期不良饮食习惯导致的肠道菌群失调以及体内脂肪异常堆积也是极为常见的问题。因此研究减重手术对肥胖患者肠道菌群、NAFLD的影响,以及肠-肝轴在其中调节作用的机制具有重要意义。减重代谢手术是目前国内外公认的可以迅速、有效、长期治愈病态性肥胖的方法。Yeo等[3]的研究表明,减肥手术可以减轻体质量的同时改善NAFLD纤维化。另有研究[4]发现,利拉鲁肽可以改善肝脏脂肪变性,其机制可能是通过下调肿瘤坏死因子-a(tumor necrosis factor-a,TNF-a)等炎性介质的表达来实现的。但目前减重手术对肥胖患者肠道菌群和NAFLD的影响、两者的相互关系以及肠-肝轴的调节机制尚不完全清楚。因此,本研究比较了腹腔镜袖状胃切除术前后肥胖患者脂肪肝、血清炎症因子以及肠道菌群的变化情况,以探究减肥手术引起的肠道菌群的变化对肥胖患者NALFD改善的可能机制。
1 资料与方法
1.1 一般资料 选取2020年7月至2021年1月在安徽医科大学第二附属医院胃肠与减重代谢外科就诊并接受LSG治疗的30例肥胖合并NAFLD患者为研究对象,其中男性11例,女性19例,年龄18~49岁,平均 (31.60±7.66)岁,身体质量指数(body mass index,BMI)33.21~62.10 kg/m2,平均(43.90±22.98)kg/m2。纳入标准:①BMI≥32.5 kg/m2;②年龄为16~65岁;③根据2001年中华肝脏病学会脂肪肝和酒精性肝病学组制定的非酒精性脂肪诊断标准[5],患者经过腹部超声检查符合NAFLD诊断;④排除手术禁忌后均接受统一减重术式——腹腔镜袖状胃切除术。排除标准:①术前存在长期大量饮酒史或正处于急慢性病毒性肝炎状态或有严重的其他肝脏疾病; ②术前常规检查提示存在感染和/或严重疾病不能耐受手术;③临床资料不完整。剔除标准:术后合并有手术相关并发症。本研究过程均已告知患者,并取得患者本人或其委托人的书面同意,且获得安徽医科大学第二附属医院伦理委员会的批准[伦理审批文件号:YX2021-017(F1)]。
1.2 研究方法 所有患者入院后完善常规检查并留取血液、粪便标本,排除明显手术禁忌症后予以行统一减肥术式—腹腔镜袖状胃切除术,术后3个月完善患者随访资料并再次留取血液及粪便标本,对比分析术前和术后3个月的临床资料,进行血清炎症因子与肝脏评分的相关性分析。
1.3 观察指标
1.3.1 体质量参数 分别于术前和术后3个月于我院门诊由我科病案管理师记录患者身高、体质量、腰围,并计算BMI。
1.3.2 实验室指标 分别于术前及术后第3个月清晨空腹状态抽取患者静脉血5 mL,置于乙二胺四乙酸(EDTA)管中,以4 000 r/min,4℃离心10 min,取上清液保存在-80℃冰箱待用。采用酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)检测血清中TNF-a、白介素-1β(interleukin-1beta, IL-1β)、IL-4水平。采用化学发光免疫法分析三酰甘油(triacylglycerol, TG)、天冬氨酸转氨酶(aspartate transaminase, AST)、丙氨酸转氨酶(alanine transaminase, ALT)、γ-谷氨酰转移酶(γ-gamma-glutamyltransferase, γ-GGT)水平。采用流式细胞术测定血小板(platelet, PLT)含量。
1.3.3 粪便菌群16S核糖体RNA基因测序 16S rRNA扩增子测序由Genesky生物技术公司(上海,中国)完成。使用FastDNA©SPIN试剂盒(MP Biomedicals, Santa Ana, CA, USA)提取粪便总DNA。通过琼脂糖凝胶电泳检测基因组DNA的完整性,使用Nanodrop 2000和Qubit3.0分光光度计(Thermo Fisher Scientific, Waltham, Massachusetts, USA)检测基因组DNA的浓度和纯度。用以下引物扩增16S rRNA基因V3-V4高变区:341F (5’-CCTACGGGNGGCWGCAG-3’); 805R (5’-GACTACHVGGGTATCTAATCC-3’)。测序使用Illumina NovaSeq 6000测序仪(San Diego, California, USA)。


2 结果
2.1 手术前后人体测量学及一般实验室指标变化 手术后3个月随访资料显示,患者的BMI、体质量、腰围、AST、ALT、GGT、TG、TC等在术后3个月均降低,且差异有统计学意义(P<0.05),PLT手术前后差异无统计学意义(P>0.05)。见表1。
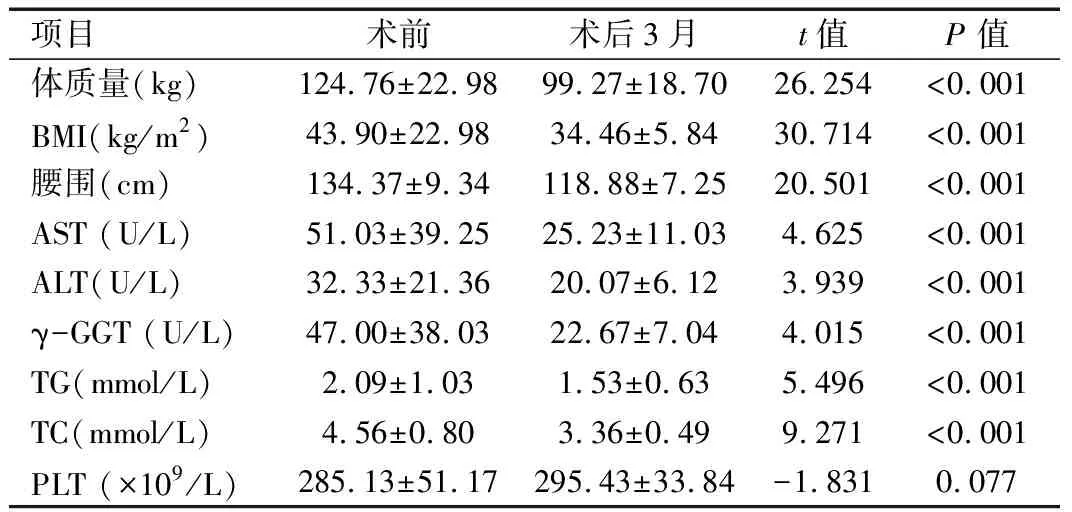
表1 术前和术后3个月体质量参数及一般实验室指标
2.2 LSG术前后炎症因子水平、FLI、FIB-4评分比较 LSG术后3个月,患者血清IL-4较术前上升,而 IL-1β和TNF-a均较术前下降,FLI和FIB-4评分低于术前,差异均有统计学意义(P<0.05)。见表2。

表2 术前和术后3个月炎症因子与肝脏评分
2.3 LSG术前后肠道菌群的变化及与炎症因子及其相关性 术后3个月肠道菌群分析显示拟杆菌[(0.536±0.115)(术前)比(0.577±0.072)(术后),P=0.360]和梭杆菌[(0.007±0.013)(术前)比(0.034±0.045)(术后),P=0.046]数量增加,厚壁菌[(0.118±0.089)(术前)比(0.051±0.033)(术后),P=0.036]、变形菌[(0.078±0.089)(术前)比(0.065±0.087)(术后),P=0.757]数量减少(图1A),患者肠道菌群alpha多样性增加[(3.62±0.46)(术前) 比(3.92±0.52)(术后),P=0.122]。见图1B。术前细胞因子与微生物的Spearman相关性分析显示,梭杆菌与TNF-a(r=-0.203,P=0.031),IL-1β(r=-0.329,P=0.023)呈负相关,β-变形菌与IL-1β(r=0.065,P=0.798)呈正相关,与IL-4(r=-0.128,P=0.613)呈负相关,厚壁菌与TNF-a(r=-0.315,P=0.033)呈负相关,与IL-1β(r=0.459,P=0.046)呈正相关(图1 C)。

注:A,手术前后部分肠道菌群的变化趋势;B,术前和术后3个月肠道菌群Alpha多样性的变化;C, 细胞因子与菌群的Spearman相关性分析。
2.4 术前术后炎症因子与FLI、FIB-4评分的相关性 术前相关性分析显示FIB-4与IL-1β(r=0.373,P=0.043)、TNF-a(r=0.435,P=0.016)呈正相关,与IL-4呈负相关(r= -0.410,P=0.024);FLI与IL-1β(r=0.402,P=0.028)、TNF-a(r=0.391,P=0.033)呈正相关,与IL-4呈负相关(r=-0.523,P=0.003)。见图2。术后FIB-4与IL-1β(r=0.382,P=0.037)、TNF-a(r= 0.413,P=0.023)呈正相关,与IL-4呈负相关(r=-0.425,P=0.019);FLI与IL-1β(r=0.362,P=0.049)、TNF-a(r= 0.363,P=0.048)呈正相关,与IL-4呈负相关(r=-0.426,P=0.019)。见图3。
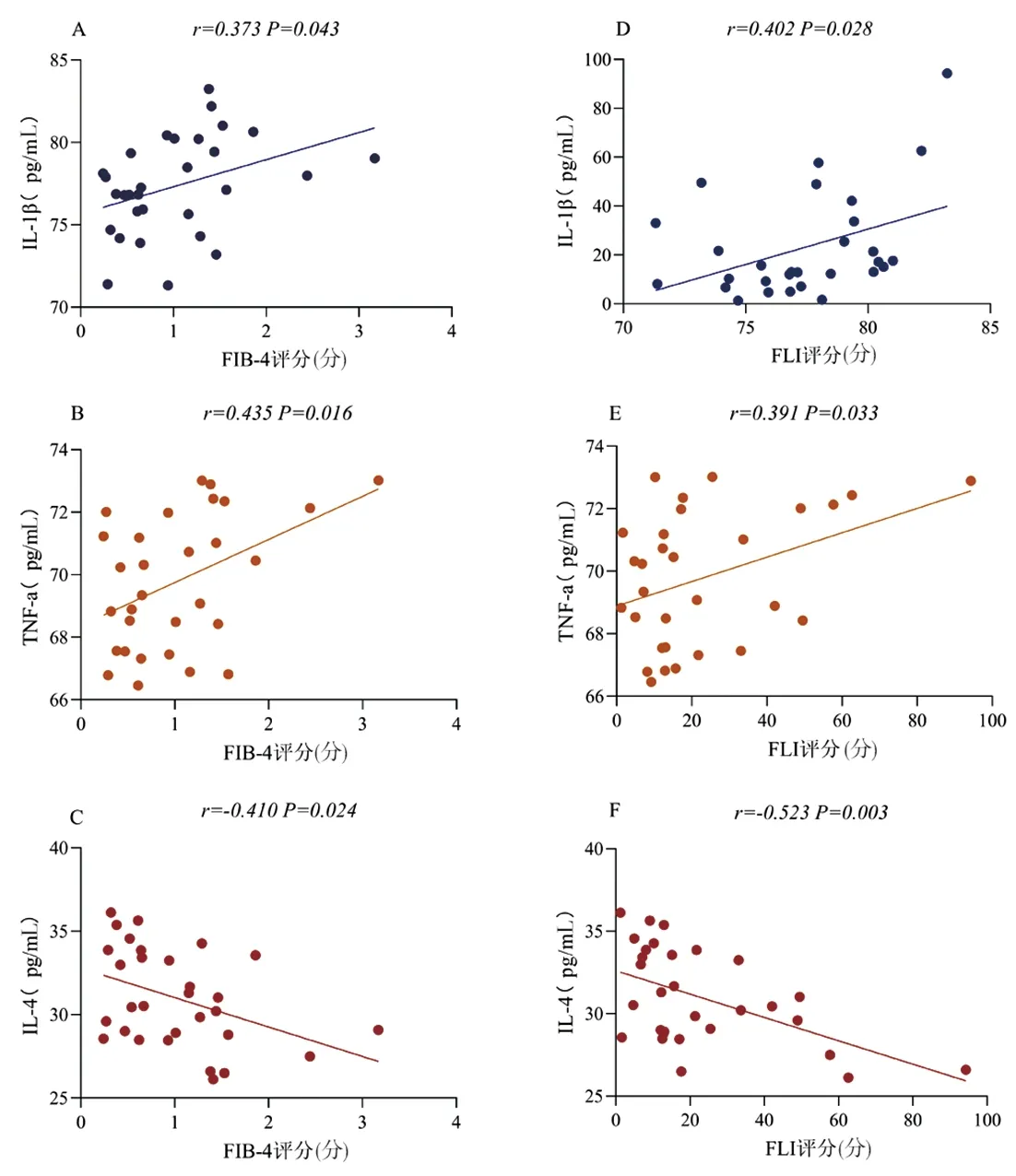
图2 术前细胞因子与肝脏评分的相关性分析
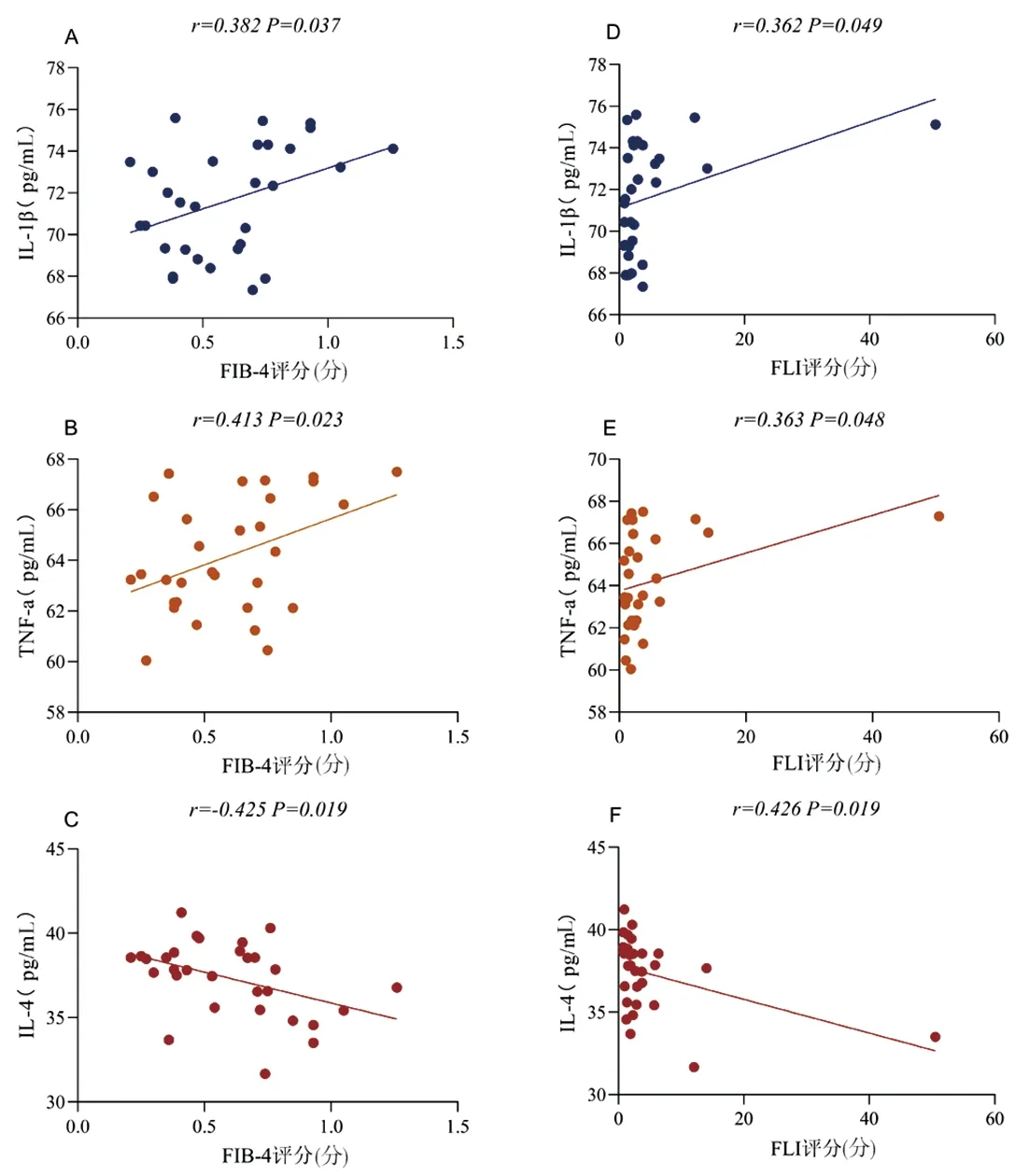
图3 术后细胞因子与肝脏评分的相关性分析
3 讨论
在全球范围内,肥胖和超重的人数呈现出急剧增加的趋势,其导致的心血管疾病、NAFLD等的风险也随之增加。其中NAFLD已成为世界上最常见的慢性肝病之一,它被定义为一系列由肝脏脂肪变性引发的肝脏病理变化,并可能会发展为肝脏坏死性炎症和纤维化[8]。肥胖患者由于饮食习惯的改变多有肠道菌群失调表现,肠道菌群的紊乱可导致肠道屏障功能受损,而肠道菌群是其与宿主相互作用的统一体,因此菌群紊乱能够导致机体生态失调。虽然肠道菌群对人体的作用已被证实,但在NAFLD中,菌群与宿主相互作用的机制并不完全清楚,因此本研究的目的是探索LSG手术引起的肠道菌群的变化对肥胖患者NALFD改善的可能机制。
肠道菌群主要由4个门组成:厚壁菌门、拟杆菌门、放线菌门和变形菌门,包括1 000余种微生物,其中约90%的菌群属于厚壁菌门和拟杆菌门,厚壁菌门/拟杆菌门的比值被认为是影响肠道菌群紊乱的重要因素。研究[9]表明,NAFLD患者的肠道微生物群有显著的改变,这与本研究结果相同。同时,紊乱的肠道菌群可以通过增加肠道通透性和激活免疫反应来促进NAFLD的发病和进展[10]。有研究[11]认为,许多效应是由共生细菌产生的活性代谢产物介导的,这些代谢产物能够参与调节NAFLD的生理和病理过程。肠道环境的紊乱和菌群的失衡程度与脂肪肝的严重程度呈正相关[12],与本研究一致,即NAFLD患者微生物群落的紊乱与炎症因子具有显著相关性,而且炎症因子与FLI、FIB-4评分呈现显著相关。此外肠道菌群的改变和肠道通透性的增加导致了肝脏与肠源性细菌接触机会的增加,其释放的大量促炎因子既可以参与脂质调节和NAFLD的发病,又可以通过门静脉迅速转移到肝脏,诱导肝脏炎症和纤维化,促进相关肠-肝轴的改变,加速NAFLD的发展[13]。Ruiz等[14]的研究显示,高脂饮食喂养再进行抗脂肪处理的大鼠血清促炎因子如IL-1β、 TNF-α水平降低,而抗炎因子IL-4水平升高,这与本研究中患者袖状胃术后炎症因子变化一致,同时其对该组大鼠肝脏解剖发现脂肪沉积较单纯高脂喂养的大鼠明显减轻,这与本研究对肝脏相关评分的变化相同。此外,Das等[15]的研究得出轻度纤维化和中度纤维化患者血清IL-1β、TNF-a、IL-4之间差异明显,这说明这些炎症因子与肝脏纤维可能存在一定程度的相关性,这与本研究结果一致。相关研究[16]表明, IL-1β, TNF-a等炎性因子的过表达能够激活肝脏星状细胞以及其它相关细胞的活动,如Ⅰ型胶原和Ⅳ型胶原细胞,从而增强细胞外基质的表达,启动肝脏纤维化并加速纤维形成,而IL-4则可以对多种肝损害起到保护作用。研究[17]表明,IL-4可以激活M2型巨噬细胞,参与组织重塑和免疫调节进程,从而改善肝脏纤维化,而IL-1β和TNF-a等又可以上调M1巨噬细胞的表达,导致M1/M2极化,从而诱导肝脏脂肪堆积及炎性改变,该过程可能与CaMKK β/ AMPK通路介导的M1/M2去极化被抑制有关。IL-1β和TNF-a也可以通过磷酸化核转录因子C/EBPβ Thr235来上调11β-HSD1的表达,而 11β-HSD1可以与下游肝脏等多种受体结合影响脂质代谢,促进高血脂、脂肪肝等的发生[18]。
本研究中,LSG可改善肥胖患者肠道菌群丰度及分布,同时也可以改善NAFLD,这可能与体内肠道菌群的改变介导的炎症介质水平的变化有关,因此对于NAFLD患者可适当予以益生菌的补充来改善肠道菌群,从而调节炎症水平来改善肝脂肪变性和纤维化的发展。然而本研究存在一定局限性,一是随访时间较短,无法对术后患者菌群改变的长期效应以及其对NAFLD改善的长期效果进行评估;二是样本量小,后续有待改进;三是未能对肠道菌群影响NAFLD发生发展的具体生理病理机制进行揭示。
综上所述,LSG可以改善肥胖人群肠道菌群分布及丰度,降低了炎症因子水平,改善了炎症因子介导的肝脏相关损害,这对病态性肥胖患者的NAFLD的治疗具有一定的临床指导意义。
