软脂酸对体外培养大鼠髓核细胞的影响
2022-08-25张月东
张月东 王 玫 刘 强 赵 建
1. 泰安市中心医院骨科,山东 泰安 271000;2. 山东第一医科大学(山东省医学科学院)医学信息工程学院,山东 泰安 271016
临床研究发现,高脂血症可能会加重腰椎间盘的变性,增加椎间盘退变的风险[1-2],加重腰椎间盘退变程度[3];另外,高甘油三酯和高总胆固醇是颈椎病的危险因素,能够加重颈椎间盘退变[4]。但脂代谢异常影响髓核细胞的具体机制尚不明确。软脂酸(palmitic acid,PA)作为血脂的重要组成成分,由机体脂肪代谢分解产生,对机体血管内皮细胞有较大影响,并且随浓度和时间作用的不同引起血管内皮细胞的凋亡,高浓度的软脂酸直接影响血管内皮细胞的增殖,促进炎性反应,增加血管动脉粥样硬化的风险[5-6]。另外,PA 还可引起低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)升高[7],导致机体脂代谢紊乱,引起相应节段椎动脉粥样硬化,椎体软骨终板渗透能力下降致髓核细胞的营养供应减少,最终促进髓核细胞凋亡[8]。目前研究较少关注细胞水平下软脂酸对髓核细胞的直接影响,因此本实验通过软脂酸刺激髓核细胞,应用流式细胞仪检测细胞凋亡、逆转录PCR(reverse transcription-PCR,RTPCR)技术检测细胞外基质基因转录水平,初步探讨软脂酸对髓核细胞凋亡的影响。
1 材料和方法
1.1 试剂和材料
软脂酸(P5585)、无脂肪酸牛血清白蛋白(FFAfree BSA)、胰蛋白酶、Ⅱ型胶原酶购自Sigma 公司;胎牛血清(FBS)、RIPA 裂解液、蛋白酶抑制剂(PMSF)、细胞凋亡检测试剂盒购自碧云天公司(Beyotime);羊抗鼠aggrecan 抗体购自Santa Cruz 公司;兔抗鼠collagen Ⅱ抗体购自Abcam 公司;5 mM软脂酸干预液配制:51.2 mg PA 置于70 ℃水浴锅,无水乙醇溶解,加0.1 M NaOH 调节至pH 值中性,与10%无脂肪酸牛血清白蛋白(FFA-free BSA)配比制备;细胞培养箱(德国Heraeus公司)、化学发光荧光成像系统AI600(美国GE 公司)、罗氏PCR 仪(德国Roche 公司);SPF 级健康雄性Wistar 大鼠,8~10周龄,购自山东大学动物实验中心。
1.2 大鼠髓核细胞的分离和培养
超净台上切取大鼠椎间盘组织,以刮匙取出髓核,剪成大小约1 mm3的碎块,用0.25%胰蛋白酶37 ℃下消化15 min,以800 r/min 离心5 min;弃上清液,用0.2%Ⅱ型胶原酶37 ℃下消化4 h,无菌200 目筛网过滤组织残渣,以800 r/min 离心5 min;弃上清液,用含1%FBS 的DMEM/F12 培养基冲洗,以800 r/min 离心5 min,弃上清液,同法洗涤髓核细胞3 次。细胞接种于25 cm2的培养瓶中,加入含10%FBS、0.1%青霉素+链霉素双抗的DMEM/F12细胞培养基,最后置于37 ℃、5%C02的恒温培养箱中培养。每隔3 天原代髓核细胞换液,细胞融合至80%~90%时,用0.25%胰蛋白酶消化传代。
1.3 免疫荧光检测
弃细胞培养基,冰PBS洗涤后加入丙酮,置于冰上固定15 min,0.4% Triton X-100 行细胞打孔20 min,随后加入山羊血清200 μL,室温下封闭1 h;弃血清,加入1∶400的一抗,置于湿盒4 ℃冰箱过夜,PBS洗涤3次,加入FITC标记的1∶200的荧光二抗,避光孵育1 h,PBS洗涤3次;培养板孔中加入DAPI,室温下避光染核5 min,荧光显微镜下避光拍照。
1.4 软脂酸对髓核细胞影响的浓度及时间分组
1.4.1 P3代大鼠髓核细胞饥饿处理12 h,随后加入无FBS的DMEM/F12培养基,分别应用0(空白对照组)、100、200、400、800 μmol/L浓度的软脂酸进行干预,于37 ℃、5%C02的细胞培养箱中培养24 h。因软脂酸的配制使用了无水乙醇溶解,为了排除其对髓核细胞的影响,设计了0.5%无水乙醇组。
1.4.2 P3 代大鼠髓核细胞饥饿处理12 h,随后加入无FBS 的DMEM/F12 培养基,用800 μmol/L 浓度的软脂酸进行干预,于37 ℃、5%C02的细胞培养箱中分别培养0、12、24、36、48、60 h。
1.5 细胞凋亡检测
软脂酸分别以不同浓度和时间干预大鼠髓核细胞后,应用流式细胞仪Annexin V-FITC/PI 染色法检测细胞凋亡,适量0.25%胰蛋白酶消化收集细胞,PBS 洗涤后重悬,加入190 μL Annexin V-FITC结合液及10 μL 碘化丙啶(PI)染色液,随即进行流式细胞仪检测。
1.6 实时荧光定量PCR检测
提取髓核细胞RNA,逆转录反应采用10 μL 体系进行,RT-PCR 采用20 μL 体系进行,最终解离曲线用2-DDCt法进行统计学分析。内参及目标引物序列:①Aggrecan:5′-3′,TGAATGGGAGCCAGCCTACA;3′-5′,TTTCGGTGTGTTCCTCTGCT。②Col II:5′-3′,AGAGCAAGGAGAAGAAGCACA;3′-5′,TGGACAG TAGACGGAGGAAAGT。③β-actin:5′-3′,CCCATCT ATGAGGGTTACGC;3′-5′,TTTAATGTCACGCACGA TTTC。
1.7 统计学分析
采用SPSS 17.0软件处理,多样本之间参数比较采用单因素方差分析(One-way ANOVA),结果以均数±标准差(xˉ±s)表示。检验水准α=0.05。
2 结 果
2.1 髓核细胞鉴定表达
蛋白多糖(Aggrecan)和Ⅱ型胶原(Col Ⅱ)在大鼠髓核细胞内具有软骨表型特征。免疫荧光检测显示,P3 代细胞胞质呈黄绿色染色、细胞核呈深蓝色染色,鉴定提示提取细胞Aggrecan 和Col Ⅱ胶原呈髓核细胞阳性表达(图1)。

图1 免疫荧光鉴定大鼠髓核细胞
2.2 软脂酸促髓核细胞凋亡的浓度依赖
2.2.1 不同浓度的软脂酸对髓核细胞凋亡的影响 Annexin V-FITC/PI 染色法检测结果显示,共同培养24 h 后,与空白对照组和0.5%无水乙醇组相比,在100、200、400、800 μmol/L 软脂酸的刺激下,髓核细胞出现不同程度的凋亡,其中在800 μmol/L的软脂酸刺激下髓核细胞凋亡率达到最高(P<0.01,图2)。0.5%无水乙醇组与空白对照组相比细胞凋亡率差异无统计学意义((P>0.05);其他组随软脂酸浓度的增加,凋亡率逐渐升高。

图2 Annexin V-FITC/PI染色法检测不同浓度PA对髓核细胞凋亡的影响(*P<0.01)
2.2.2 不同浓度软脂酸对髓核细胞软骨表型基因表达的影响 RT-PCR 检测结果显示,共同培养24 h 后,与空白对照组和0.5%无水乙醇组相比,在100、200、400及800 μmol/L 软脂酸的刺激下,髓核细胞内Aggrecan 及Collagen Ⅱ基因表达水平逐渐 降 低,其 中 在800 μmol/L 时 表 达 最 低(P<0.01),而0.5%无水乙醇组与空白对照组基因表达差异无统计学意义((P>0.05,图3)。结果表明,软脂酸抑制了髓核细胞外基质的合成代谢,并随诱导程度的加大,合成代谢程度越来越低。

图3 RT-PCR检测不同浓度PA对髓核细胞软骨表型基因表达的影响(*P<0.01)
2.3 软脂酸促髓核细胞凋亡的时间依赖
2.3.1 不同时间软脂酸刺激对髓核细胞凋亡的影响 Annexin V-FITC/PI 染色法检测结果显示,在800 μmol/L 软脂酸刺激下,12、24、36、48、60 h时,髓核细胞出现不同程度的凋亡,其中在36 h时凋亡率基本达到最高(P<0.01);与36 h 相比,在48、60 h时凋亡率无明显差异(图4)。结果表明,在软脂酸的诱导下髓核细胞发生凋亡,并随诱导时间的延长,细胞凋亡率愈来愈高。

图4 不同时间PA刺激对髓核细胞凋亡的影响(*P<0.01)
2.3.2 不同时间软脂酸刺激对髓核细胞软骨表型基因表达的影响 细胞凋亡检测发现,在800 μmol/L 软脂酸刺激下,随时间延长,24 h 后细胞凋亡率显著增高,最高达80%以上,实验中无法提取有效目的RNA,故本次实验仅分析0、12 及24 h 3 个时间段。RT-PCR 检测结果显示,12、24 h时髓核细胞内Aggrecan 及Collagen Ⅱ的基因表达水平逐渐降低,其中在24 h 时表达最低(P<0.01)(图5)。结果表明,软脂酸抑制了髓核细胞外基质的合成代谢,并随诱导时间的延长,合成代谢程度越来越低。
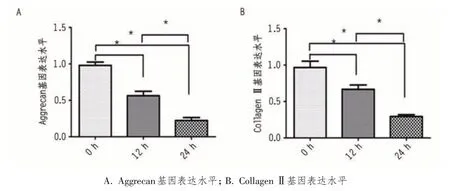
图5 RT-PCR检测不同时间软脂酸刺激对髓核细胞软骨表型基因表达的影响(*P<0.01)
3 讨论
研究发现,炎症介导反应、氧化应激反应及细胞外基质代谢因子的调控在髓核细胞的退变过程中发挥着重要的调节作用[9-11]。同样,营养物质代谢对椎间盘细胞的合成与分解也起着重要的调控作用[12],营养供应不足导致髓核细胞凋亡,继而引起细胞外基质代谢紊乱,进一步加重椎间盘变性[13-15]。以往研究注重糖类代谢异常在椎间盘退变发生中的作用[16-17],但较少关注脂类代谢紊乱对椎间盘髓核细胞的影响,因此本实验着重研究不同条件下软脂酸对髓核细胞的影响。通过预先分组,探讨在不同浓度及不同时间点干预下,软脂酸对髓核细胞凋亡的影响及细胞外基质代谢的失衡。
蛋白多糖、Ⅱ型胶原是椎间盘髓核细胞外基质的主要组成部分,在椎间盘退变的发生、发展过程中发挥重要的调节作用[18],两者含量的减少标志着椎间盘退变的发生及发展[19]。本研究应用流式细胞仪行细胞凋亡检测及RT-PCR行细胞外基质代谢检测,得出软脂酸与髓核细胞共同培养24 h 后,800 μmol/L 的软脂酸刺激对髓核细胞凋亡影响最大,髓核细胞内Aggrecan 及Collagen Ⅱ的基因水平在800 μmol/L 时表达最低,同法比较在800 μmol/L软脂酸刺激下,髓核细胞在36 h时凋亡率基本达到高峰。以上结果提示,在软脂酸的影响下,随着浓度及干预时间的延长,髓核细胞的凋亡率逐渐升高,蛋白多糖及胶原Ⅱ在髓核细胞外基质中的基因水平表达急剧下降。
综上所述,本研究证实了在体外细胞培养中软脂酸对髓核细胞增殖的影响,软脂酸呈浓度和时间依赖诱导髓核细胞凋亡,引起细胞的合成代谢发生紊乱,间接提示有效的血脂控制有助于延缓椎间盘退变的发展,但软脂酸通过何种途径引起髓核细胞的凋亡及具体的凋亡机制需进一步的实验研究。
利益冲突所有作者均声明不存在利益冲突
