弱光胁迫对白蟾生理特性的影响
2022-08-25杨柳青
彭 琦,杨柳青
(中南林业科技大学,湖南 长沙 4150001)
1 引言
白蟾植物内富含有栀子素(gardenin)、栀子苷(gardenoside)、有机酸酯类(Organic acid ester)、环烯醚萜苷类(Iridoid Glycoside)等其他类化合物化学成分[1],应用于治疗抗炎症、抑郁症、抗氧化、抗肝损伤、抗痴呆,对认知功能的神经保护[2~4],具有较高的经济价值;白蟾在树荫下、林下均能生长良好,耐阴性较强、适应性强、观赏优良,吸附室内PM2.5的能力强,具有作为室内园林植物以及垂直绿化植物开发潜力。
相比于城市园林绿地,室内的光照强度相对不强,而植物的生长发育与光有关,光照因子与植物的光合特性相关,从植物的形态结构和生理特性等方面促进或阻碍着植物生长,室内植物应顺应弱光环境才能发挥其最佳的景观效果[5]。研究发现,植物在不同的弱光环境下,其游离脯氨酸(Fpro)、可溶性糖(SS)、可溶性蛋白(SP)等渗透调节物质起到了保护作用,会增加或者减少渗透物质含量使得细胞渗透维持平衡[6,7],降低弱光环境下对细胞膜的伤害;抗氧化系统在不同的弱光环境下也起到了一定的保护作用,当植物处在弱光环境下,植物细胞内的活性氧含量较高,导致保护性酶(SOD)的活性含量会发生变化,也会对植物的叶绿素含量(CC)、类胡罗卜素(CK)含量产生影响[8]。目前国内外有关弱光胁迫的研究集中在花卉、乔灌木、水果与蔬菜作物等对象的生理生化过程[9~12],还没有出现过对白蟾的弱光胁迫研究。因此探究植物在弱光胁迫下对白蟾的生理特性影,能为植物培育条件与室内植物景观园林应用提供科学依据。
2 试验材料与方法
2.1 试验材料处理
白蟾采自湖南省中兰林责任有限公司,对每株白蟾进行相同水分、养分和通风管理,保持植物的正常发育和光合代谢生长一个月;待其生长至相似的生长状况的时候,选择生长健壮的、相似的白蟾放置120 mm花盆栽培种植,其土壤基质比为蘑菇渣比泥炭比珍珠岩是8∶2∶1,给植物浇水,待其没有水流出来时在放置于中南林业科技大学的负一楼实验室的人工气候箱内,光照强度约为200 μmol·m-2·s-1、温度约为25 ℃、湿度为70%)的环境下让其适应新环境3 d之后,再将其放置在试验弱光照条件下。
2.2 实验设计
白蟾在林下、屋檐下生长良好,用便携式测光仪测得夏季林下12:00~14:00的最高平均光强为200μmol·m-2·s-1;综合考虑:CK组:200 μmol·m-2·s-1为对照组;设置处理组A:100 μ mol·m-2·s-1(相当于室内的最高光照强度);处理组B:40 μmol·m-2·s-1(相当于室内阳台光照强度);处理组C:20 μmol·m-2·s-1(相当于为雨天室内阳台光照强度);处理组D:10 μmol·m-2·s-1(相当于室内光照强度);处理组E:2 μmol·m-2·s-1(相当于室内背光处光强)。每组设4个重复,共24盆,每隔2~3 d浇1次水,每隔10 d为1个周期,每隔10 d测每株植物3~4片叶片,测3种植物的各项生理指标,历时45 d。
2.3 测定指标与测定方法
试验测叶绿素含量用丙酮法、测相对电导率用电导法、测相对含水量采用恒重法、测MDA含量采用比色法TBA(硫代巴比妥酸)比色法、测可溶性蛋白含量采用考马斯亮蓝法、测可溶性糖含量采用蒽酮比色法、测游离脯氨酸含量采用茚三酮显色法、测SOD酶活性含量采用氮蓝四唑(NBT)光化还原法。
2.4 数据处理与分析
所得数据采用Excel软件对数据进行简单记录处理,用SPSS25软件进行单因素方差分析与主成分分析,得出其平均值、方差和各处理间的差异显著性。采用prism软件进行绘图。
3 结果与分析
3.1 弱光胁迫对白蟾形态特征的影响
弱光胁迫下白蟾形态特征变化如表1所示:随着弱光时间的增加,白蟾各个组都随着弱光胁迫时间的增加呈现增长的趋势,白蟾从试验开始到45 d,在叶片颜色变化上,白蟾各个处理组基本不变;各个处理组植物叶片都变大;对于株高增长量看,各个组的株高增长关系为:处理组A>CK>B>C>D>E,较初始分别增加了10、11、9、8、9、5 cm,白蟾能适应弱光环境,且能正常生长;其中处理组A(光照条件为100 μmol·m-2·s-1)时的白蟾长势最佳,植物生长最好;

表1 弱光胁迫下白蟾植物形态变化
3.2 弱光胁迫对白蟾光合色素含量的影响
3.2.1 弱光胁迫对白蟾叶绿素总含量的影响
弱光胁迫对白蟾叶绿素总含量变化如图1可知:白蟾各组叶绿素含量变化趋势略有不同,总体呈持续增长的趋势。
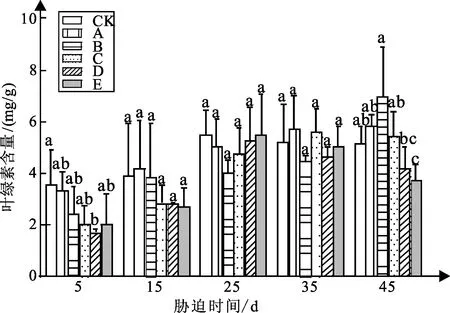
图1 弱光胁迫下叶绿素含量变化
白蟾试验5 d时,处理组A、B、C、D、E较CK组叶绿素含量分别下降6%、32%、43%、52%、43%,值分别为3.3、2.42、2.03、1.7、2.03 mg/g,其中处理组D与CK组差异显著;试验15 d时,处理组A较CK组叶绿素含量增加7%,处理组B、C、D、E分别下降1%、26%、26%、29%,差异不显著;试验25 d时,处理组A、B、C、D、E较CK组叶绿素含量分别下降8%、27%、14%、47%、0%,差异不显著;试验35 d时,各组叶绿素含量相差较小,差异不显著;试验45 d,处理组A、B、C较CK组叶绿素含量分别增加12%、35%、5%;处理组D、E分别下降18%、22%。
在实验45 d时,白蟾的叶绿素含量都随着弱光强度的降低呈先升后降的趋势,其中白蟾处理组A的叶绿素含量最高为5.833 mg/g,处理组D、E叶绿素含量显著小于CK组,而处理组A、B、C显著高于CK组。
3.2.2 弱光胁迫对白蟾叶绿素a/b的影响
弱光胁迫对白蟾植物叶绿素a/b含量的变化如图2可知:随着胁迫时间得增加,白蟾CK组与处理组A、B、C、D、E的叶绿素a/b含量变化不完全一样,总体呈逐渐先增后降的趋势。
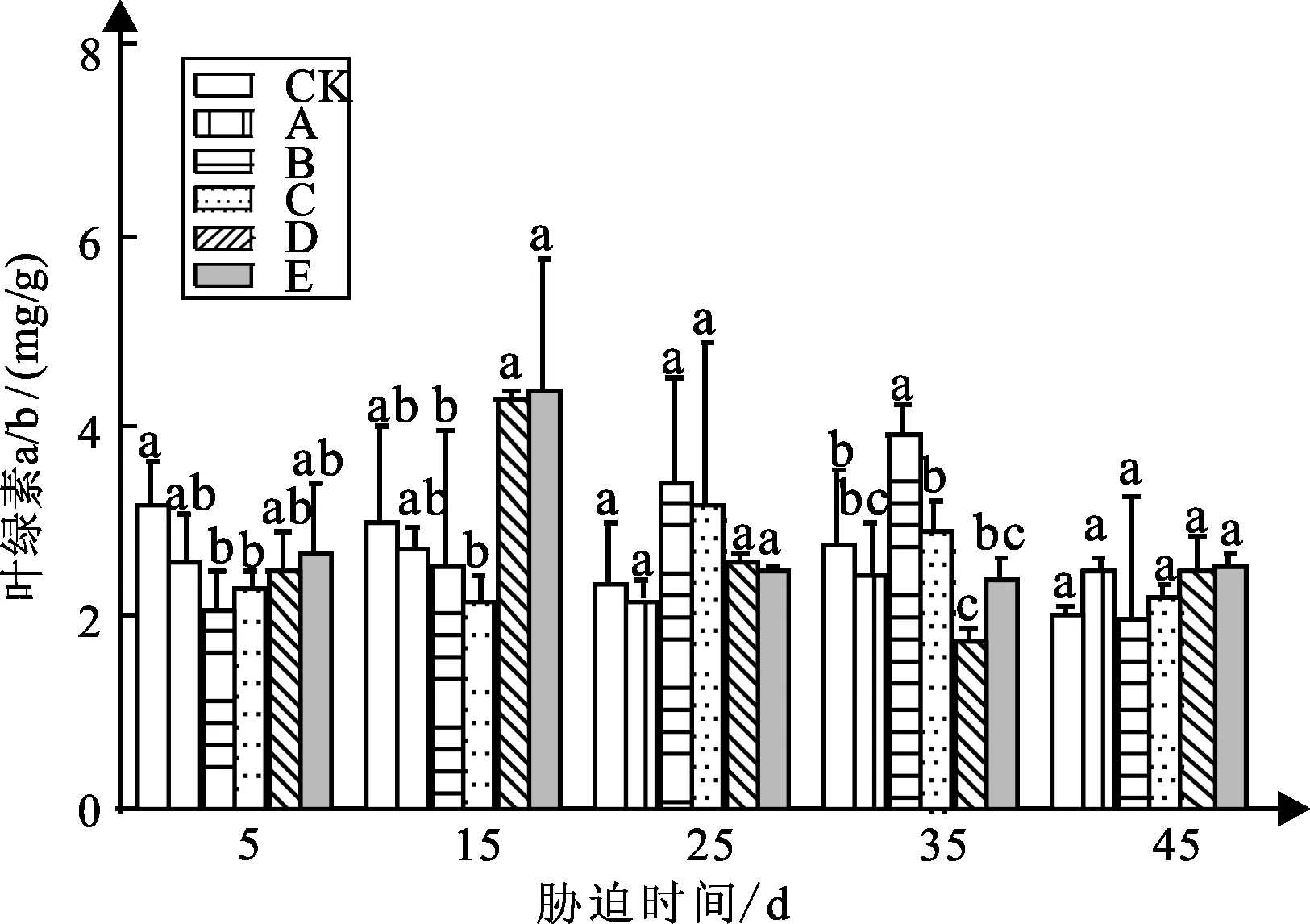
图2 弱光胁迫下叶绿素a/b含量变化
白蟾试验5 d时,处理组A、B、C、D、E较CK组叶绿素a/b含量分别下降17%、34%、27%、31%、15%,值分别为2.6、2.09、2.3、2.68、2.53 mg/g,其中处理组B、C显著;试验15 d,处理组A、B、C较CK组叶绿素a/b含量分别下降9%、15%、27%,处理组D、E较CK组叶绿素a/b含量分别增加43%、45%,差异不显著;试验25 d,处理组A较CK组叶绿素a/b含量下降6%,值为2.19 mg/g,处理组B、C、D、E较CK组叶绿素a/b含量分别增加45%、35%、9%、6%,值分别为3.42、3.19、2.58、2.51 mg/g;试验35 d,处理组B、D与CK组差异显著,较CK组叶绿素a/b含量增加42%、减小36%,值分别为3.91、1.74 mg/g;试验45 d,各组与CK组差异不显著,变化不大。
试验45 d,白蟾植物叶绿素a/b含量与弱光强度呈先增后降的关系,其中白蟾处理组A的叶绿素a/b含量最高为3.43 mg/g;白蟾在试验45 d时处理组D、E均存活,且白蟾的各个处理组的叶绿素a/b含量较CK组高。
3.2.3 弱光胁迫对白蟾类胡萝卜素含量的影响
弱光胁迫对白蟾植物类胡罗卜素含量的变化如图3可知:随着胁迫时间得增加,白蟾CK组与处理组A、B、C的类胡萝卜素含量变化整体呈缓慢增加的趋势。
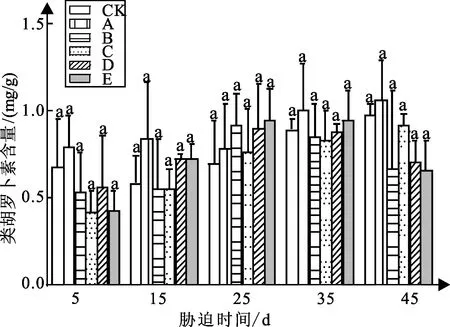
图3 弱光胁迫下类胡罗卜素含量变化
试验5~45 d时各个处理组与CK组差异均不显著;试验5 d时,处理组A较CK组类胡罗卜素含量增加16%,处理组B、C、D、E较CK组含量分别下降22%、38%、16%、36%,值分别为0.53、0.42、0.57、0.43 mg/g;试验15 d时,各处理组含量与CK组差异不大;试验25 d时,处理组A、B、C、D、E较CK组含量分别增加12%、31%、8%、28%、35%,值分别为0.79、0.92、0.76、0.9、0.95 mg/g;试验35 d,各处理组类胡罗卜素含量与CK组差异较小;在试验45 d,处理组B、C、D、E较CK组含量分别下降45%、7%、39%、46%,值分别为1.06、0.67、0.92、0.71、0.66 mg/g。
试验45 d时,白蟾植物的类胡萝卜素含量与弱光强度呈先上升后下降的趋势;其中白蟾的处理组A的类胡罗卜素的含量最高,最终为1.06 mg/g,且处理组D、E显著小于CK组。
3.3 弱光胁迫对白蟾相对电导率含量的影响
弱光胁迫对白蟾植物相对电导率含量的影响如图4可知:白蟾各组植物的相对电导率含量总体随着胁迫时间的推移而呈现先降低后增加的趋势。
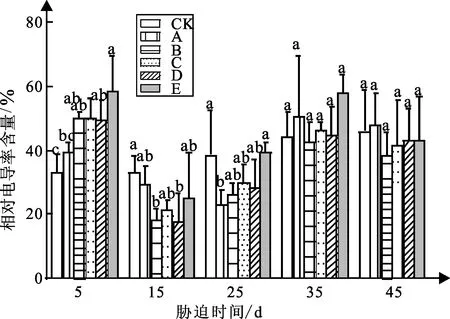
图4 弱光胁迫下相对电导率含量变化
试验5 d时,处理组A、B、C、D、E较CK组相对电导率含量增加了19%、51%、51%、49%、76%,值分别为39.4、50.01、50.02、49.55、58.41%,各组较CK组差异显著;试验15 d,处理组B、D较CK组差异显著,相对电导率含量分别降低了45%、46%,其他各组与CK组相差不大;试验25 d,处理组B较CK组相对电导率含量差异显著;试验35 d,处理组A、B、C、D、E较CK组相对电导率含量增加13%、1%、3%、1%、40%;试验45 d,处理组A较CK组相对电导率含量增加了4%,处理组B、C、D、E较CK组相对电导率含量减小了17%、10%、6%、6%,各组与CK组差异不显著。
试验45 d,白蟾的相对电导率含量随着弱光强度的增加呈先上升后下降的趋势;其中处理组A的相对电导率含量最高。
3.4 弱光胁迫对白蟾相对含水量含量的影响
弱光胁迫对白蟾植物相对含水量含量的影响如图5可知:白蟾各处理组相对含水量随着弱光胁迫时间的增加呈现逐渐增加后减小的趋势;白蟾CK组、处理组A、处理组B、处理组C、处理组D、处理组E相对含水量5~45 d的下降速率关系为:处理组D>E>C>B>A>CK,分别较初始下降了10%、8%、6%、5%、2%、1%。
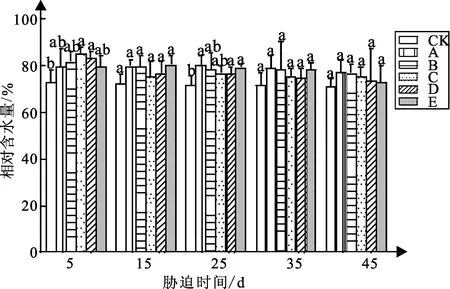
图5 弱光胁迫下相对含水量变化
白蟾试验5 d时,处理组C、D较CK组含水量差异显著,CK组含水量为72.86%,处理组C、D较CK组含水量相差12%、11%,值分别为84.93、83.26%;试验15 d,各处理组较CK组差异不显著,CK组相对含水量为72.25%;试验25 d,处理组A相对含水量较CK组差异显著,值为80.25%,较CK组增加8%;试验35 d,各处理组与CK组差异不显著,处理组A、B、C、D、E比CK组高7%、7%、4%、3%、7%;试验45 d,各处理组与CK组差异不显著,值分别为77%、76%、75%、71%、73%、72%。
试验45 d,白蟾相对含水量随弱光强度的增加呈先升后降的趋势,其中CK组相对含水量含量最低,处理组A相对含水量含量最高。
3.5 弱光胁迫对白蟾MDA含量的影响
弱光胁迫对白蟾植物MDA含量的影响如图6可知:白蟾CK组与处理组A、B、C随着胁迫时间的增加呈先减小后增加的趋势。
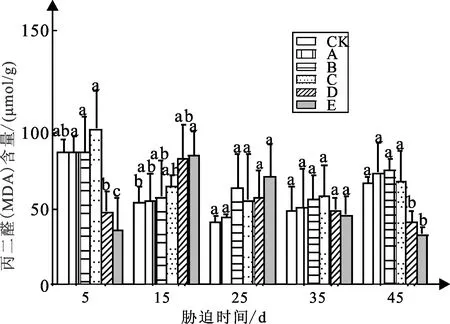
图6 弱光胁迫下MDA含量变化
白蟾试验5 d时,处理组D、E较CK组MDA含量变化显著,处理组D、E值分别为40、30 μmol/g,CK组含量为49 μmol/g;试验15 d时,处理组A较CK组MDA含量增加16%,值为30 μmol/g处理组B、C、D、E较CK组MDA含量分别减小57%、53%、33%、32%,值分别为35、19、20、21 μmol/g;试验25 d与35 d,各处理组与CK组MDA含量差异不大;试验45 d,处理组D、E与CK组MDA含量差异显著,处理组D、E较CK组MDA含量减小36%、28%。
试验45 d,白蟾的MDA含量与弱光强度呈先升后降的趋势,其中处理组B的MDA含量最高,处理组D、E的MDA含量显著小于CK组MDA含量,处理组A、B、C高于CK组MDA含量。
3.6 弱光胁迫对白蟾渗透物质含量的影响
3.6.1 弱光胁迫对白蟾可溶性蛋白含量的影响
弱光胁迫对白蟾植物可溶性蛋白含量的影响如图7可知:白蟾可溶性蛋白含量都随着时间的推移呈现先升后降的趋势。
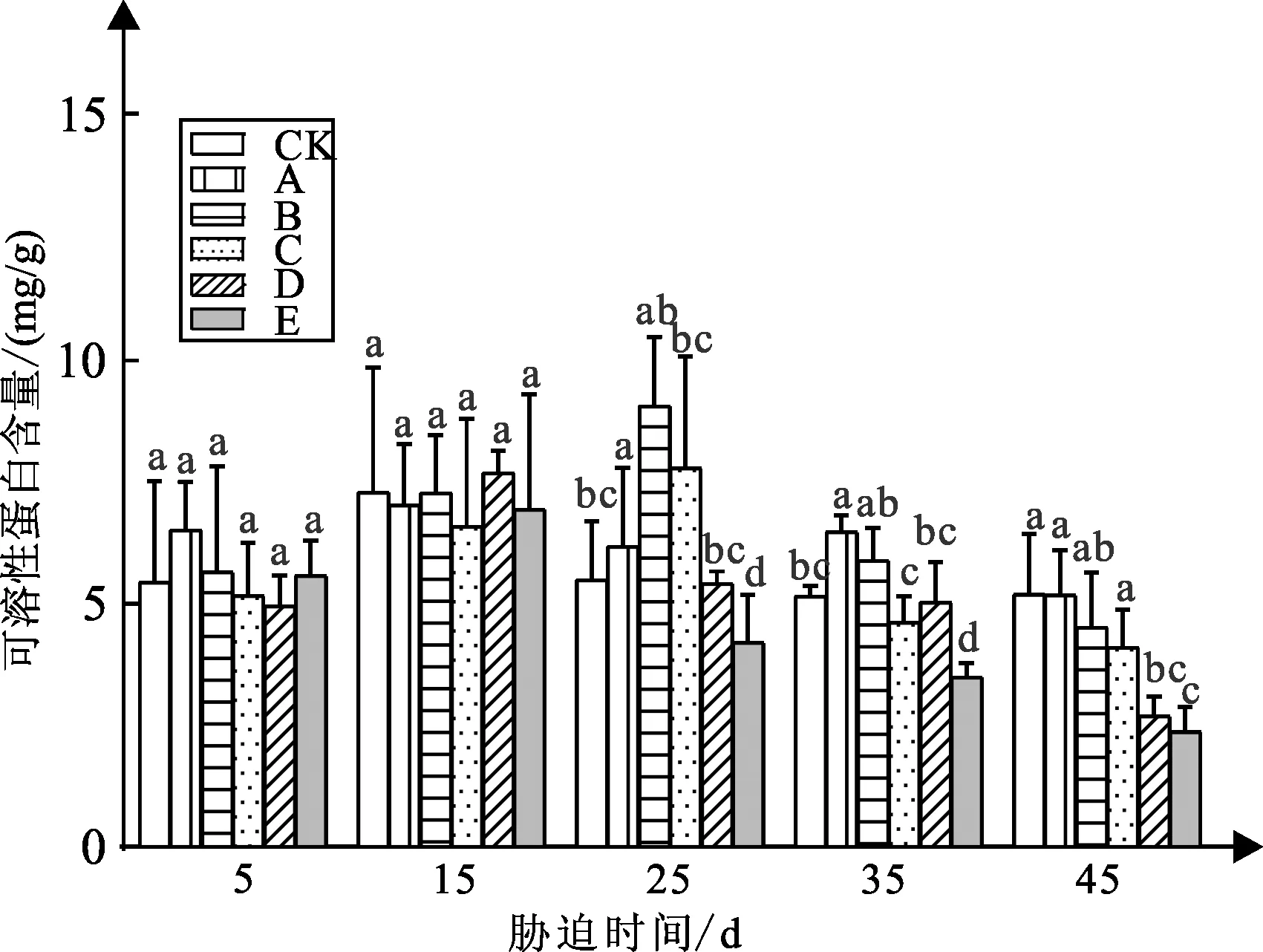
图7 弱光胁迫下可溶性蛋白含量变化
试验5 d时,处理组A、B、E较CK组可溶性蛋白含量增加19%、4%、2%,值分别为6.51、5.66、5.58 mg/g处理组C、D较CK组可溶性蛋白含量分别减小4%、9%,值分别为5.17、4.95 mg/g,与CK组差异不显著;试验15 d,CK组可溶性蛋白含量7.29 mg/g,各处理组可溶性蛋白含量与CK组差异不大;试验25 d,处理组A、B、C较CK组可溶性蛋白含量分别增加12%、64%、41%,处理组D、E较CK组可溶性蛋白含量分别减小1%、23%;试验35 d,处理组A、B较CK组可溶性蛋白含量分别增加25%、14%,处理组C、D、E较CK组可溶性蛋白含量分别减小10%、2%、32%,处理组A与CK组差异显著;试验45 d,处理组A、B、C、D、E较CK组可溶性蛋白含量分别下降1%、12%、20%、48%、54%,值分别为5.19、4.52、4.11、2.69、2.36 mg/g。
在试验45 d时,白蟾的可溶性蛋白含量与弱光程度呈缓慢降低的关系,白蟾CK组可溶性蛋白含量最高为5.19 mg/g,处理组D、E的可溶性蛋白含量显著小于CK组。
3.6.2 弱光胁迫对白蟾可溶性糖含量的影响
弱光胁迫对白蟾植物可溶性糖含量的影响如图8可知:白蟾各组随着弱光胁迫时间的增加呈现先增加后减小的趋势。
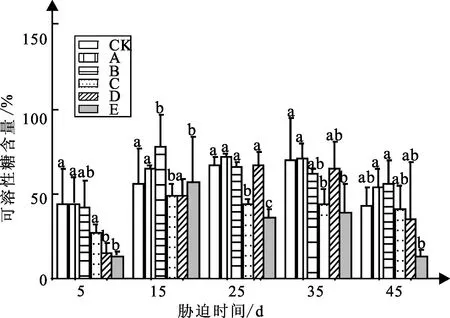
图8 弱光胁迫下可溶性糖含量变化
白蟾试验5 d时,处理组A、B、D可溶性糖含量较CK组可溶性糖含量分别增加30%、31%、7%,处理组C、E较CK组分别下降27%、33%,各处理组较CK组差异均不显著;试验15 d,处理组A与CK组可溶性糖含量差距不大,处理组B、C、D、E较CK组分别下降39%、43%、48%、46%,值分别为15.97%、14.9%、13.82%、14.23%,各处理组与CK组差异不显著;试验35 d,处理组A、B、C、D、E较CK组增加32%、52%、21%、6%、29%;试验45 d,处理组E差异显著,较CK组下降60%,可溶性糖含量值为13.26%。
试验45 d,白蟾各组的可溶性糖含量与弱光强度呈先增后降的趋势,其中处理组A、B的可溶性糖含量显著高于CK组与处理组C、D、E的可溶性糖含量;白蟾处理组B可溶性糖含量最高,其最大值可溶性糖含量分别为56.29%。
3.6.3 弱光胁迫对白蟾游离脯氨酸含量的影响
弱光胁迫对白蟾植物游离脯氨酸含量的影响如图9可知:白蟾CK组在5~35 d变化不大;处理组A、B、C、D、E呈先下降后上升的趋势。
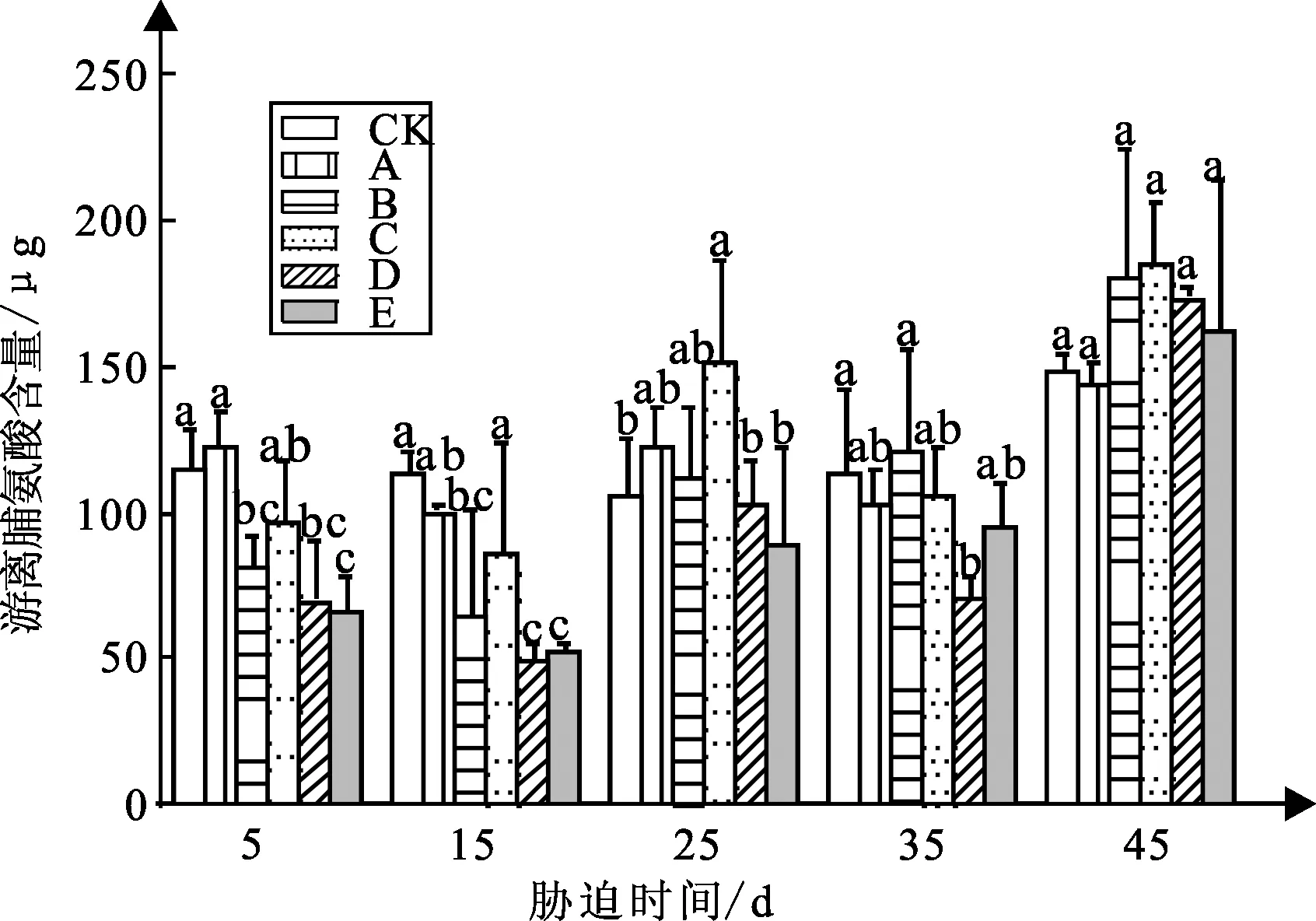
图9 弱光胁迫下游离脯氨酸含量变化
试验5 d时,白蟾处理组A与CK组差距不大,处理组B、C、D、E游离脯氨酸含量较CK组游离脯氨酸含量分别下降29%、15%、39%、43%,各处理组游离脯氨酸含量分别为81、96、69、65 μg,其中处理组D、E较CK组差距显著;试验15 d,处理组A、B、C、D、E较CK组分别下降11%、43%、24%、56%、53%,其中处理组B、D、E较CK组差距显著;试验25 d,处理组C较CK组差异显著,较CK组增加44%;试验35 d,处理组D较CK组差异显著,较CK组游离脯氨酸含量下降37%,其他各组与CK组差距不大;试验45 d,各处理组与CK组差异不显著,处理组A与CK组差距不大,处理组B、C、D、E游离脯氨酸含量较CK组游离脯氨酸含量分别增加22%、24%、17%、9%,游离脯氨酸含量分别为143、181、184、148、173、162 μg。
试验45 d后,白蟾游离脯氨酸含量与弱光强度呈先降后增再降的抛物线趋势,白蟾处理组B、C、D、E的游离脯氨酸含量显著高于CK组、处理组A,其中处理组C的游离脯氨酸含量最高。
3.7 弱光胁迫对白蟾超氧化物歧化酶(SOD)活性含量的影响
弱光胁迫对白蟾植物SOD酶活性含量的影响如图10可知:白蟾各处理组都随着弱光胁迫时间的增加呈现持续增加的趋势。
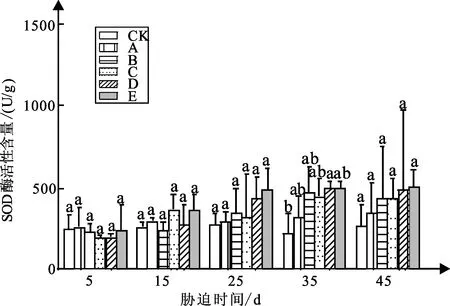
图10 弱光胁迫下SOD活性含量变化
白蟾试验5 d时,处理组A、B、C、D、E的SOD酶活性含量较CK组SOD酶活性含量分别下降5%、7%、22%、19%、2%;试验15 d,处理组A、B、C、D、E的SOD酶活性含量较CK组SOD酶活性含量分别增加14%、1%、41%、4%、39%,各处理组值分别为296、237、368、272、362U/g;试验25 d,处理组A、B、C、D、E较CK组分别增加9%、27%、18%、46%、80%,各处理组值分别为295、345、322、397、489 U/g;试验35 d,处理组A、B、C、D、E较CK组增加46%、118%、106%、130%、165%,其中处理组A与CK组差异显著;试验45 d,处理组A、B、C、D、E较CK组分别增加30%、34%、64%、82%、92%,值分别为346、357、436、486、510 U/g。
试验45 d白蟾SOD酶活性含量与弱光强度呈持续增长的抛物线趋势,其中白蟾处理组E的SOD酶活性含量最高。
4 讨论与结论
4.1 讨论
在弱光条件下,植物的光受体感知会对环境红光和远红光比例不一,会导致植物Chl a/b 含量降低、叶绿素含量(CC)升高[13,14],本试验结果研究表明:白蟾叶绿素总量都是随时间增加而变大,叶绿素a/b随时间的胁迫呈逐渐减小的趋势;白蟾处理组D、E的总叶绿素含量最高,可能因为白蟾在人工气候箱的边角地,导致吸收光能减弱导致叶绿素b含量的累计,叶绿素总含量增加,造成叶绿素a/b含量的减小。
当植物遭受逆境伤害时,会致使植物产生失水或者其他变化;其植物渗透物资含量会变高,加速植物新陈代谢[15];本试验得出试验45时白蟾处理组D、E在试验时可溶性蛋白含量趋势是逐渐减小,白蟾的处理组D、E的游离脯氨酸含量显著高于处理组A、处理组B、处理组C与CK组,可能是由于处理组D、E白蟾的光线更暗,导致植物的抗逆境能力减弱,使得其含量小于其他各组,也可能是由于在弱光强度下,光合作用不活跃。
超氧化物酶(SOD)以使植物间的膜透性变强,使得植物能够在弱光条件下生存;体内会残留大量超氧化物酶和丙二醛等调节物质来保持细胞内平衡[16,17];本试验探究出白蟾除CK组的SOD酶活性含量随着时间的增加呈先下降后上升的趋势,且在试验45 d时,白蟾处理组D、E的SOD酶活性含量显著高于处理组A、处理组B、处理组C与CK组,可能是由于其植物自生的调节机制相关,白蟾植物自生在酶活性因子上更能调节SOD酶活性含量来适应弱光环境。白蟾处理组A、CK、B、C的丙二醛含量在5~25 d时呈持续降低的趋势,说明白蟾在此期间没有遭受弱光逆境的伤害;处理组D、E在试验5~15 d时显著上升,说明白蟾在2~10 μmol·m-2·s-1的弱光环境下遭受了逆境伤害使得丙二醛含量变高,15d后降低说明白蟾适应了弱光环境,遭受伤害变小。
植物在弱光的光照情况下,植物的细胞膜会遭受逆境的损伤,使得植物会通过增加相对电导率的含量来适应较为弱光的环境,白蟾各处理组在5~15 d下降,可能是植物在弱光胁迫的前期,是其他物质在增大而使得植物的细胞膜没有遭受损害,在15~35 d时,相对电导率上升,且处理组E含量最高,说明在弱光胁迫遭受损伤严重,使得白蟾在35 d时细胞膜的透性变大;相对含水量反应了植物对于储存水的强弱关系,其下降的越慢,说明其植物的存水能力更强。白蟾的处理组D、E均是变化最快的,可能是由于植物在弱光环境下,会导致植物的存水能力发生变化,使得白蟾植物的保水能力减弱。植物丙二醛的含量反应的是植物字逆境下受伤害的程度。
4.2 结论
白蟾在光照条件为200、100、40、20、10、2 μmol·m-2·s-1时均正常生长、叶色没有黄化现象、叶片变大,自我调节能力较强,其中当光照条件为100 μmol·m-2·s-1时白蟾生长得最好。
