植物春化作用分子机理研究进展
2022-08-23王凡卞晓春刘陈玮徐仁超吴春芳
王凡,卞晓春,刘陈玮,徐仁超,吴春芳
(江苏沿江地区农业科学研究所,江苏如皋 226541)
植物需要一定的外界条件诱导,才能由营养生长转变为生殖生长,外界条件有温、光、水、气等,其中温度是一个重要环境因素。大多一年生或二年生的冬性植物,必须在种子萌发期或营养生长初期经过一段时间的低温处理才能开花,这种低温处理一段时间从而促进植物开花的现象,称为春化作用[1]。
春化作用通常具有如下特征:①春化作用是缓慢的量变积累过程,在低温下经历的时间越短,对开花的促进作用越弱,而在低温下经历的时间越长,植物的开花时间越短,直至达到饱和状态;②春化作用不会改变植物内在的基因,不具有遗传性,其产生的效应只能通过有丝分裂的方式稳定维持在当代植株中,并不能通过有性繁殖传递给后代;③有分裂活性的细胞才能对春化作用做出反应,所以春化作用的感受位点通常在植物的根尖和茎尖;④春化作用不能直接导致植物开花,其仅在很大程度上促进了开花的进程。
1 春化作用概述
植物春化主要有2 种类型:一种是种子春化型植物,即种子处在萌发状态,就可以通过胚感受到低温诱导,如小麦、大白菜、菠菜和萝卜;另一种是绿体春化型植物,即幼苗生长到一定阶段,才能通过其茎尖分生组织感受外界低温诱导,如洋葱、大蒜、甘蓝和芹菜[2]。不同物种因生长环境不同和生长状态不同,所需的最适春化条件也有所不同。大多数植物所需的最适低温为1~7℃,但某些温带植物要求10℃以上,某些谷类作物要求-6℃。同时完成春化所需的时间也从几天到几个月不等。
在微观世界中,微型藻类也存在和高等植物相似的春化作用。植物通过开花结果的方式繁殖,而铜绿微囊藻通过细胞分裂一分为二的方式繁殖,低温加速植物开花结果与低温加速藻细胞分裂的本质均是繁殖。因此,可以将低温加速藻增长的现象称为藻春化作用,植物春化作用属于狭义的春化作用,藻类春化作用属于广义的春化作用[3]。
温度、光照、其他环境条件(水分、氧气和营养物质)均与植物春化作用相关。温度是直接影响春化作用的一个关键因子,花芽分化与低温之间并不是简单的线性关系,而是积累关系,每个春化植物都能找到一个最适宜的低温来促进花芽分化。在满足春化所需的低温后,光照成为了最关键的影响因子,低温春化和光周期两者之间能够相互替代和影响,如菠菜是不需要经过低温环境就能开花的长日照植物,但经过低温处理后,其在短日照下也能开花。水分、氧气和营养物质是除了低温和光照2 个因素外春化的必须条件。干燥的种子不能完成花芽分化,一般情况下,种子含水量要在40%以上才能春化。离体胚必须在有氧、水分和糖类的条件下才会进行春化。外源物质的处理对春化也有一定影响,已知的五大生长类激素都与春化过程以及成花过程存在某些联系[4]。
2 春化作用分子机制
生理研究表明,春化作用会引起植物体内核酸代谢、可溶性蛋白含量、内源激素代谢、碳氮代谢等生理方面的变化[5],这使人们初步认识了春化作用,但没有从根本上揭示春化作用的分子机理。随着分子生物学技术的迅速发展,人们更加透彻地认识了春化作用的分子机理,已经分离鉴定了一系列春化相关基因,并对其如何调控植物的开花展开了大量研究。例如,春化作用能够调控FLC 等关键基因的表达,并引起DNA 甲基化、组蛋白修饰等一系列变化来影响植物的成花转变[6]。春化作用已在模式植物拟南芥和单子叶植物中得到广泛研究(图1)。
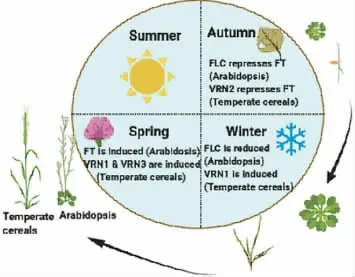
图1 春化介导开花的分子机制
在拟南芥中,寒冷前(秋季)FLC 表达量较高,并抑制FT。在冬季,长时间的冷暴露,导致FLC 水平降低。春季后期,长日照诱导FT 表达,并促进开花。在温带谷物中,VRN2 在寒冷前抑制FT。在冬季,冷暴露诱导VRN1 的表达,并抑制VRN2。春季VRN1 保持较高水平,并允许诱导VRN3 促进开花。
2.1 拟南芥中春化作用的分子机制
在拟南芥中,2 个关键基因赋予了春化要求:FRI和FLC。FRI 编码一种植物特异性的支架蛋白,且是FLC 激活转录所必须的。FRI 通过由SUF4、FRL1 和FES1 组成的大蛋白复合体调控FLC 的转录。该蛋白复合体进一步募集转录激活因子和染色质修饰蛋白用于FLC 的上调。FLC 编码一个MADS-box 转录因子,作为开花的抑制因子。高水平的FLC 抑制开花整合基因,如FT、FD 和SOC1 的表达,导致开花延迟。FLC 结合FT 的第一个内含子及FD 和SOC1 的启动子,以发挥抑制因子的功能。
在拟南芥中,FLC 的抑制是有丝分裂稳定的,许多基因参与了FLC 的稳定抑制和组蛋白修饰,如AtVRN1、AtVRN2、VIN3 和VRN5。AtVRN1 编码一个含DNA 结合域和PEST 区域的蛋白,其参与了FLC 的稳定抑制,其通常会以低水平的方式存在,而给予持续低温后表达量会骤然上升。AtVRN2 编码一个锌指核蛋白,类似果蝇中的SU(Z)12、植物中的FIS1 和EMF2。AtVRN2 是POLYCOMB GROUP 抑制复合物2(PRC2)的一部分,在恢复温暖条件后,FLC 抑制在稳定维持中起重要作用。VIN3 编码一个染色质重塑植物同源域指(PHD)蛋白,并被春化激活。VIN3 的激活通过募集PRC2 复合物催化FLC 染色质的H3K27me3 修饰,导致FLC 被抑制。VRN5 也编码PHD 蛋白,在春化过程中,VIN3 和VRN5 形成异源二聚体,维持FLC 稳定沉默所需的组蛋白修饰。VRN1、VRN2 和VRN5 无论春化与否都会表达,而VIN3 只有在感受一段时间的低温后表达,当温度转暖,其表达会迅速下降。VIN3作为FLC 表观遗传沉默的热传感器元件,在更温暖和更可变的温度下,影响春化响应方面具有关键和复杂的作用[7-8]。
长链非编码RNA(lncRNA)在植物的整个生命过程中参与不同的生物学功能,具有显著的调节作用。研究发现,2 种不同 类型的lncRNA,COOLAIR 和COLDAIR 在FLC 调控过程中具有表观遗传调控的作用[9]。COOLAIR 是天然存在的FLC 反向转录本,根据剪切方式的不同,又分为近端转录本和远端转录本,远端转录本的外显子区域,可以触及到FLC 正向转录本的第一个外显子和启动子区域,春化作用使其表达丰度迅速积累,与FLC 序列反向互补,以转录后调控的方式干扰其表达[10]。COLDAIR 由FLC 第一个内含子转录出来,春化过程中与PRC2 的组分催化亚基CLF 相互作用,促进PRC2 与FLC 结合,参与FLC 的抑制作用,温度升高,COLDAIR 与CLF 的结合度降低,对FLC的抑制下降,促进开花。此外,存在另一种形式lncRNA COLDWRAP,是从受抑制的FLC 启动子区域分离出来,春化使COLDWRAP 与COLDAIR 在FLC 位点形成一个基因内部的抑制性染色质茎环结构,对FLC 的稳定抑制起重要作用[11]。
2.2 谷物中春化作用的分子机制
春化作用在单子叶谷物中也得到了广泛研究。在谷物中,春化主要受2 个基因调控:VRN1 和VRN2,这2 个基因进一步调控开花整合基因VRN3。VRN1 和VRN2 与拟南芥VRN 基因不同,表明春化途径可能在温带谷物中独立进化。VRN1 起开花启动子的作用,且是调节春化反应的核心。它编码一个MADS-box 转录因子,并与拟南芥花分生组织决定基因AP1 和FUL 相关。在小麦和大麦的冬季品种中,VRN1 的表达受冷处理诱导。然而,在春季品种中,即使没有冷处理,VRN1仍会表达,这减少甚至消除了它们对春化的需求。与拟南芥中FLC 下调受到表观遗传调控相似,VRN1 上调也受到表观遗传调控。VRN1 的上调与H3K27me3(抑制染色质标记)的抑制和H3K4me3(活性染色质标记)的诱导相关。VRN1 启动子区域和第一内含子在维持春化反应中起着至关重要的作用。VRN1 的启动子区域和第一个内含子的缺失与春小麦品种相关。长期冷处理后,VRN1 的持续上调导致开花抑制子VRN2 的低表达。然而,也有报道称,VRN1 的表达不是寒冷期间开花或VRN2 下调所必须的,表明春化后可能有其他基因参与VRN2 的下调。VRN2 编码一个锌指CCT结构域蛋白,且在拟南芥中未发现其同系物。CCT 结构域对于调节春化要求非常重要,CCT 结构域的突变会导致春化需求的消除。在小麦和大麦中,秋季长日照诱导VRN2,进一步抑制VRN3,抑制开花。VRN1 的表达受春化调控,不受光周期影响,相反,VRN2 的表达受光周期调控,表明光周期在谷物的春化诱导开花中也有重要作用。在小麦和大麦中,较高环境温度下,VRN1的调控控制着小穗数、小花数和开花时间。最终,VRN2的下调释放了VRN3。VRN3 是FT 的同系物,在春化后并响应最佳光周期诱导开花。类似于拟南芥中的FT,VRN3 的开花启动子活性被长日照激活。VRN3 通过正反馈回路刺激叶片中VRN1 的表达。VRN3 通过与另一种VRN1 启动子结合的转录因子(FDL2)沟通来增加VRN1 的表达[8,12]。
另一个MADS-box 基因VRT2 可能也参与了谷物的成花转变过程,其与VRN2 基因有相似的响应春化模式。研究VRN1、VRN2 及VRT2 基因及其产物之间的作用关系,发现VRT2 是VRN1 的转录抑制因子,VRT2 与VRN1 基因启动子区域的CArG-box 区结合,从而抑制了VRN1 的表达活性。同时发现,VRN2 并不与VRN1 的启动子区域结合,也不直接影响其表达活性,但VRN2 能够增强VRT2 的转录抑制作用,表明他们形成了一个调控复合体,该复合体影响了VRN1 的表达[13]。
VER2 基因,编码一种类植物凝集素蛋白,也参与了谷物的成花转变。在春化处理的小麦中,VER2 主要在茎尖以及周围幼叶中表达,去春化处理能抑制VER2 基因的表达。分析VER2 蛋白的凝集素活性和糖结合特性,表明其能够专一性地结合N-乙酰氨基葡萄糖和半乳糖,推测该蛋白参与了细胞内O-Glc-NAc 信号的传递;春化过程中,VER2 主要定位于细胞核内,去春化处理后,VER2 定位于细胞质;2-D 电泳结合western blot 表明,春化处理后,VER2 蛋白的等电点发生改变,并且磷酸化处理加快了这种改变,表明VER2 蛋白在春化过程中发生了磷酸化修饰[14]。
2.3 其它植物中春化作用的分子机制
随着大白菜全基因组测序的完成及分子生物学技术的发展,白菜春化作用的相关研究已从生理水平逐渐转向分子水平。白菜类作物与拟南芥同属十字花科植物,因此,研究者们可借助拟南芥的春化分子机制,研究白菜类作物的春化机制,为白菜类作物春化育种提供理论依据。目前,已在白菜、甘蓝和甘蓝型油菜中克隆出多个FLC 同源基因,并通过转基因等方法验证了白菜类作物中的BrFLCs 基因与拟南芥的AtFLC 基因作用相似[15]。除FLC外,白菜类作物中与春化相关的其它开花基因也有少量报道,如BrFRI、BrSOC1、BrVIN3、BrFT 等。尽管国内外关于白菜类作物开花基因的研究已有一定进展,但研究内容不够深入,如果能更深入地研究其春化机理,克隆分析出更多的白菜开花基因,对于其育种研究将会产生巨大帮助。
在甜菜中,主要有3 种基因在春化反应中起作用,BvBTC1、BvFT1 和BvFT2。BvFT2 是甜菜中的功能性FT 直向同源物,其过表达在没有春化的情况下促进开花,干扰表达不开花。但BvFT1 是一种开花抑制子,过表达BvFT1 导致BvFT2 表达的抑制和开花推迟,春化导致BvFT1 下调,即使在恢复温暖条件后,春化诱导的BvFT1 抑制也能稳定保持,表明BvFT1 的功能与拟南芥中FLC 的功能相似。甜菜中的春化主要通过BvBTC1 对BvFT1 和BvFT2 的调节来满足,春化处理将BvBTC1 逐渐激活至足,以抑制BvFT1 并激活BvFT2 的水平[16]。
蚕豆是豆科的一员,是粮食、蔬菜、饲料和绿肥兼用作物。蚕豆分冬性、春性和中间型品种,其中冬性蚕豆需经过春化作用才能诱导其开花结荚。蚕豆人工春化促早栽培,主要通过对蚕豆芽苗进行人工春化技术,可以实现元旦采收鲜荚,显著提高效益。对蚕豆春化分子机理的研究甚少,目前仅限于转录组和蛋白组分析。对蚕豆品种‘通鲜2 号’进行转录组测序,分析春化和未春化蚕豆幼苗转录组的差异,结果表明春化处理的蚕豆光合作用和碳代谢受到强烈抑制,而响应胁迫相关基因显著上调表达。此外,还鉴定到22 个春化诱导的花粉-雌蕊相互作用基因和一些特异表达的蛋白激酶[17]。对‘通鲜2 号’进行蛋白组测序,结果表明,在春化处理的蚕豆芽苗中有91 个来自不同功能类别的蛋白质特异表达。春化处理后,光合作用和植酸代谢在内的几种生物学过程或代谢途径相关蛋白表达量与对照相比有显著差异。另外,还发现富含甘氨酸的RNA结合因子蛋白家族在春化幼苗中积累,表明在春化反应中转录本丰度受到选择性剪接的额外调控[18]。
草莓的花芽分化也受低温诱导。在野生草莓中发现,在低温下无论光周期如何都会开花。目前多从生理和栽培角度阐述外界因素如何影响草莓花芽分化,但对其成花的分子调控机理了解甚少。前期研究主要集中在利用QTL 作图来进行成花性状相关基因的定位[19]。后来,基于森林草莓EST 序列,并结合生物信息学分析,对参与二倍体草莓成花调控的基因进行了较深入的研究,结果表明,在二倍体草莓中,可找到许多与拟南芥成花途径中基因对应的同源基因,拟南芥成花分子机理的研究,可为草莓中相关的研究提供借鉴,但同时也发现,二倍体草莓中存在着不同于拟南芥的调节机制[20]。近些年来,与成花有关的同源基因AP1、LFY、TFL1、FT、CO 等从栽培草莓中被克隆分离出来,并通过定量PCR 验证了这些基因在不同组织、不同花器官及不同花发育阶段的表达情况,发现它们都很可能参与了草莓的成花调控[21]。
3 结语
植物的春化作用对发展农业生产具有重要意义,迄今为止,春化技术已应用在各种蔬菜、花卉上,并取得一定进展,如乌塌菜、蚕豆、百合等。但春化作用分子机制的研究主要集中在拟南芥和小麦上,对于其他植物的研究甚少,且种子春化型和绿体春化型植物的春化作用机制是否一致,有待进一步研究。植物春化特性是由多基因控制,基因之间存在复杂的作用关系,要多角度、多层次认识春化机理的本质,将生理、生化、分子生物学、遗传学、生物信息学等学科有机结合,以取得新的突破。
