偶氮苯类DNA纳米机器
2022-08-22刘苏毓樊春海
刘苏毓,丁 飞,李 茜,3,樊春海,冯 景
(1.上海理工大学健康科学与工程学院,上海 200093;2.上海交通大学化学化工学院,上海 200240;3.世界顶尖科学家国际联合实验室,上海 201203;4.上海交通大学附属第六人民医院南院,上海 201499)
偶氮苯(Azobenzene)分子于1834年首次被发现[1],其光致异构性的研究可追溯到1937年[2]. 偶氮苯分子的光致异构性具体表现为:在紫外光(340~380 nm)照射下,偶氮苯呈现顺式非平面极性构象(cis),空间位阻效应阻碍其与其它平面构象分子的结合[3];而在可见光(420~490 nm)刺激时,偶氮苯则呈现反式平面非极性构象(trans),此时其能够与其它平面构象分子(如核酸碱基)紧密结合[4][图1(A)]. 基于这种性质,偶氮苯类分子目前已成为一类被广泛应用的光响应性分子[5]. 此外,偶氮苯基团可被体内还原物质(如偶氮还原酶和谷胱甘肽)还原裂解[图1(B)]. 通常这类还原物质的局部浓度与组织的乏氧程度呈正相关[6],因此偶氮苯也被视为乏氧响应因子,被用于构建乏氧激活的探针或药物递送载体等[7~12].

Fig.1 Photo⁃isomerized and hypoxia⁃responsive properties of azobenzene(A)Azobenzene reversibly isomerizes between cis- and trans-form under visible and UV light irradiation;(B)hypoxic reduction mechanism of azobenzene.
随着脱氧核糖核酸(DNA)纳米技术的蓬勃发展,DNA已不仅是遗传信息的载体,也成为纳米医学和材料科学领域应用最为广泛的生物材料之一[13,14]. 目前,通过核酸的可编程性能够构建正方形、长方形、星形和笑脸等不同空间形状的结构[15]. 除了上述的静态结构,基于核酸纳米技术也可构建DNA镊子[16,17]、DNA步行器[18]以及DNA控制释放系统[19]等动态智能化的核酸纳米结构. 这些动态响应性的核酸纳米结构在单分子传感、药物输送和分子组装等领域显示出巨大的潜力[20~22].
将偶氮苯整合至DNA骨架中,能够赋予DNA纳米结构光致异构性及乏氧响应性,进而构建光响应的DNA 纳米机器(Scheme 1)[23]. 本文梳理了近年来基于偶氮苯的DNA纳米机器的研究进展,并进行分类汇总和利弊分析,希望为DNA 纳米机器在生物、化学、医学和材料等领域的研究提供新的思路.
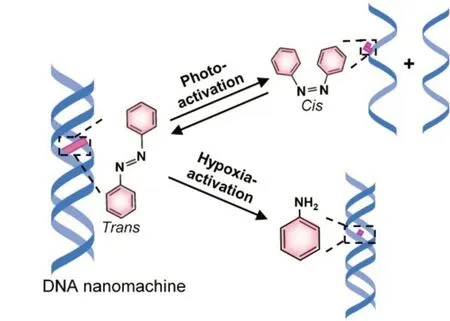
Scheme 1 Light⁃ and hypoxia⁃responsive azoben⁃zene integrated DNA nanomachine
1 偶氮苯类DNA纳米机器的构建
1.1 DNA分子的偶氮苯修饰
偶氮苯与DNA的相互作用主要分为非共价与共价2种方式(图2). 非共价作用力主要包括静电吸附[24]和氢键[25]等. 利用非共价作用力,无需对DNA分子进行复杂的修饰即可实现对核酸结构和功能的调控[26][图2(A)],此类非共价作用的核酸-偶氮苯杂合物包括季铵盐类偶氮苯[27,28]、偶氮苯-阳离子肽类分子(Azo-PM)[29]和带胍盐的偶氮苯衍生物(AzoDiGua)[30]等. 基于这类超分子作用,很难实现核酸结构的局部调控,而且游离的偶氮苯衍生物具有较高的生物毒副作用[31].
按照偶联位置不同,偶氮苯基团与核酸的共价结合方式主要分为3种:(1)偶氮苯单元作为核苷替代物整合至核酸中[图2(B)];(2)偶氮苯基团修饰在核苷上[图2(C)和(D)];(3)偶氮苯基团修饰在磷酸骨架上[图2(E)和(F)].

Fig.2 Interactions between azobenzene and nucleotides(A)Schematic illustration of noncovalent interaction;(B)schematic illustration of covalent interaction:azobenzene as nucleoside surrogates;(C)azobenzene attached to a nucleoside on the ribose unit;(D)azobenzene attached to a nucleoside on the nucleobase;(E)azobenzene used as a backbone linker between two nucleosides;(F)azobenzene attached on the phosphate backbone;(G)an example of azobenzene-based hypoxia-activated DNA nanodevice[32];(H)light-responsive azobenzene-integrated asODNs for regulating RNA digestion[33].(G)Copyright 2019,American Chemical Society;(H)Copyright 2015,American Chemical Society.
将偶氮苯单元作为核苷替代物(偶氮苯亚磷酰胺单体),利用DNA固相合成仪整合至核酸骨架中是构建偶氮苯类DNA光控纳米机器最常见的方法[34][图2(B)]. 该方法可以实现偶氮苯基团在寡聚核苷酸链上的定点及多位点修饰,从而扩大核酸设计的范围. 在这种设计中,当偶氮苯基团呈现平面反式构象时,能够插入到碱基对层间空隙中,而且其疏水性可以增强碱基间堆积力,从而提高双链核酸的稳定性;当偶氮苯单元异构为非平面顺式结构时,空间位阻增大,碱基间氢键作用减弱,导致双链核酸的稳定性和熔融温度(Tm)降低[35]. 这种修饰方式目前主要用于光调控双链核酸的杂交和解链[36~38]. 在偶氮苯亚磷酰胺单体中,偶氮苯基团需要借助桥连单元连接核酸骨架,这种桥连单元的结构会影响偶氮苯的光致异构化效率. 目前最为常见的桥连单元是D-苏氨醇[39],其能够匹配顺B-型DNA右手螺旋,使结构更加稳定[40]. 但D-苏氨醇偶联的偶氮苯骨架(D-tAzo)[图3(A)]在37 ℃下的光异构化效率较低,仅为30%[41]. Liang 等[42]将更为柔性的R-甘油偶联的偶氮苯(R-gAzo)整合至寡聚核kl 苷酸链中[图3(B)],使偶氮苯单元的光异构化效率显著增强,室温下能够获得80%的顺式异构体[43]. 此外,Burghardt等[43,44]将β-糖环偶联的偶氮苯骨架(β-dAzo)插入RNA中[图3(C)],同样能有效地完成光异构化,甚至在高温时异构化效率能与D-tAzo修饰的RNA双链相比.
核苷作为偶氮苯单元的修饰位点,可分为五碳糖以及碱基两部分[图2(C)和(D)]. 其中,核苷中五碳糖的修饰位点主要集中在糖环2′位[图2(C)]. 通过酰胺化[45]和环加成[46]反应可将偶氮苯类分子偶联至寡聚核苷酸的糖环2′位. 这类偶联模式会拉大偶氮苯驱动单元与碱基之间的距离,降低整体结构的光驱动效率[47]. 将偶氮苯分子修饰到碱基上[图2(D)],同样会遇到光驱动效率低的难题,这主要是由于偶氮苯分子与互补链的碱基相对距离较短,光异构反应的空间位阻增大所致. 精确考量偶氮苯单元与碱基的构效关系,是获得高顺反异构效率的关键. 目前,主流的修饰策略是将偶氮苯通过点击反应修饰至脱氧尿嘧啶的C5位,这种偶联方法在紫外光照下可获得60%的顺式异构体[48,49]. 将偶氮苯单元作为乏氧激活因子,直接偶联至碱基中,同样能够构建乏氧驱动的DNA纳米机器. Tan等[32]通过DNA固相合成仪将氨基修饰的腺嘌呤(iAmMC6-dT)整合至核酸适配体中,再与聚乙二醇-偶氮苯-N-羟基琥珀酰亚胺酯(PEG5000-azo-NHS)偶联构建乏氧响应的适配体偶联物[图2(G)]. 当其未处于肿瘤部位时,聚乙二醇的位阻效应会阻碍核酸适配体与靶点蛋白结合,使其不具有识别作用. 当处于肿瘤乏氧微环境中,偶氮苯基团中氮-氮双键被还原断裂,适配体恢复识别功能,从而减少脱靶效应.
核酸磷酸骨架的偶氮苯单元修饰主要包含2种方法:(1)偶氮苯基团通过取代反应与硫代磷酸酯修饰的寡聚核苷酸偶联[50][图2(E)]. 由于偶氮苯驱动单元与碱基距离较远,影响光驱动效率,因此这种方法不适宜构建光敏DNA纳米机器,但可作为乏氧激活的DNA纳米机器的构建方法;(2)偶氮苯基团作为连接单元,连接2条寡聚核苷酸的两端构建发卡核酸[51,52][图2(F)]. 这种方法是目前用于构建光驱动的DNA纳米机器的主要工具. Wu等[33]将反义寡核苷酸(asODN)两端通过4,4′-羟甲基偶氮苯分别偶联短链核酸(含有5个碱基),实现了光控RNA的降解[图2(H)]. 当偶氮苯单元处于反式结构时,其两端相邻碱基互补配对不受影响,此时核酸形成稳定的发夹结构;当偶氮苯单元处于非平面的顺式结构时,偶氮苯相邻碱基空间位阻增大,导致发夹结构失稳,寡核苷酸与RNA 结合,使RNA 在RNase H的作用下降解.
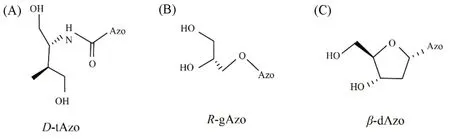
Fig.3 Bridging groups between azobenzene and nucleic acid
1.2 偶氮苯类DNA纳米机器的构建
传统偶氮苯类DNA纳米机器需要紫外光触发,其光响应范围在340~360 nm[53],此波长区间的光通常会破坏胞内酶的结构功能,与生物系统不兼容[54]. 相比之下,可见光响应的偶氮苯类DNA纳米机器则具有更广泛的应用前景[图4(A)].
通常偶氮苯及其烷基衍生物的反式异构体在320 nm 左右(π-π*跃迁)具有最大吸收峰(λmax),在310~370 nm的光照射下可得到顺式异构体[53]. 当苯环对位引入供电子基团时,可使λmax向可见光区域红移. 然而,π-π*和n-π*跃迁的重叠(约450 nm)会降低顺式结构的热稳定性,从而难以获得稳定的顺式结构[55]. 为避免这些不利因素,可见光响应的偶氮苯衍生物理想的λmax应在400 nm左右[56]. 基于此,Asanuma等[18][图4(B)]合成了一种可见光响应的偶氮苯衍生物——2,6-二甲基-4-(甲硫基)偶氮苯-4′-羧酸(S-DMazo). 在供电子基团的影响下,偶氮苯衍生物(反式异构体)的最大吸收峰红移至400 nm,同时偶氮苯邻位修饰的2个甲基增强了衍生物光致异构的效率及顺式异构体的热稳定性. 在400和450 nm的光照射下,S-DMazo分别进行反式到顺式和顺式到反式的异构化. 将S-DMazo通过D-苏氨醇偶联至DNA 中,当S-DMazo 呈现反式构象时,同样能够增强双链DNA 的Tm;而当S-DMazo 呈现顺式构象时,双链DNA解开.
Asanuma等[57]发现,当L-苏氨醇作为桥连单元时,DNA双链的稳定能力小于D-苏氨醇桥连的稳定能力,且偶氮苯的对位被烷基修饰时,这种现象进一步增强[图4(C)]. 利用这一性质,Asanuma 等[58]通过L-苏氨醇桥连对位修饰烷基的偶氮苯单元构建了一种可见光响应的新型偶氮苯类DNA 纳米机器. 与常规偶氮苯类DNA纳米机器不同,此修饰方式在偶氮苯单元呈现顺式构象时(400 nm),能够促进DNA双链形成;当其呈现反式构象时(520 nm),DNA双链解离,而且这种新型纳米机器提高了常温光致异构的效率.

Fig.4 Schematic illustration of azobenzene⁃modified DNA(A)The azobenzene-based DNA nanomachines responding to visible light;(B)S-DMAzo[18];(C)L-tAzo[58];(D)oF4Azo[59];(E)CL-siRNAzo[60].(B)Copyright 2012,Wiley-VCH Verlag GmbH & Co. KGaA,Weinheim;(C)Copyright 2019,Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim;(D)Copyright 2019,Beilstein-Institut;(E)Copyright 2020,Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim.
Olalla 等[59]通过固相合成法将可见光响应的四邻氟偶氮苯单元(oF4Azo)引入肽核酸(PNA)体系[图4(D)]. 与寡聚核苷酸体系相比,这种肽核酸同样能够实现光控PNA/DNA或者PNA/RNA的解链与杂交(405 nm/520 nm). 更重要的是,这种PNA 与互补DNA 或RNA 具有更高的结合亲和力,改善了生理条件下辨别碱基错配的能力. Hammill等[60]将四邻氯偶氮苯亚磷酰胺单体通过DNA固相合成仪整合至siRNA的正义链(CL-siRNAzos)中,在410 nm/660 nm可见光诱导下实现了正义链与反义链的解链与杂交,从而进一步对RNA 干扰行为进行调控[图4(E)]. 这些体系规避了紫外光,拓展了偶氮苯-核酸纳米机器在生物体内的应用.
2 偶氮苯类光控DNA纳米机器的应用
目前,将偶氮苯驱动单元整合至寡聚核苷酸中主要用于构建光控纳米机器,较少用于构建乏氧驱动的纳米机器[61]. 基于此,本节集中讨论偶氮苯类光控DNA纳米机器,提供了若干例子用于展示其在各个领域的最新进展,并总结了其优缺点,为扩展其应用提供参考.
2.1 调控酶活性
酶活性与新陈代谢、营养和能量转换等生命过程密切相关. 可逆调节酶活性对于细胞和有机体功能的调控具有重要的生物学意义[62].
凝血酶对于内环境稳态的调节至关重要,并且与许多类型癌症的发生有关[63]. 通过偶氮苯类DNA纳米机器调节凝血酶适配体与凝血酶的结合或解离,能够实现对凝血酶活性的调控[64]. Tan等[65]将偶氮苯修饰在与凝血酶适配体互补的DNA 序列中(cDNA),再通过聚乙二醇将其连接到适配体上[图5(A)]. 当偶氮苯呈现反式构象时,凝血酶适配体与cDNA杂交,不影响凝血酶功能;当其呈现顺式构象时,诱导发夹结构(双链)的解离,适配体结合凝血酶从而抑制其功能发挥,实现对凝血酶的调控. 偶氮苯类DNA 纳米机器调控G-四链体的形成和解离为调控凝血酶活性提供了新的方法[66].Zhou等[67]发现偶氮苯衍生物可诱导端粒DNA的折叠(G-四链体)-拉伸(链状). 在此基础上,进一步利用偶氮苯衍生物(Razo)-端粒DNA体系[图5(B)]实现了对凝血酶的调控[68]. 端粒DNA两端连接2个不同的凝血酶适配体,当Razo呈现顺式构象时,诱导端粒DNA折叠形成G-四链体结构,2种适配体脱离凝血酶且不影响其功能;当Razo呈现反式构象时,诱导端粒DNA拉伸成链状,适配体与凝血酶结合且抑制其功能发挥,实现了对凝血酶的调控. 该系统已经成功地用于调节人体血浆的凝血过程,有望推动生物医学和制药应用领域的研究.

Fig.5 Azobenzene⁃based DNA nanomachines for regulation of enzymatic activity(A)The azobenzene-modified cDNA regulate thrombin activity[65];(B)razo and telomere DNA regulate thrombin activity[68];(C)light-responsive azobenzene-integrated DNA duplex for controlling GOx/HRP protein enzyme cascade activity[69];(D)regulation of enzyme Cascade activity[70].(A)Copyright 2009,National Academy of Sciences;(B)Copyright 2016,American Chemical Society;(C)Copyright 2011,American Chemical Society;(D)Copyright 2018,American Chemical Society.
酶反应可通过级联的方式协同作用,如在葡萄糖氧化酶(GOx)和辣根过氧化物酶(HRP)级联体系中,GOx催化形成的产物可作为HRP 反应的底物. 这种体系可减少中间产物的积累,提升酶反应速率,对于控制细胞信号转导也起着重要作用. Tan 等[69]将GOx连接至偶氮苯-DNA 上作为信号转导的“臂”,同时HRP连接到cDNA上[图5(C)]. 通过杂交/解离调控GOx和HRP之间的距离,提升酶反应的效率,实现了对酶促反应的精确控制.
在酶级联活性调控过程中,对酶及偶氮核酸纳米机器进行合理的空间排列是获得高效的级联催化的关键. Yan等[70]利用DNA折纸作为发生级联的酶平台[图5(D)],精确编码组装酶间距及偶氮苯修饰的摆动臂,从而优化酶级联活性. 以葡萄糖6-磷酸脱氢酶(G6pDH)和乳酸脱氢酶(LDH)级联反应为模型,反应以6-磷酸葡萄糖被G6pDH 氧化开始,同时烟酰胺腺嘌呤二核苷酸辅酶(NAD+)被还原为烟酰胺腺嘌呤二核苷酸辅酶(NADH);然后LDH利用NADH将丙酮酸还原为乳酸,反应再生的NAD+继续级联反应. 因为NAD+在级联反应中的循环作用,所以将其作为G6pDH和LDH之间的摆动臂. 为了实现控制NAD+摆臂运动,将偶氮苯引入摆臂链(HJ-armAZO)和可与之杂交的锚定链(anchor-AZO)中,然后DNA 折纸精确组装酶级联、摆臂链和锚定链. 在可见光和紫外光的照射下,调节HJ-armAZO 链和anchor-AZO 链的杂交/解链,诱发摆臂链远离/靠近酶级联. 这种方法将代谢中间物从一种酶直接转移至下一种酶,避免游离产物释放到溶液中,加快了代谢物的加工并提高底物的选择性[71],实现了干净、快速、可逆地光调控酶级联活性.
2.2 调控物质传输
生物分子的选择性跨膜运输具有重要意义. 受到生物通道介导三磷酸腺苷(ATP)转运的启发[72],Jiang等[73]通过光响应的偶氮苯类DNA纳米机器构建了人工纳米通道,实现ATP分子的光调节跨膜捕获-释放-运输. 首先将偶氮苯单元偶联至ATP适配体中,然后将其修饰在锥形聚酰亚胺(PI)纳米通道内[图6(A)]. 当可见光照射时,适配体形成发夹结构,同时捕获ATP分子;当紫外光照射时,适配体则呈现单链状态,释放ATP 分子. 该体系能够在折叠与展开状态之间进行切换,实现ATP 的光控输运. 通过指数富集配体的系统进化,改变核酸适配体序列,可以构建不同的偶氮苯-DNA适配体纳米通道,适用于各种分子、离子甚至癌细胞的运输.

Fig.6 Azobenzene⁃based DNA nanomachines for photo⁃responsive regulation of material transport(A)Azobenzene-modified DNA nanochannel for ATP transmembrane transport[73];(B)azobenzene-modified DNA nanochannel for ion transport[76];(C)schematic illustration of the construction and working mechanism of the ionic gate based on the interaction between GO and azobenzene-DNA-modified PAA membrane[77];(D)azobenzene-integrated DNA nanopump for photo-regulating Dox release[79].(A)Copyright 2018,American Chemical Society;(B)Copyright 2016,Wiley-VCH Verlag GmbH & Co. KGaA,Weinheim;(C)Copyright 2019,American Chemical Society;(D)Copyright 2019,Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim.
天然蛋白质通道通常嵌入脂质双分子层中,因其脆弱且不稳定,不适宜用作体外离子通道实验材料. 相比之下,构筑人工光敏离子通道更有助于离子传输的研究[74]. 受视紫红质光控离子通道原理的启发[75],Jiang等[76]基于偶氮苯类DNA纳米机器的光致异构性构建了光控纳米通道[图6(B)],实现了对离子传输过程的调节. 整合偶氮苯的DNA分子,通过金-硫键被固定在锥形聚对苯二甲酸乙二醇酯纳米通道内. 在可见光照射下,DNA呈现发夹结构,扩大了纳米通道的有效直径(开放状态);在紫外光照射下,DNA呈现单链状态,减小了有效直径(闭合状态),阻断了纳米通道,实现光控调节离子传输. 这种纳米通道响应快,具有良好的生物相容性,在光控药物传输、光信息存储和逻辑网络等方面将具有潜在的应用前景. 利用相同的原理,Li等[77]构建了一种新型氧化石墨烯离子门用于光控离子传输. 这种类视紫红质仿生离子门为研究离子通道、离子功能和离子数量提供了一种新的模型和方法[图6(C)].
通过偶氮苯的光异构转换可实现光控药物传输,如抗癌药物阿霉素(DOX)的光控递送. Tan等[78]将偶氮苯修饰的DNA双链装载在介孔二氧化硅的孔口处,同时将DOX装载于介孔二氧化硅中,制备了光子调控的药物释放系统. 在可见光照射下,DNA双链形成,孔口闭合,药物被封装在介孔二氧化硅纳米孔中;紫外光照射时,DNA双链解离,孔口打开实现药物释放. 此外,Liu等[79]基于偶氮苯的光致异构性构建了一种DNA纳米泵,用于快速高效的药物传输[图6(D)]. 偶氮苯-DNA通过配体交换被修饰至上转换纳米颗粒(UCNP)表面,DOX选择性插入DNA双螺旋中,形成高效负载药物的纳米泵. 在近红外光照射下,UCNPs同时发射紫外和可见光光子,使偶氮苯单元如同叶轮泵在光照下连续进行顺反异构. 当偶氮苯单元呈现反式构象时,堆叠在相邻碱基对之间,DNA双链形成,纳米泵闭合,不释放DOX;当其呈现顺式构象时,使DNA双链解离,纳米泵打开,实现光控DOX释放. 该体系的DOX释放率在30 min 内可以达到86.7%. 通过在体系中组装核定位肽(HIV-1 TAT),能够进一步实现药物的细胞核靶向递送,从而增强抑癌效果.
2.3 调控机械运动
链置换反应是目前构建DNA机械运动的基本原理[80],但这种策略产生的“废物”链会逐渐积累,进而降低驱动效率[81]. 由光驱动运行的DNA纳米机器可以克服燃料链逐步累积的缺点[82]. Asanuma等[18]基于偶氮苯构建了一种光燃料DNA“跷跷板”[图7(A)]. 这种DNA“跷跷板”由4条寡核苷酸链组成:整合5个S-DMazo的寡核苷酸(L bar,20 nt)、未修饰偶氮苯的寡核苷酸(M bar,25 nt)、整合5个偶氮苯单元的寡核苷酸(R bar,20 nt)以及DNA模板链(Temp,65 nt). 在450 nm光照射下,S-DMazo和偶氮苯单元呈现反式构象,L bar/Temp和R bar/Temp双链呈现杂交状态(state a). 在390 nm(或400 nm)光照下,S-DMazo呈顺式构象,而偶氮苯单元保持反式构象,L bar/Temp双链解离,R bar/Temp双链保持稳定状态(state b). 在340 nm光照下,S-DMazo 异构为反式,而反式偶氮苯单元异构为顺式,因此L bar/Temp双链杂交,R bar/Temp 双链解离(state c). 在370 nm 光照下,S-DMazo 和偶氮苯单元都呈现顺式构象,L bar/Temp 和R bar/Temp 双链都离解(state d). 中间的双链(M bar/Temp)在所有状态下都是稳定的双链. 通过偶联S-DMazo和偶氮苯单元,其可以在不同波长的光照射下以“跷跷板”的形式运动.

Fig.7 The azobenzene⁃based DNA nanomachines for photo⁃responsive regulation of mechanical motion,cellular morphology and molecular communication(A)Scheme illustration offour possible states(a,b,c,and d)of the DNA machines containing S-DMazo and azobenzenemodified DNAs are achieved byirradiation at four wavelengths(340,370,390 and 450 nm,respectively)[18];(B)scheme illustration of DNA Walker[83];(C)azobenzene-integrated DNA machine for photo-regulating cellular morphology[85];(D)schematics of photo-actuated reversible transport of molecules between two DNA coacervates[86].(A)Copyright 2019,Wiley-VCH Verlag GmbH & Co. KGaA,Weinheim;(B)Copyright 2012,Wiley-VCH Verlag GmbH & Co. KGaA,Weinheim;(C)Copyright 2019,Wiley-VCH Verlag GmbH & Co. KGaA,Weinheim;(D)Copyright 2022,Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim.
基于相同原理,Asanuma等[83]进一步利用2,6-二甲基偶氮苯(DM-Azo)和2,6-二甲基-4′-(甲硫基)偶氮苯(S-DM-Azo),首次构建出能够在一维空间双向移动的正交光控非自主DNA 步行器[图7(B)].该步行器系统由3 个部分组成:S-DM-Azo 和DM-Azo 修饰的“两足”DNA 步行器(LEG A,LEG B)、4 个foothold 链(F)组成的步行器行走路径(F1,F2,F3和F4)及toehold 寡脱氧核苷酸链(TO). TO-1和TO-2可分别与F1 和F2 上的片段碱基互补配对. 当步行器两足分别位于F1 和F2 时为起始位置,TO-A 和TO-B与两足杂交. 在385 nm光照下,S-DM-Azo 呈现顺式构象,使LEG A 与TO-A解链,LEG A 向前移动到F3,TO-1 结合F1. 在365 nm 光照下,DM-Azo 呈现顺式构象,使LEG B 和TO-B 解链,LEG B 向前移动到F4,TO-2结合F2. 随后步行器再经385 nm光照射时,S-DM-Azo呈现反式构象,两足反向移动一步. 最后,450 nm的光照射使DM-Azo呈现反式构象,两足反向移动回到起始位置. 这种前所未有的步行器系统设计实现了高精度的运动控制,为推进非自主性DNA机器开辟了新途径,促进了其在纳米尺度上的应用.
2.4 其它应用
准确模拟细胞的形态变化、修复和分化等动态过程有助于深入探究细胞生命活动[84]. Masayuki等[85]构建了一个偶氮苯修饰的DNA聚合物用于可逆调控细胞形态变化[图7(C)]. DNA聚合物由修饰偶氮苯的DNA链(S1-Azo)、修饰细胞粘附肽(RGD)的DNA链(S2-RGD)及与这两条DNA链碱基互补配对的模板链组成. 在可见光照射下,DNA双链杂交,DNA聚合物形成线性结构,细胞呈现纺锤形. 在紫外光照射下,DNA双链解旋,模板链形成发夹结构,这种构象变化产生了11.6 nm的收缩,改变了细胞RGD之间的距离,细胞的形态发生了明显的变化,呈现圆形;经可见光照射后,细胞形态逆转回纺锤形,这表明光照射后细胞的收缩和扩张是可逆的. 这种光控可逆的动态DNA聚合物可以作为一个高效的工具用于研究细胞形态、组织修复、癌症转移和细胞分化等许多重要的现象. 利用人造细胞器模拟细胞之间物质交换有助于深入理解细胞内分子通信. Deng等[86]在油包水液滴中通过液-液相分离制备了无膜DNA凝聚体;然后将DNA凝聚体作为人造细胞器,偶氮苯修饰的DNA作为通讯分子,通过光调控实现生物双向转运,从而模拟胞内通信[图7(D)]. 首先,将含有2 种不同黏性末端序列(SE1 和SE2)的单链DNA分子通过液-液相分离形成不同的DNA凝聚体,以此模拟2种不同的细胞器;然后在DNA凝聚体中加入3种单链DNA(ssDNA):修饰FITC的信号分子ssDNA1、修饰偶氮苯的ssDNA2和修饰偶氮苯的发夹DNA,ssDNA2能够结合在SE1 DNA凝聚体上,发夹DNA能够结合在SE2 DNA凝聚体中. ssDNA 1与ssDNA2完全互补配对,但与发夹DNA部分配对. 在紫外光照射下,ssDNA1与ssDNA2解离,发夹DNA解离成单链DNA,此时ssDNA1由SE1 DNA凝聚体转移到SE2 DNA凝聚体与单链发夹DNA 结合;当切换成可见光照射时,单链发夹DNA 形成发夹构型,ssDNA1从SE2 DNA 凝聚体再转移回到SE1 DNA凝聚体上,因此模拟了在不同细胞器之间细胞通信. 此研究展示了一种在多个细胞器中控制分子输运的新途径,在微反应器、功能材料和药物递送领域具有潜在的应用前景.
3 总结与展望
本文概述了基于偶氮苯的DNA纳米机器的构建方式及优缺点,呈现了其在生物、医学、材料等方面的广泛应用. 毫无疑问,随着对偶氮苯性质探究的不断深入,基于偶氮苯的DNA纳米机器的研发将展现出更多的优势和更大的潜力.
尽管如此,基于偶氮苯的DNA纳米机器的应用仍面临着一些障碍和挑战. 首先,偶氮苯类化合物存在光致异构化的量子产率低、顺式异构体的热稳定性差、半衰期短以及顺反异构体出现吸收带重叠影响异构效率等问题. 这些问题限制了偶氮苯在生物医学领域的应用. 此外,乏氧、可见光甚至近红外光响应性的偶氮苯DNA纳米机器的例子仍然鲜有报道. 因此,开发优良特性的偶氮苯类光响应单元极为重要. 然后,进一步探究偶氮苯类化合物在乏氧环境(例如氧浓度变化和体内还原剂)中的氧化还原性质,有望为构建新型偶氮苯类DNA纳米机器提供思路.
目前基于偶氮苯的DNA纳米机器在生物、医学和化学等方面取得了许多进展,对其进一步的研究能使其在更多创新领域创造更高的价值. 要实现这些目标,需要各领域专业知识与创新思维的结合,这无疑将激励更多生物医学和化学等领域的研究人员来面对这些机遇和挑战.
