光/还原双重响应水凝胶微球的制备及在细胞三维(3D)培养中的应用
2022-08-22王学斌茆华女项艳鑫包春燕
王学斌,薛 源,茆华女,项艳鑫,包春燕
(华东理工大学化学与分子工程学院,上海市功能性材料化学重点实验室,上海 200237)
随着药学、细胞生物学和组织工程与再生医学领域的不断发展,哺乳动物细胞的体外培养成为研究热点,其可为生物体外的细胞和组织的生理和病理研究提供基础实验平台. 最初,研究者们主要通过在聚苯乙烯(TCPS)、玻璃及组织等类似物材料表面进行二维(2D)细胞培养. 这项技术的应用使人们能够在体外研究细胞的生理和病理活动[1~3]. 随着研究的不断深入,2D细胞培养的局限性也逐渐展现出来. 一方面,科学家发现在2D培养生长环境中,细胞的生理状态和行为活动相比于体内三维(3D)生长的细胞往往存在很大的差异,导致研究结果与体内结果经常不一致[4~8];另一方面,2D培养由于本身的空间限制,增殖效率低,已经无法满足当今细胞治疗和相关应用研究的大剂量需求.
针对2D细胞培养存在的问题和局限性,人们开始寻求能高度拟合自然细胞微环境的3D支架材料进行3D细胞的培养[9~12]. 其中,水凝胶由于其高含水量和可高度拟合细胞外基质(ECMs)的网络结构而成为3D细胞培养基质的首选材料[13~16]. 特别是具有高比表面积的水凝胶微球载体,它可以通过表面修饰模拟3D自然微环境,是一种高效的适用于细胞大规模3D培养的支架材料[17~19]. 为了使培养的细胞最终实现在细胞移植、组织工程和再生医学中的应用,除了需要细胞能在仿生3D微环境下培养外,还需要细胞与载体能进行可控分离并实现无创捕获. 目前,大部分3D微载体通过酶消化(胰蛋白酶)的方法分离和捕获细胞,但这种方法会破坏细胞膜的完整性,从而影响捕获细胞的进一步应用[20]. 为了克服这一缺点,人们开始致力于开发对环境变化敏感的刺激响应水凝胶材料,利用外在温和刺激调控细胞与载体的黏附和分离,从而实现3D细胞的大规模培养与捕获. 如温度敏感的聚(N-异丙基丙烯酰胺)(pNIPAAM)水凝胶已被证明可用于大规模细胞培养和无酶捕获的载体[21,22]. 但这种方法对于一些温度敏感的细胞并不友好,并不能普遍适用. Lee 等[23]利用pH 响应的聚氨酯作为基质实现了细胞的无酶释放,但是这种低pH(pH=6)的释放条件也不能普适于所有细胞,存在细胞相容性差的潜在问题.
与热和pH响应相比,光响应刺激由于可以远程控制、允许时空可控并具有所需的生物相容性而更具吸引力. 因此,本文提出构建一种光/还原双重响应的水凝胶微球载体用于细胞的3D大规模培养和无酶无损捕获. 如Scheme 1所示,水凝胶微球主要由甲基丙烯酸羟乙酯(HEMA)、聚乙二醇单甲醚甲基丙烯酸酯(PEGMA,Mw=300)、光/还原双重响应功能单体(M1)和交联剂聚乙二醇二丙烯酸酯(AAPEG-AA,Mw=2000)经过W/O型微乳法聚合得到. 通过光照微球表面醛基的生成实现细胞黏附蛋白的固定,从而引导人脐静脉血管内皮细胞(HUVEC)的黏附、生长和增殖. 通过加入还原剂谷胱甘肽(GSH)温和剪切二硫键,实现细胞在微球表面的无损释放,实现细胞的大规模获取. 该双重响应的微凝胶体系为3D细胞大规模培养和无酶获取细胞提供了有效的方法,也为构建新型响应型水凝胶并实现其在生物医学和组织工程等方面的应用提供了新思路.

Scheme 1 Schematic presentation of preparation of dual⁃stimuli responsive hydrogel microsphere(A), the mechanism of photoinduced reaction with protein(B)and the schematic diagram of cell adhesion and release(C)
1 实验部分
1.1 试剂与仪器
过硫酸铵(APS)、四甲基乙二胺(TEMED)和谷胱甘肽(GSH),上海麦克林生化科技有限公司;司班80(Span-80)和石蜡油,中国医药集团上海公司;单体PEGMA,AA-PEG-AA 和HEMA 等有机试剂,梯希爱(上海)化成工业有限公司(TCI);异氰酸酯罗丹明B,上海阿拉丁生化科技有限公司;明胶(Gelatin)和牛血清蛋白(BSA),西格玛奥德里奇(上海)贸易有限公司(Sigma-Aldrich);人脐静脉血管内皮细胞(HUVEC),中国科学院上海科学院细胞库,其培养方式按照细胞库标准,生物实验中所用到的细胞培养试剂均来自赛默飞世尔科技(中国)有限公司;细胞活死染色试剂(Calcein-AM/PI)和细胞计数试剂(Cell Counting Kit-8,CCK-8),艾博抗(上海)贸易有限公司(abcam). 实验用水均为去离子水;实验用磷酸盐缓冲液(PBS)均为0.01 mol/L无菌PBS(pH=7.2).
600 MHz 型核磁共振波谱仪(NMR),德国Bruker 公司;XEVO G2 TOF 型飞行时间质谱仪,美国Waters 公司;Nicolet 5700 型傅里叶变换红外光谱(FTIR)仪,全反射(ATR)模式,美国ThermoFisher 公司;S-4800型场发射扫描电子显微镜(SEM),日本Hitachi公司;Leica AF6000型激光共聚焦显微镜,德国Leica Microsystems 公司;UV-2550 型紫外-可见光(UV-Vis)分光光度计,日本Shimadzu 公司;MCO-15AC型二氧化碳细胞培养箱,日本Sanyo公司.
1.2 光-还原双重响应功能单体的合成
参照文献[24]方法合成M1,并对其进行了核磁共振氢谱、碳谱与质谱表征.1H NMR(400 MHz,CDCl3),δ:7.75(s,1H),7.11(s,1H),6.61(s,1H),6.29(m,1H),6.20(m,1H),5.67(m,1H),5.53(s,2H),4.60(s,2H),3.99(s,3H),3.72(m,6H),3.64(m,10H),3.57(t,J=4.82 Hz,2H),3.42(t,J=4.74 Hz,2H),2.87(m,5H).13C NMR(101 MHz,CDCl3),δ:167.71,165.18,156.18,154.21,146.56,139.39,132.01,129.48,125.81,111.40,111.12,72.79,70.28,70.21,70.20,70.02,69.63,68.49,62.80,60.67,56.81,38.40,38.17,37.55,37.39. MS(ESI),C26H40N4O12S2Na+([M+H]+),m/z计算值(理论值):687.1976(687.1983).
1.3 水凝胶微球的制备
将90 mg(0.7 mmol)HEMA、90 mg(0.3 mmol)PEGMA单体、80 mg(0.2 mmol)AA-PEG-AA交联剂以及20 mg(0.03 mmol)M1 加入到1 mL 乙腈/水(体积比为4/1)的混合溶剂中,振荡混合均匀后,通入N2气15 min 以除去其中的O2气;加入浓度为2 mol/L 的APS 水溶液和2 mol/L 的TEMED 水溶液各50 μL,快速涡旋至混合均匀;将混合后的溶液装入注射器中并匀速滴加至含有1%(体积分数)Span-80的石蜡油(5 mL)中,在300 r/min的转速下搅拌30 min后,将石蜡油乳液倒入100 mL去离子水中并用不同尺寸筛网过滤,以获得粒径在150~250 μm的水凝胶微球. 将筛选后的水凝胶微球在乙腈/水(体积比为1∶1)的混合溶剂中透析至溶液中检测不到M1分子的紫外吸收后,将水凝胶微球于PBS中平衡24 h,然后浸入到含10%双抗(Penicillin/Streptomycin)的PBS溶液中室温静置2 h;将水凝胶微球浸泡在含10%FBS和1%P/S的DMEM无菌培养基中,并于4 ℃下保存备用,所得双重响应水凝胶微球命名为DRG.
采用相同的方法,在制备过程中不加入M1,制备不含功能分子M1的水凝胶微球,命名为NRG.
1.4 水凝胶微球表面蛋白的固定
1.4.1 荧光染料标记牛血清蛋白(Rho-BSA)的制备 将100 mg(1.5×10-3mmol)BSA 溶于10 mL PBS(pH=7.2,0.01 mol/L)中,于4 ℃搅拌并用氩气保护;将7.2 mg(0.013 mmol)异氰酸酯罗丹明B 溶于1 mL DMSO 中并缓慢滴加到上述BSA体系中,于4 ℃搅拌反应12 h;将所得混合溶液转移到截留分子量为10000的透析袋中,在水中透析3 d;通过冷冻干燥得到罗丹明B标记的牛血清蛋白(Rho-BSA).
采用相同的方法,用罗丹明标记明胶,制得Rho-gelatin.
1.4.2 DRG表面蛋白的固定 静置DRG水凝胶微球使其沉降到离心管底部,轻轻吸出上层培养基,加入1 mL Rho-BSA 或Rho-gelatin 溶液(0.5 mg/mL). 轻轻摇晃使水凝胶微球分散在溶液中并光照2 min(365 nm,10 mW/cm2),静置3 h后将溶液吸出并加入2 mL异丙醇/去离子水(体积比为1∶4)混合溶剂,放入摇床振荡以清洗表面物理结合的蛋白,每小时更换一次溶液. 清洗3次后用PBS溶液清洗3次,得到的微球储存在4 ℃的PBS中.
1.5 水凝胶微球表面细胞的黏附生长
水凝胶微球在进行细胞培养前均进行灭菌处理并用DMEM培养基平衡72 h.
1.5.1 水凝胶微球的毒性表征 通过CCK-8法评价水凝胶微球对HUVEC细胞的毒性. 按照实验分组在24孔抗黏附孔板中加入上述制备的500 μL水凝胶微球和1 mL HUVEC 细胞(5×103Cell). 在培养箱中分别培养1,3 和5 d 后,移除培养基,每孔加入CCK-8 的培养基溶液(体积比为1∶10),培养2 h 后,用酶标仪测定450 nm处的吸光度值(OD值). 以DMEM培养基作为阳性对照,通过下式计算细胞与水凝胶微球共培养不同天数后的存活率(Cell viability,%):
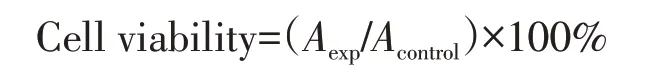
式中,Aexp和Acontrol分别为细胞在含有水凝胶微球和纯培养基中培养不同时间的吸光度值. 实验平行进行6组,取平均值.
1.5.2 水凝胶微球表面的细胞黏附行为 将平衡后的无菌水凝胶微球用1 mL DMEM 培养基分散,使微球浓度大约在20 mg/mL左右,加入到24孔抗黏附孔板中后,加入HUVEC细胞(2×104Cell/孔). 轻拍孔板使细胞均匀分散在水凝胶微球空隙中,随后,将孔板放置于培养箱中进行细胞黏附培养. 培养期间每隔6 h用滴管轻轻吹打水凝胶微球,使细胞均匀生长. 培养增殖不同时间后,用PBS洗涤培养有细胞的水凝胶微球,并用Calcein-AM/PI对细胞进行染色,于激光共聚焦显微镜下观察细胞在水凝胶微球表面的黏附生长情况. 同时,用CCK-8法测定OD值来定量分析细胞在水凝胶微球表面培养1,3和5 d后的增殖行为.
1.6 水凝胶微球表面细胞的释放
1.6.1 GSH 培养基的配制 用不含血清及双抗的DMEM 培养基配制60 mg/mL 的GSH 溶液,加入10%(质量分数)NaOH溶液调节溶液pH值至中性,经0.22 μm的滤膜过滤除菌后待用.
1.6.2 水凝胶微球表面细胞的释放 将500 μL 黏附有细胞的微球用无血清培养基冲洗后加入1 mL GSH 培养基,在37 ℃下培养2 h;通过细胞过滤器分离水凝胶微球,细胞通过离心分离(1000 r/min,5 min)后用细胞计数器计算获取的细胞数量;将部分捕获的细胞加入细胞培养皿中进行贴壁培养,并用CCK-8试剂定量分析捕获细胞的生长增殖情况.
2 结果与讨论
2.1 水凝胶微球的制备与表面光照下蛋白的固定
为了实现更为有效的细胞黏附和释放,水凝胶微球的组分都选取生物相容性好和具有一定抗黏附性能的单体,包括HEMA,PEGMA,AA-PEG-AA 和PEG 功能化修饰的M1. 利用APS/TEMED 氧化还原引发聚合并采用W/O型微乳法得到水凝胶微球. 为了实现微球的光刺激响应性,M1单体中引入了邻硝基苄酯光响应基团,如Scheme 1所示,该基团可在365 nm紫外光照射下发生剪切反应,解离一端的PEG分子,自身生成一个可与氨基发生偶联反应的活性醛基[24],从而使微球表面实现黏附蛋白的固定并促进细胞的黏附生长. 为了实现还原响应性,在M1单体中引入还原响应的二硫键,该二硫键可在温和还原剂GSH的作用下发生键的断裂,从而通过在微球表面解离黏附蛋白实现细胞的释放.
由图1可见,与不含有M1的水凝胶微球NRG相比,DRG的红外吸收光谱在1520 cm-1处出现硝基(—NO2)的反伸缩振动峰[25],说明通过APS/TEMED 引发的自由基聚合,M1 被成功地引入到水凝胶微球中. 经过分析发现,冻干的水凝胶微球大小均匀,直径约为200 μm. 进一步放大局部形貌后能够观察到水凝胶微球的多孔结构[图2(A,B)]. 这说明通过W/O型微乳法,水凝胶单体由于水-油两相的分相以及快速的搅拌可以形成尺寸均匀的乳液,进一步经过原位引发聚合得到水凝胶微球载体. 为了证明蛋白能够通过光照成功地固定于水凝胶微球表面,首先以罗丹明修饰的牛血清蛋白(Rho-BSA)为模型进行研究. 由共聚焦显微镜照片[图2(C,D)]可见,通过365 nm(10 mW/cm2)光源照射水凝胶微球溶液2 min 并在Rho-BSA 溶液(0.5 mg/mL)中静置3 h,清洗后微球的表面出现明显的Rho-BSA的荧光包裹层,表明水凝胶微球通过功能组分M1光生醛基与BSA 胺基偶联将Rho-BSA 共价固定于微球表面.这为后续进行黏附蛋白介导的细胞黏附、生长奠定了基础.
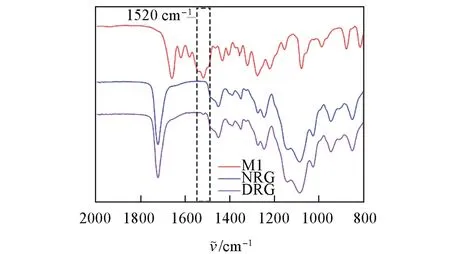
Fig.1 FTIR⁃ATR spectra of M1,hydrogel microspheres DRG and NRG

Fig.2 SEM images of xerogel microspheres by W/O emulsion method(A,B) and confocal microscope images of Rho⁃BSA immobilized hydrogel microspheres(C,D)
2.2 细胞在水凝胶微球表面的黏附生长
作为细胞培养的载体,细胞相容性对于水凝胶微球至关重要. 因此,在考察细胞能否在水凝胶微球表面进行黏附生长之前,对水凝胶微球的细胞毒性进行了详细的研究. 为了实现定量比较,利用CCK-8法[26]对水凝胶微球进行了细胞共培养和毒性测试. 选取HUVEC作为细胞模型. 由图3可见,细胞和水凝胶微球共培养1,3 和5 d 后的细胞存活率均接近甚至超过100%,证明制备的水凝胶微球具有优良的细胞相容性.
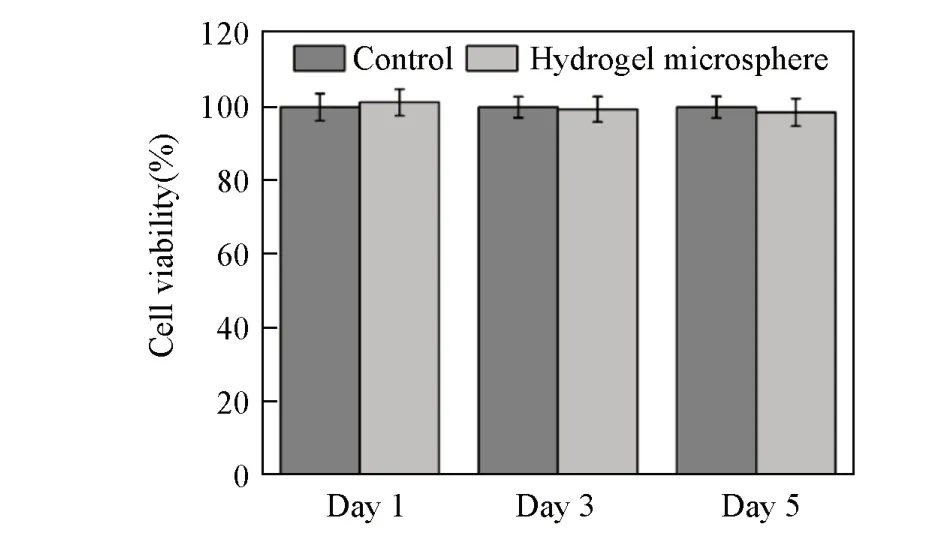
Fig.3 HUVEC cell viability of hydrogel microsphere after coculturing for 1,3 and 5 d
为了实现水凝胶表面细胞的黏附,选取对细胞具有黏附促进作用的明胶(Gelatin)作为黏附蛋白,通过邻硝基苄酯光照偶联反应共价固定到水凝胶微球的表面. 为了实现这一过程的可视化,同样在Gelatin上标记了罗丹明荧光染料(Rho-gelatin). 经过杀菌处理、蛋白固定和清洗后,将微球分散于细胞培养基中并等量加入抗黏附孔板中,然后分别加入同等数量的HUVEC细胞使其黏附到微球表面进行生长. 由图4(A)~(C)可见,培养1 d后,通过共聚焦显微镜的不同通道观察,可以明确看到HUVEC细胞在Rho-gelatin固定的微球表面进行了黏附,488 nm激发波长下的细胞活死染通道呈现绿色,几乎没看到死细胞的存在,说明光生醛基可以稳定地固定黏附蛋白并黏附细胞,所有操作过程温和,细胞相容性好. CCK-8增殖实验结果[图4(D)]表明随着培养天数的增加,细胞数量一直保持增加,说明细胞在水凝胶微球表面不仅可以正常黏附,而且可以长时间保持足够的活性,实现增殖. 为了更好地观察细胞在3D水凝胶表面的生长情况,利用三维共聚焦扫描显微镜观察细胞在水凝胶微球表面的分布和生长状态. 由图5可见,共培养3 d后,更多的细胞在水凝胶微球表面黏附生长,并且细胞铺展呈现良好的生长状态. 这些结果说明通过简单的光照和蛋白的固定就可以实现细胞在3D水凝胶微球载体表面黏附和增殖.
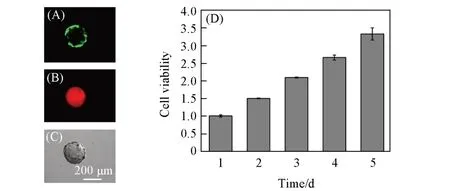
Fig.4 Confocal images of hydrogel microspheres with HUVEC cells adhesion(A—C) and cell proliferation of HUVEC on the Rho⁃gelatin immobilized microsphers from 1 d to 5 d(D)(A)—(C)The images from fluorescence fields[(A)λex=488 nm;(B)λex=561 nm]and the bright field,respectively.
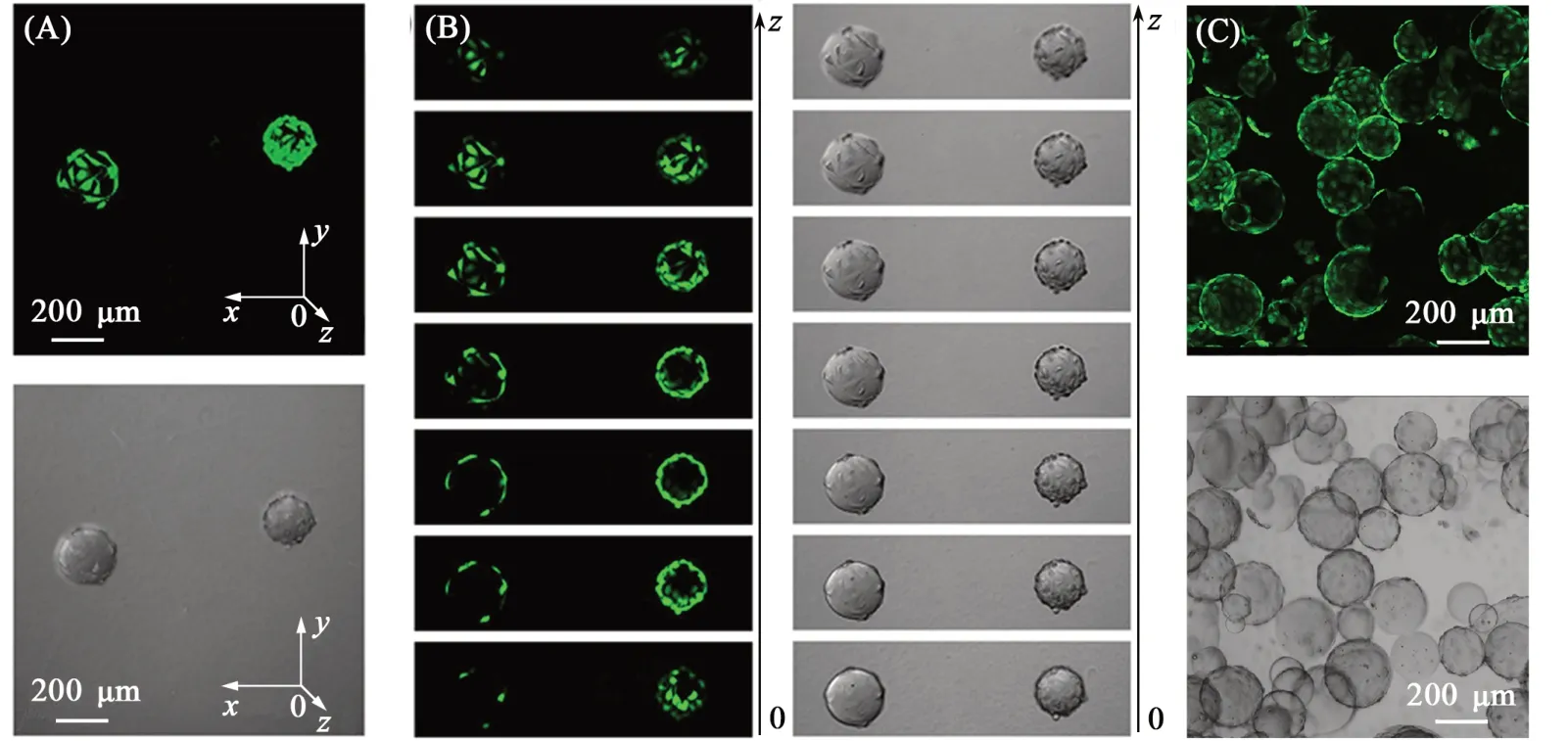
Fig.5 3D Confocal images of HUVEC adhesion on the surface of hydrogel microspheres after coculturing for 3D(A)From top to bottom are the Z-axis overlayed images of fluorescent field(λex=488 nm)and bright field;(B)from left to right are section images of fluorescent field(λex=488 nm)and bright field in Z-axis direction;(C)from top to bottom are the images of fluorescent field(λex=488 nm)and bright field.
2.3 水凝胶微球表面细胞的释放

Fig.6 Time⁃course of cell detachment on hydrogel microspheres upon GSH stimuli with different timeTime/min:(A)0;(B)30;(C)60;(D)90.
细胞的无创采集是实现细胞治疗的前提. 在常规的细胞分离过程中一般会用胰酶来处理细胞,但是长时间的胰酶处理往往会导致细胞一些功能的丧失. 因此,细胞的无酶释放备受青睐. 基于M1中二硫键的还原响应性,我们期望能通过加入GSH实现细胞的无酶释放. 当细胞在水凝胶微球表面黏附增殖到一定程度后(3D培养5 d),加入含GSH的培养基对水凝胶微球进行还原处理. 通过简单的倒置显微镜观察发现,随着GSH孵育时间的增长,水凝胶微球表面的细胞逐渐脱离,并在约90 min实现完全释放(图6 和图7). 为了验证释放过程的细胞相容性,将释放后的细胞转移至细胞培养皿内继续培养,并利用CCK-8评估了分离后的细胞活性. 由CCK-8定量细胞活性图(图8)可以看出,分离后的细胞随着培养时间的延长,呈现正常的增殖. 这充分说明水凝胶微球除了可以实现细胞的温和黏附和3D培养外,还可以通过外加温和还原剂实现高效无酶释放. 与利用温敏性实现细胞脱附的聚(N-异丙基丙烯酰胺)聚合物材料相比[27],细胞在从材料表面脱附的过程中始终处于37 ℃培养环境中,避免了温度变化对细胞的潜在损伤,因而在细胞体外培养领域有着更大的实用潜力.
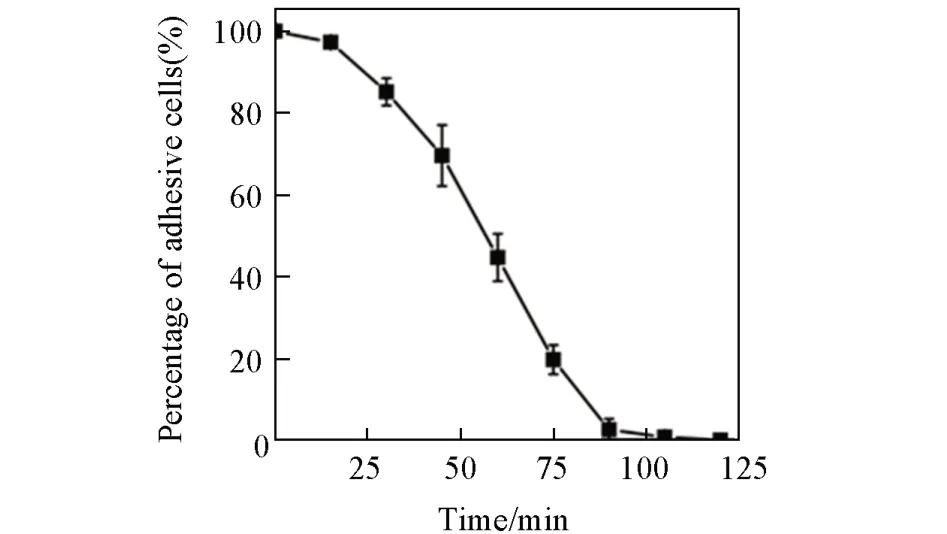
Fig.7 Time⁃course of the detachment percentage of adhesive cells on hydrogel microspheres upon GSH stimuliThe initial percentage of adhesive cells was defined as 100%,three independent samples were explored.
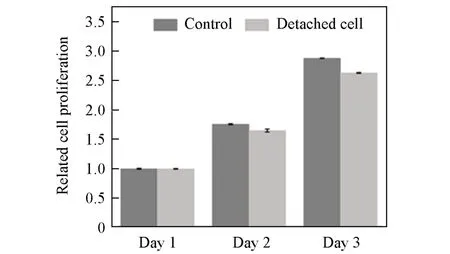
Fig.8 Proliferation analysis for the detached cells from hydrogel microspheres
3 结论
制备了一种光和还原双重响应的子显微水凝胶微球,并将其用作3D细胞培养载体从而实现细胞的黏附、增殖和无损释放. 红外光谱和扫描电子显微镜结果证明了水凝胶微球的成功构建,共聚焦显微镜观察证明通过光照可以实现蛋白在水凝胶微球表面的共价固定,从而通过蛋白介导细胞在水凝胶微球表面的黏附. 良好的材料生物相容性和温和的操作过程能够保障黏附后的HUVEC细胞在微球表面正常铺展与增殖. 显微镜实时追踪观测结果表明,通过加入GSH还原剂,水凝胶微球表面黏附的细胞可以实现无酶释放,并且释放后的细胞保持活性. 该水凝胶微球通用性强,操作简单,显示了在3D大规模培养细胞方面的应用潜力.
