miR-198通过靶向ZEB2调控EMT过程抑制肝癌细胞增殖和迁移的机制研究
2022-08-21李忠辉
陈 偲,李忠辉,王 颖
(1.解放军联勤保障部队第九六九医院感染科, 呼和浩特 010010;2.内蒙古包头市昆都仑区包钢医院a.肿瘤内科;b.老年病科,内蒙古包头 014010)
原发性肝细胞癌(hepatocellular carcinoma,HCC)简称肝癌,是目前全球发病率第五和死亡率第三的恶性肿瘤,其中约50%的新发HCC 病例来自中国,每年大约60 万患者因HCC 死亡[1-2]。HCC 因缺乏敏感度和特异度高的肿瘤分子标志物,早期诊断困难,故从分子机制上探索HCC 的发生和发展,寻找有效的生物治疗靶点是当前研究的重要方向[3]。微小核糖核酸(microRNAs, miRNAs)是一种内源性非编码小分子RNA,大约由21 ~25个核苷酸组成,通常可靶向一个或者多个mRNA通过翻译水平的抑制或断裂靶标mRNAs 而调节基因表达,参与肿瘤多种生物学过程,例如细胞分化、增殖、凋亡及上皮-间质转化(epithelial-mesenchymal transformation,EMT)等[4]。越来越多研究表明miRNAs 在肺癌、食管癌、胰腺癌及结肠癌等[5-9]癌症中普遍存在表达失调的现象,广泛参与多种肿瘤进程,是一种新的肿瘤研究分子靶标。目前有关miR-198 在肺腺癌[10]、乳腺癌[11]、卵巢癌[12]中的异常表达均有报道,但是miR-198 与HCC 的发生、发展关系的研究鲜少。因此本研究以HCC 细胞Huh7 为研究对象,探讨miR-198 对Huh7 细胞增殖和迁移能力的影响及其作用机制。
1 材料及方法
1.1 研究对象 选取人HCC 细胞株HepG2,Hep3G,MHCC97H,Huh7 及人正常肝细胞chang liver,LO2 进行研究,所有细胞均购自中国科学院上海细胞库。选取2020年1 ~3月解放军联勤保障部队第九六九医院病理科留存的20 例HCC 患者的癌组织及邻近正常组织标本,经病理诊断后在液氮中低温保存备用;患者术前未接受任何相关放化疗及新辅助治疗。
1.2 仪器及试剂 RPMI-1640培养基、胎牛血清(美国Thermo Fisher 公司);胰蛋白酶(美国gibco 公司);Trizol 试剂(捷世康生物科技有限公司);脂质体2000(北京天根生化科技公司);miR-198 mimics,mimics NC 由上海生工生物工程有限公司合成;pcDNA3.1-ZEB2 质粒、空载体vector 质粒、ZEB2 3’-UTR-wt,ZEB2 3’-UTR-mut 报告基因质粒由Invitrogen 公司设计构建;逆转录试剂盒(美国Sigma 公司);荧光定量PCR 扩增仪(Applied Biosystems 公司);BCA 蛋白浓度检测试剂盒(上海酶联生物科技有限公司);免疫印迹所需兔抗人ZEB2 多克隆抗体及HRP 二抗(Abcam 公司);CCK-8 试剂盒(碧云天生物公司);双荧光素酶报告基因系统[赛默飞世尔科技(中国)有限公司]。
1.3 方法
1.3.1 细胞培养与传代:本研究中所有细胞株均使用含10g/dl 胎牛血清RPMI-1640 培养液常规培养至细胞贴壁后,0.25 g/dl 胰蛋白酶消化,吹打制成单细胞悬液,进行细胞传代。
1.3.2 细胞转染和分组:取对数生长期待测细胞以1×105/孔接种于6 孔板,待生长密度至85%时参照脂质体2000 说明书进行转染,后常规培养2 天,胰蛋白酶消化,收集细胞进行实验。分组:转染miR-198 mimics 的细胞作为miR-198 过表达组(miR-198 mimics),转染mimics NC 作为阴性对照组(mimics NC),不作任何干预的细胞为空白对照组(Blank),转染miR-198 mimics 与pcDNA3.1-ZEB2 的细胞作为共转染组(miR-198 mimics+pcDNA3.1-ZEB2)。
1.3.3 双荧光素酶报告基因实验:检索生物信息学数据库预测miR-198 的潜在靶基因,发现ZEB2可能是miR-198 的靶基因。利用荧光素酶报告基因实验进行验证,构建包含miR-198 结合区域在内的ZEB2 3’-UTR-wt 野生型和ZEB2 3’-UTR-mut突变型荧光报告基因质粒,与miR-198 mimics 或mimicsNC 共转染到待测细胞中,双荧光素酶报告基因系统检测细胞内荧光素酶活性。
1.3.4 qRT-PCR 实验:Trizol 法提取组织及细胞总RNA,逆转录成cDNA,以此为模板配置反应体系行PCR 扩增实验,扩增体系为:PCR 正反向引物 各1 μl,SYBR Premix EaqTMII(2×) 12.5 μl,cDNA 2 μl,终体积25 μl。反应条件:95℃ 15 s,60℃ 30 s,72℃ 35 s,循环40 次。以U6 作为内参,采用2-ΔΔCt法计算miR-198 和ZEB2 mRNA 相对表达。引物序列见表1。
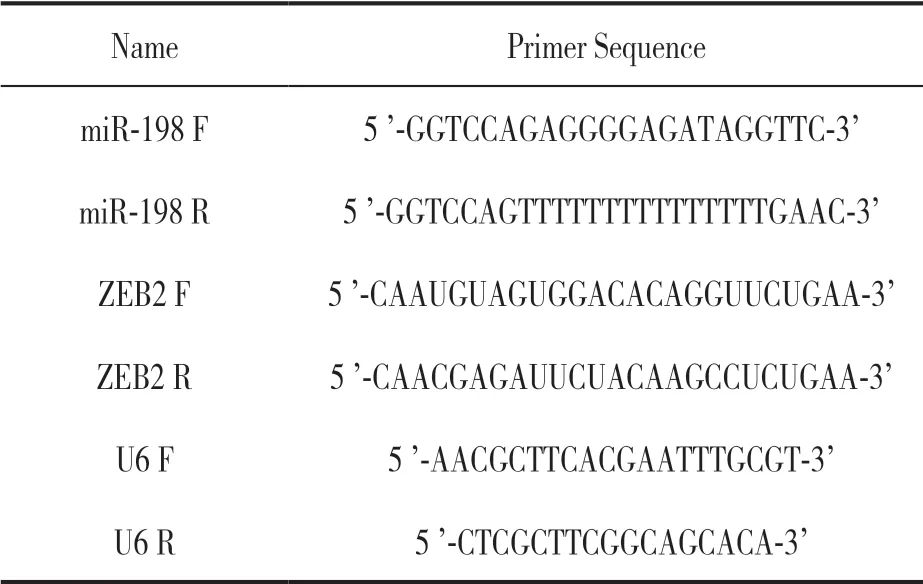
表1 qRT-PCR 引物序列
1.3.5 Western blot 实验:收集细胞,加入RIPA 裂解液提取细胞总蛋白,BCA 法检测蛋白浓度。取等量蛋白上样,SDS-PAGE 凝胶电泳分离,转移到PVDF 膜,5 g/dl 脱脂奶粉封闭1 h,加入一抗孵育过夜;次日PBS 清洗2 次,加入HRP 二抗孵育1 h,PBS 清洗2 次,ECL 显色,凝胶成像系统拍照,以β-Actin 为内参采用Gel-Pro Analyzer 软件进行灰度分析。
1.3.6 细胞增殖实验:将1×104个细胞接种到96孔板,每孔体积100 μl,24 h 后避光条件下加入10 μl 的CCK-8 试剂,培养0,24,48,72 h 时在450 nm 波长下用酶标仪测定吸光度(A值),绘制细胞增殖曲线,实验重复3 次取平均值。
1.3.7 细胞迁移实验:将转染后细胞胰酶消化制成细胞悬液,1×106/孔接种于6 孔板,37 ℃,5ml/dl CO2培养24 h;次日用枪头垂直于6 孔板划痕,PBS 冲洗2 次,无血清培养基继续培养0 h,48 h 拍照,并测量划痕的宽度,计算细胞迁移愈合率。细胞迁移愈合率 =(迁移宽度/划痕宽度)×100%,实验重复3 次取平均值。
1.4 统计学分析 采用SPSS 22.0 软件进行实验数据分析,数据用均数±标准差(±s)表示,多组间差异比较采用one way ANOVO 分析,组间两两比较采用LSD-t检验;癌组织及癌旁正常组织中差异比较采用配对t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-198 在HCC 组织及细胞中表达 qRTPCR 检测发现,20 例HCC 组织中miR-198 相对表达量(0.354±0.022)明显低于邻近正常组织(4.762±1.135),差异有统计学意义(t=17.365,P<0.001)。与人正常肝细胞LO2 相比,HCC 细胞HepG2(0.589±0.103),Hep3G(0.495±0.086),MHCC97H(0.558±0.056),Huh7(0.362±0.045)中miR-198 相对表达量均呈现不同程度的降低(t=17.159,19.446,17.590,20.315,均P<0.001),其中Huh7 细胞表达量最低,见图1,选取Huh7 细胞用于后续实验。
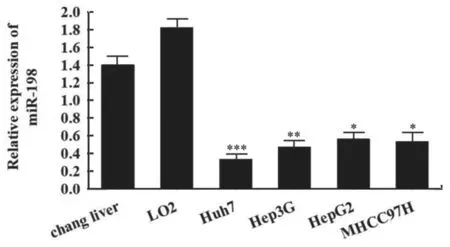
图1 miR-198 在不同HCC 细胞株及人正常肝细胞中的表达水平
2.2 miR-198对HCC细胞增殖和迁移的影响 qRTPCR 检测显示,miR-198 mimics 组细胞中miR-198表达较Blank组和mimics NC组显著升高(t=13.433,13.256,均P<0.001),见图2。表明miR-198 mimics 的转染使Huh7 细胞中miR-198 过表达,转染有效,可用于后续实验。
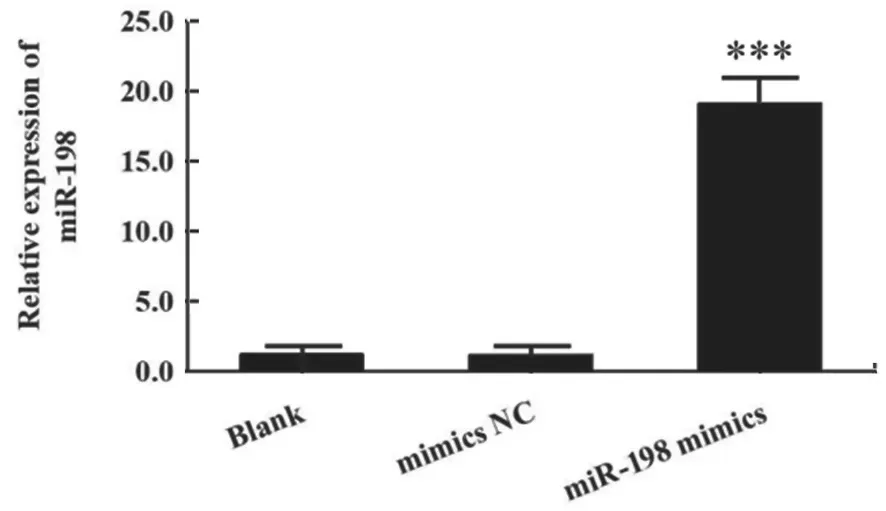
图2 qRT-PCR 检测转染miR-198 mimics 后miR-198 的表达
CCK-8 检测结果显示,与Blank 组和mimics NC 组相比,miR-198 mimics 组的增殖能力明显下降(P<0.05),见图3。划痕实验检测结果显示,与Blank 组和mimics NC 组相比,miR-198mimics组Huh7 细胞迁移能力显著降低(F=52.771,P<0.001),见图4。
2.3 miR-198 对HCC 细胞EMT 相关标志蛋白的影响 见图5。Western blot 检测EMT 相关标志蛋白E-cadherin,N-cadherin,Vimentin 表达水平显示,miR-198 mimics 组细胞中E-cadherin 表达较Blank组和mimics-NC 组显著升高(P<0.01),N-cadherin和Vimentin 表达较Blank 组和mimics-NC 组显著降低(均P<0.01)。
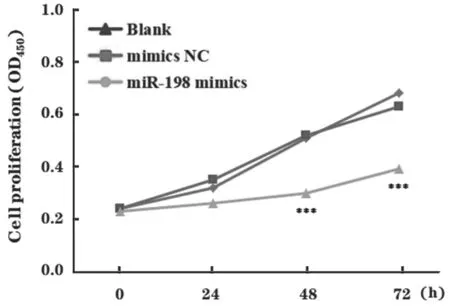
图3 转染miR-198 mimics 对Huh7 细胞体外增殖的影响
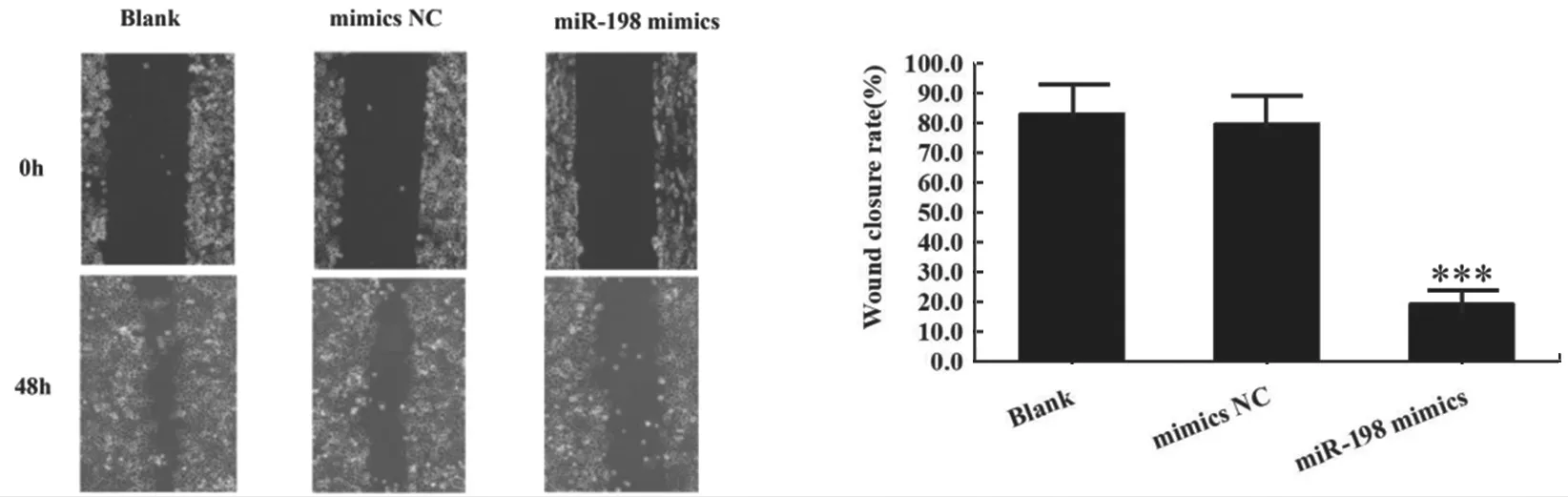
图4 转染miR-198 mimics 对Huh7 细胞体外迁移的影响
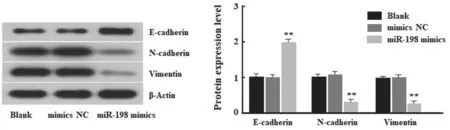
图5 转染miR-198 mimics 对EMT 相关蛋白表达的影响

图6 ZEB2 3’-UTR 与miR-198 的结合位点
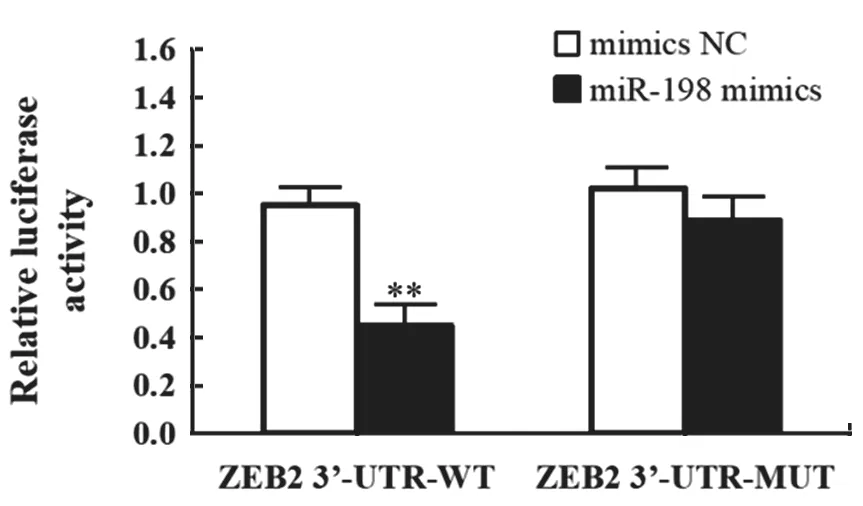
图7 荧光素酶报告基因实验检测Huh7 细胞中荧光素酶活性
2.4 miR-198 与ZEB 靶向结合关系验证 生物信息学软件预测发现,ZEB2 3’-UTR 与miR-198 存在结合位点,见图6。双荧光素酶报告基因实验验证显示,miR-198 mimics 组ZEB2-3’-UTR-WT 质粒荧光强度明显降低(P<0.01),ZEB2-3’-UTRMUT 质粒荧光强度变化无显著影响(P>0.05),见图7。提示ZEB2 是miR-198 的靶基因。进一步检测发现,相比于Blank 组和mimics NC 组,miR-198 mimics 组细胞中ZEB2 mRNA 和ZEB2 蛋白表达水平显著降低(F=17.696,436.609,P<0.05),见图8。表明miR-198 靶向负调控ZEB2 表达。
2.5 HCC 组织中ZEB2 表达及与miR-198 的相关性 qRT-PCR 检测发现,20 例HCC 临床组织中ZEB2 相对表达量(3.621±1.143)明显高于邻近正常组织(0.736±0.030),差异有统计学意义(t=11.284,P<0.001);Sperman 相关性分析显示,HCC 组织中miR-198 和ZEB2 编导呈显著负相关(r=-0.702,P<0.05)。
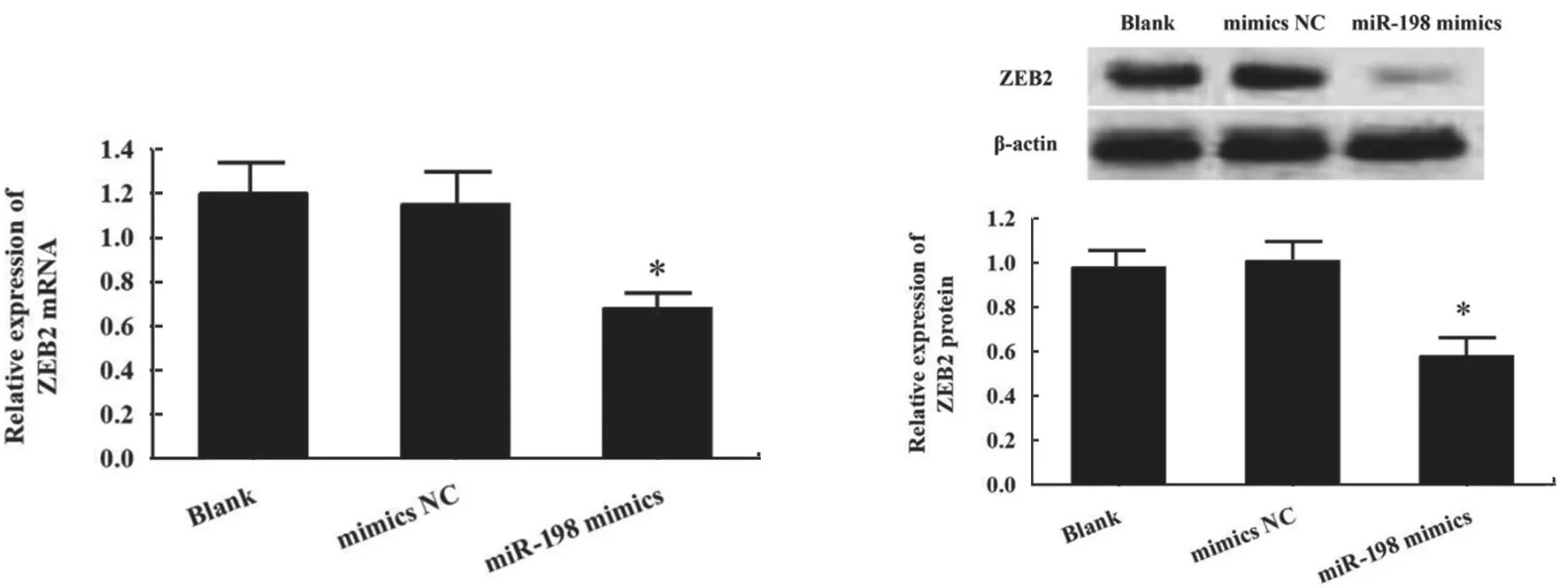
图8 qRT-PCR 和Western blot 检测miR-198 mimics 对ZEB2 mRNA 和蛋白表达的影响
2.6 miR-198 靶向调控ZEB2 抑制HCC 细胞的增殖和迁移 研究转染pcDNA3.1-ZEB2 过表达细胞中ZEB2,经细胞实验检测显示,过表达ZEB2 明显促进了HCC 细胞的增殖和迁移(P<0.05),提示ZEB2 发挥原癌基因属性;在miR-198 mimic组共转然pcDNA3.1-ZEB2 后,细胞增殖和迁移能力较单独转染miR-198 mimics 组显著增加(P<0.05),基本恢复至正常水平,见图9, 图10。提示共转染pcDNA3.1-ZEB2 能够逆转miR-198 mimics 对Huh7 细胞的增殖和迁移的抑制作用,由此可见miR-198 通过靶向负调控ZEB2 表达可抑制Huh7 细胞的增殖和迁移。
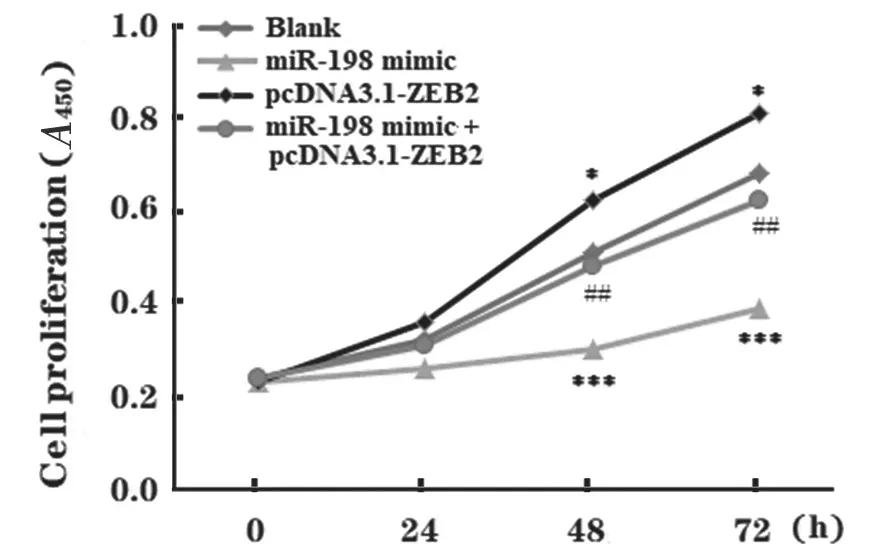
图9 共转染miR-198 mimics 和pcDNA3.1-ZEB2对Huh7 细胞体外增殖的影响
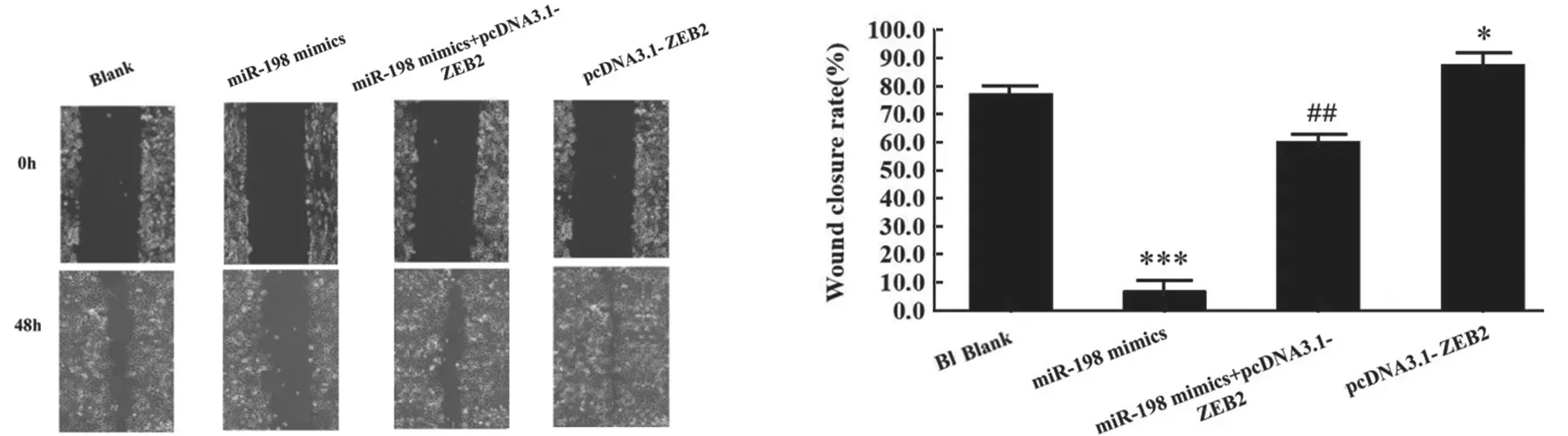
图10 共转染miR-198 mimics 和pcDNA3.1-ZEB2 对Huh7 细胞体外迁移的影响
2.7 miR-198 靶向调控ZEB2 抑制HCC 细胞的EMT过程 Western blot 检测显示,miR-198 mimics+vector 组细胞中E-cadherin 表达较Blank 组显著升高(P<0.01),N-cadherin 和Vimentin 表达较Blank 组则显著降低(P<0.01), 与miR-198 mimics 组无明显差异(P>0.05); 在miR-198 mimics 组细胞中共转染pcDNA3.1-ZEB2 后,E-cadherin 和N-cadherin,Vimentin 表达水平被显著逆转,提示过表达ZEB2 逆转了miR-198 mimics对EMT 的抑制作用,见图11。说明miR-198 靶向调控ZEB2 可能通过EMT 途径参与HCC 细胞的增殖和迁移。
3 讨论
我国HCC 占全球肝癌发生率的50%左右,每年因HCC 导致近60 万人死亡,乙型肝炎病毒感染(HBV)是HCC 的常见病因,其他危险因素常见黄曲霉素B1、过量酒精滥用、药物、血色素沉着病和肥胖等[2,13]。miRNAs 具有高度保守性,不易被降解,调控下游靶基因和下游蛋白表达是miRNAs 调控癌症发展的主要机制。miRNAs 即可作为预测癌症发生发展的指标,也可作为治疗癌症的分子靶点,因此寻找与癌症发生相关的miRNAs及下游靶基因将有助于癌症的诊断和治疗[14-15]。
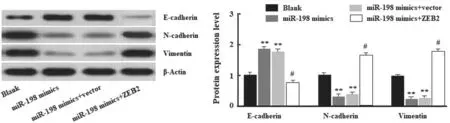
图11 miR-198 靶向ZEB2 抑制HCC 细胞EMT 过程
近年来研究发现,乳腺癌组织细胞中miR-198显著低表达,起抑癌基因的作用[11];非小细胞肺癌(NSCLC)中,miRNA-198 抑制HGF/c-MET 信号通路可克服放疗耐药性,诱导细胞凋亡[16];王磊等[17]研究发现,HCC 组织中miR-198 表达显著降低,与临床病理特征及患者预后密切相关,miR-198 低表达促进肝癌进展,提示其作为一种抑癌基因参与肿瘤的发生发展。而本研究探究发现,HCC 组织及细胞中miR-198 同样显著低表达,其过表达显著抑制了HCC 细胞的增殖和迁移,表明miR-198 在HCC 发生发展过程中扮演着重要角色,故对其进行研究具有积极意义。
研究运用生物信息学网站预测miR-198 靶基因,发现E 盒结合锌指蛋白2(E-box binding zinc finger protein 2,ZEB2)与miR-198 存在结合位点,双荧光素酶实验证实ZEB2 是miR-198 的靶基因,miR-198 靶向负调控ZEB2 表达。ZEB2是由ZFHX1B 基因所编码的蛋白,其CDS 区是3572bp,拥有8 个内含子和9 个外显子。ZEB2是ZEB 家族的一员,ZEB 家族是上皮-间质转化(epithelial-mesenchymal transformation,EMT) 的重要调控因子[18]。发现ZEB2 通过抑制E-cadherin,mac-1 和Mucoprotein,Desmocollin 等相关蛋白转录,能够上调N-cadherin 和Vimentin 蛋白表达,参与EMT 发生过程[19-20]。此外,ZEB2 表达失调与多种类型肿瘤的发生发展密切相关,包括结直肠癌、胃癌、肾癌、胰腺癌、卵巢癌等。而本研究结果显示miR-198 mimics 可以上调E-cadherin 蛋白表达,下调N-cadherin 和Vimentin 蛋白表达,说明miR-198 过表达抑制了HCC 细胞EMT 过程;进一步在miR-198 mimics 细胞中共转染pcDNA3.1-ZEB2,发现ZEB2 过表达逆转了miR-198 mimics 对HCC 细胞增殖、迁移能力和EMT 的抑制过程,提示miR-198 通过靶向下调ZEB2 抑制HCC 细胞的增殖和迁移与其抑制EMT 过程有关。本研究探讨了miR-198 调控HCC 发生发展的作用机制,为其靶向治疗提供了分子靶标及思路,但癌基因参与调控肿瘤发生的作用机制复杂,故miR-198 在HCC 中发挥作用的更深入的信号分子通路还需进一步继续探究。综上所述,HCC 组织和细胞中miR-198 显著低表达,其通过靶向调控ZEB2 抑制细胞上皮-间质转化进而参与HCC 的发生发展。miR-198/ZEB2有望成为HCC 生物治疗的潜在靶点之一。
