丙泊酚对滋养层细胞VEGF/MMP-9通路及细胞活力、侵袭能力的影响*
2022-08-19陈丹丹彭晓红
李 鹏, 陈丹丹, 蔡 琳, 李 思, 彭晓红
武汉市第四医院麻醉科,武汉 430022
滋养层细胞是组成胎盘组织的主要细胞之一,其迁移和侵袭能力类似于肿瘤细胞[1]。滋养细胞正常的增殖、侵袭能力对胎盘血管重塑、胎儿营养物质输送具有重要作用,但其增殖及侵袭能力异常是导致绒毛膜癌、妊娠糖尿病、流产、子痫前期等妊娠期疾病发生的重要原因[2]。滋养层细胞侵袭能力调控机制的研究,对阐明人类多种妊娠疾病的发生发展具有重要意义。基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)可在绒毛膜滋养层细胞入侵和改造螺旋动脉的过程中起重要作用[3],血管内皮生长因子(vascular endothelial growth factor,VEGF)可在滋养层细胞入侵子宫内膜、转化子宫内壁血管过程中发挥作用[4-5],且VEGF及MMP-9也是肿瘤迁移及侵袭的重要调控因子[6]。丙泊酚为肿瘤切除手术时施行全身麻醉的常用麻醉药之一[7],且越来越多研究发现,其可抑制人类肿瘤细胞的侵袭能力[8],但丙泊酚是否也能影响人类滋养层细胞的增殖、侵袭能力还未见报道。本研究利用体外培养的人绒毛外滋养层细胞,从VEGF/MMP-9通路角度探究丙泊酚对滋养层细胞侵袭能力的影响,以期为人类妊娠疾病的治疗提供实验依据。
1 材料与方法
1.1 细胞、主要试剂与仪器
人类绒毛外滋养层细胞株HTR8-SVneo细胞由第四军医大学王晓红教授馈赠。
DMEM/F12培养液(北京百奥莱博科技有限公司,货号:SNM544-SCD);丙泊酚(上海晶抗生物工程有限公司,货号:JKG8628);MTT试剂盒(上海恒斐生物科技有限公司,货号:M1020);BD生物涂层基质侵袭室试剂盒(北京沃比森科技有限公司,货号:BD2025);VEGF、MMP-9、CD34、人类白细胞抗原G(HLA-G)、苹果酸脱氢酶(MDH)、细胞骨架相关蛋白(prefoldin 1)抗体(美国Abcam公司,货号:ab27278,ab76003,ab81289,ab134743,ab181857,ab151708);荧光显微镜(日本奥林巴斯,型号:Olympus BX63)。
1.2 细胞培养及处理
取人类绒毛外滋养层细胞株HTR8-SVneo常规复苏后,用DMEM/F12培养液(含10%胎牛血清)进行常规传代培养。待细胞融合度达60%左右时,取对数期细胞,以1×105个/孔的密度接种于6孔板内,并进行如下处理:①取HTR8-SVneo细胞,分别在培养液中加入终浓度为0、10、25、50、100、200 μmol/L的丙泊酚溶液培养72 h,用MTT法及Western blot法检测不同浓度丙泊酚干预下细胞活力及MMP-9、VEGF蛋白表达;②取HTR8-SVneo细胞,加入终浓度为100 μmol/L丙泊酚溶液,分别检测细胞在培养0、8、12、24、72 h时的细胞活力及MMP-9、VEGF蛋白表达水平;③取HTR8-SVneo细胞转染含VEGF过表达序列的腺病毒载体(ad-VEGF)及不含VEGF过表达序列的腺病毒空载体(ad-NC),并设置对照组、丙泊酚组、ad-VEGF组、ad-NC组、丙泊酚+ad-VEGF组。对照组在正常条件下培养24 h;丙泊酚组在对照组基础上加入终浓度为100 μmol/L丙泊酚溶液干预培养;ad-VEGF组及ad-NC组转染ad-VEGF或对照腺病毒空载体6 h后,在正常条件下培养24 h;丙泊酚+ad-VEGF组在丙泊酚组基础上转染ad-VEGF;各组均培养24 h后,检测细胞活力,侵袭能力,HLA-G、MDH、prefoldin 1蛋白表达及MMP-9、VEGF、CD34阳性表达水平。
1.3 MTT法检测细胞活力
取1.2项中处理后的各组细胞,每孔加入浓度为5 mg /mL的MTT溶液20 μL,培养箱中放置4 h后,弃上清,每孔加入二甲基亚砜(DMSO)溶液150 μL摇床振荡10 min后,在490 nm波长下,用酶标仪读取各组吸光度(A)值,根据公式,细胞存活率=(对照组A值-给药组A值)/对照组A值×100%,计算出各组细胞存活率,存活率越大,预示细胞活力越强。
1.4 Western blot法检测细胞MMP-9、VEGF、HLA-G、MDH、prefoldin 1蛋白表达
收集各组细胞,裂解并抽提蛋白,BCA法测蛋白浓度后,取100 μg蛋白样品行电泳及转膜,加入一抗[MMP-9、VEGF、HLA-G、MDH、prefoldin 1抗体(1∶500),内参GAPDH(1∶800)],4℃孵育过夜,辣根过氧化物酶标记的IgG二抗(1∶2000)室温孵育1.5 h,ELC显影曝光,化学发光成像分析系统拍照并分析灰度值。每组实验重复3次。
1.5 改良版基底膜基质Boyden室检测细胞侵袭能力
按说明书方法制备溶胶,4℃过夜,冰台上用磷酸缓冲液∶胶(1∶6)制备稀Matrigel胶,每孔加入40 μL Matrigel胶工作液浸润,37℃过夜后。上室及下室分别加入600 μL及100 μL培养液平衡12 h。取1.2项③方法下的各组细胞,重悬成浓度为1×108个/mL的细胞悬液,在基质包被的滤器中接种含胎牛血清的细胞悬液,室温孵育24 h后,取出小室,清洗膜,固定,染色,记录已经通过滤器的细胞数目,细胞数目越多代表细胞侵袭能力越强。实验重复3次。
1.6 免疫荧光检测细胞MMP-9、VEGF阳性表达
取1.2项③方法下的各组细胞,弃去培养液,4%多聚甲醛固定15 min,0.1%曲拉通透化、5%胎牛血清封闭后,加入一抗(MMP-9、VEGF,1∶200)室温孵育2 h,加入荧光二抗室温孵育1 h,DAPI复染后,防猝灭液封片,于荧光显微镜下观察,拍照并评估荧光强度。
1.7 免疫细胞化学法检测细胞CD34阳性表达水平
取1.2项③方法下的各组细胞,弃去培养液,4%多聚甲醛固定后,PBS漂洗3次,加入3%过氧化氢,PBS再漂洗3次,加入山羊血清封闭10 min,加入一抗(CD34,1∶300)4℃孵育过夜,加入二抗(1∶500)室温孵育1.5 h,加入辣根酶标记链卵白素工作液室温孵育20 min,DAB显色、中性树脂封片,光镜下观察拍照,用Image Pro Plus 5.0图像分析系统分析单位面积内细胞阳性染色吸光度值。
1.8 统计学分析

2 结果
2.1 不同浓度丙泊酚对细胞活力及VEGF、MMP-9蛋白表达的影响
丙泊酚处理72 h,随着丙泊酚浓度(0~100 μmol/L)升高,细胞活力呈逐渐下降趋势,细胞VEGF、MMP-9蛋白表达逐渐下降(均P<0.05),并在100~200 μmol/L时,细胞活力及VEGF、MMP-9蛋白表达趋于平衡。见图1、图2、表1。

与0 μmol/L组比较,*P<0.05图1 不同浓度丙泊酚对HTR8-SVneo细胞存活率的影响(MTT检测)Fig.1 Effect of different concentrations of propofol on the survival rate of HTR8-SVneo cells(MTT test)

图2 不同浓度丙泊酚处理对HTR8-SVneo细胞VEGF、MMP-9蛋白表达的影响(Western blot法)Fig.2 Effect of different concentrations of propofol on VEGF and MMP-9 protein expression in HTR8-SVneo cells(Western blot)

表1 不同浓度丙泊酚处理条件下HTR8-SVneo细胞VEGF、MMP-9蛋白表达的比较Table 1 Comparison of VEGF and MMP-9 protein expression in HTR8-SVneo cells treated with propofol at different concentrations of
2.2 丙泊酚处理不同时间对细胞活力及VEGF、MMP-9蛋白表达的影响
100 μmol/L丙泊酚处理不同时间(0、8、12、24、72 h)后,细胞随着丙泊酚处理时间延长,细胞活力呈逐渐下降趋势,细胞VEGF、MMP-9蛋白表达逐渐下降(均P<0.05),并在24~72 h时,细胞活力及VEGF、MMP-9蛋白表达趋于平衡。见图3、图4、表2。
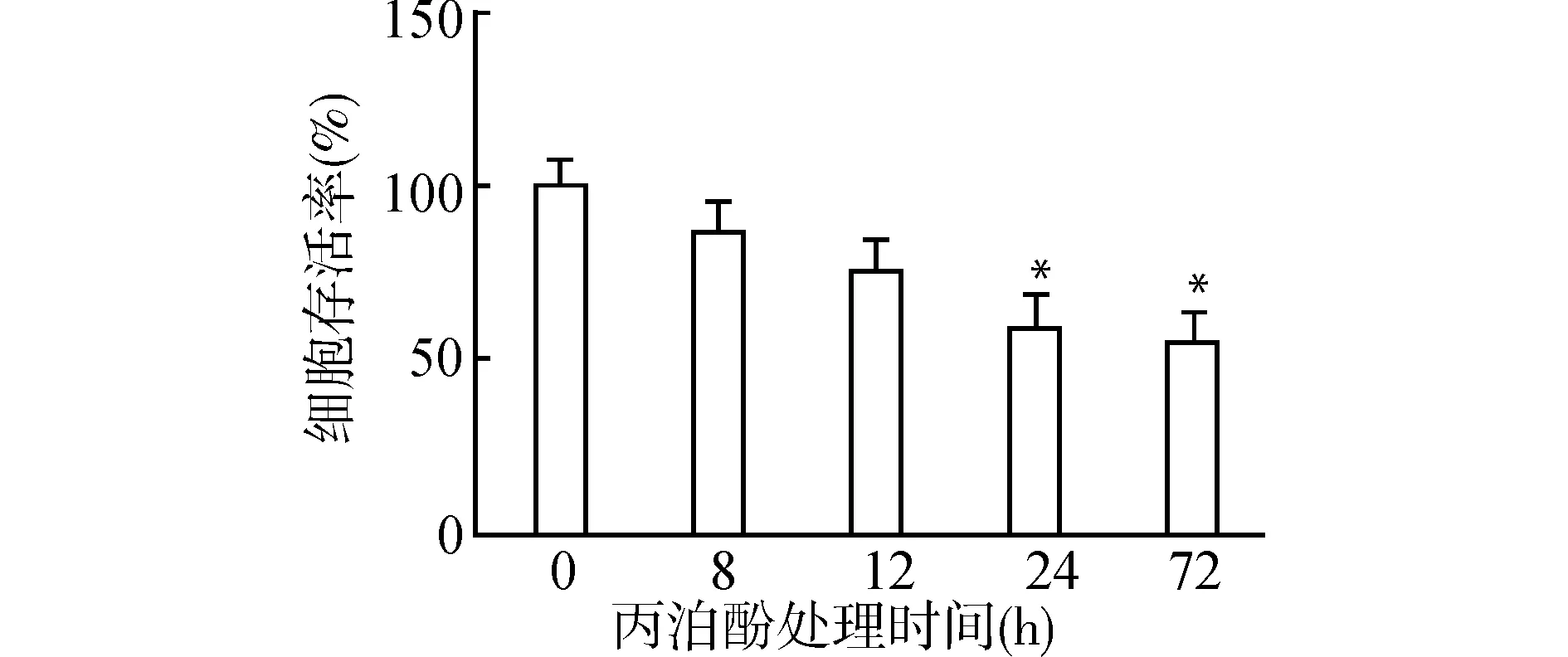
与0 h组比较,*P<0.05图3 丙泊酚不同处理时间对HTR8-SVneo细胞存活率的影响(MTT检测)Fig.3 Effect of propofol treatment for different time durations on the survival rate of HTR8-SVneo cells(MTT test)

图4 丙泊酚不同处理时间对HTR8-SVneo细胞VEGF、MMP-9蛋白表达的影响(Western blot法)Fig.4 Effect of propofol treatment for different time durations on VEGF and MMP-9 protein expression in HTR8-SVneo cells(Western blot)

表2 丙泊酚处理不同时间后HTR8-SVneo细胞VEGF、MMP-9蛋白表达的比较Table 2 Comparison of VEGF and MMP-9 protein expression in HTR8-SVneo cells treated with propofol
2.3 丙泊酚处理或过表达VEGF对细胞活力的影响
与对照组[(100.00±0.00)%]相比,丙泊酚组[(53.69±5.05)%]细胞活力降低(P<0.05);ad-VEGF组[(146.79±10.05)%]细胞活力升高(P<0.05)。与丙泊酚组相比,丙泊酚+ad-VEGF组[(100.66±5.11)%]细胞活力升高(P<0.05)。ad-NC组[(101.59±5.12)%]及丙泊酚+ad-VEGF组,与对照组比较差异无统计学意义(均P>0.05)。
2.4 丙泊酚处理或过表达VEGF对细胞侵袭能力的影响
与对照组(223.35±10.06)相比,丙泊酚组(151.55±10.63)细胞侵袭数目减少,侵袭能力降低(P<0.05);ad-VEGF组(362.53±10.99)细胞侵袭能力升高(P<0.05)。与丙泊酚组相比,丙泊酚+ad-VEGF组(247.07±12.08)细胞侵袭能力升高(P<0.05)。ad-NC组(221.06±10.58)与对照组比较差异无统计学意义(P>0.05),见图5。
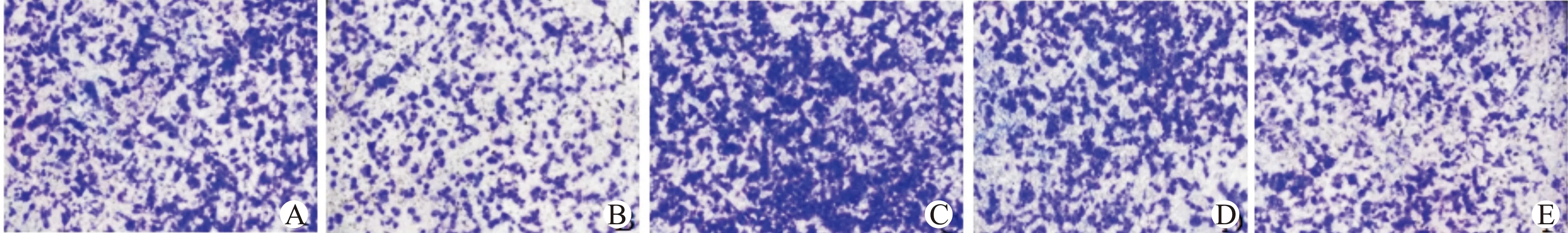
A:对照组;B:丙泊酚组;C:ad-VEGF组;D:丙泊酚+ad-VEGF组;E:ad-NC组图5 各组细胞侵袭能力检测(×40)Fig.5 Cell invasion in each group(×40)
2.5 丙泊酚处理或过表达VEGF对细胞VEGF及MMP-9阳性表达的影响
免疫荧光结果显示,VEGF及MMP-9在对照组HTR8-SVneo滋养细胞胞质中呈强阳性表达。与对照组比较,丙泊酚组VEGF及MMP-9阳性表达减弱(均P<0.05);ad-VEGF组细胞VEGF及MMP-9阳性表达增强(均P<0.05)。与丙泊酚组相比,丙泊酚+ad-VEGF组细胞VEGF及MMP-9阳性表达增强(均P<0.05)。ad-NC组及丙泊酚+ad-VEGF组与对照组比较差异无统计学意义(均P>0.05),见图6、表3。

图6 各组细胞VEGF及MMP-9免疫荧光染色图(×200)Fig.6 Immunofluorescence staining of VEGF and MMP-9 in cells in each group(×200)

表3 细胞VEGF及MMP-9阳性表达的比较Table 3 Comparison of VEGF and MMP-9 expression in
2.6 丙泊酚处理或过表达VEGF对细胞CD34阳性表达的影响
CD34为微血管密度升高的标志蛋白,CD34可在对照组细胞胞质中呈强阳性表达。与对照组(0.99±0.05)相比,丙泊酚组细胞CD34阳性表达(0.35±0.03)减弱(P<0.05);ad-VEGF组细胞CD34阳性表达(1.68±0.13)增强(P<0.05)。与丙泊酚组相比,丙泊酚+ad-VEGF组细胞CD34阳性表达(0.92±0.05)增强(P<0.05)。ad-NC组(0.93±0.06)及丙泊酚+ad-VEGF组与对照组比较差异无统计学意义(均P>0.05),见图7。

A:对照组;B:丙泊酚组;C:ad-VEGF组;D:丙泊酚+ad-VEGF组;E:ad-NC组图7 各组细胞CD34免疫细胞化学染色图(×400)Fig.7 Immunocytochemical staining of CD34 cells in each group(×400)
2.7 丙泊酚处理或过表达VEGF对细胞HLA-G、MDH、prefoldin 1蛋白表达的影响
与对照组比较,丙泊酚组细胞HLA-G、MDH、prefoldin 1蛋白表达降低(均P<0.05);ad-VEGF组细胞HLA-G、MDH、prefoldin 1蛋白表达升高(均P<0.05)。与丙泊酚组相比,丙泊酚+ad-VEGF组细胞HLA-G、MDH、prefoldin 1蛋白表达升高(均P<0.05)。ad-NC组及丙泊酚+ad-VEGF组,与对照组比较差异无统计学意义(均P>0.05),见图8、表4。

A:对照组;B:丙泊酚组;C:ad-VEGF组;D:丙泊酚+ad-VEGF组;E:ad-NC组图8 各组细胞HLA-G、MDH、prefoldin 1蛋白表达(Western blot)Fig.8 HLA-G,MDH and prefoldin 1 protein expression in cells in each group(Western blot)

表4 各组细胞HLA-G、MDH、prefoldin 1蛋白表达的比较Table 4 Comparison of HLA-G,MDH and prefoldin 1 protein expression in cells in each group
3 讨论
正常情况下,绒毛外滋养层细胞在囊胚着床后开始分化,迁移、侵袭至子宫脱膜层及基层血管,启动螺旋动脉重塑,建立母胎循环,维持妊娠进行[9]。Heidari等[10]发现,绒毛外滋养层细胞侵入过度可引起绒毛膜癌、妊娠糖尿病等疾病的发生;Ding等[11]发现绒毛外滋养层细胞增殖能力降低、凋亡增加、侵袭能力不足,可引起胎盘功能障碍,导致流产、子痫前期等妊娠期疾病的发生,证实滋养层细胞增殖和侵袭过深或者过浅均可引起各种妊娠疾病的发生。故探究滋养层细胞增殖、侵袭的调控机制,对阐明多种妊娠疾病的发生发展机制具有重要意义。
丙泊酚为子痫前期剖宫术[12]、人工流产术[13]等妊娠疾病手术过程中的常用麻醉剂,大量研究证实,其对肿瘤增殖、侵袭能力有抑制作用[14-15],但丙泊酚是否能影响绒毛外滋养层细胞的增殖、侵袭能力,并影响妊娠疾病的发生发展,还未见报道。本研究发现,在0~100 μmol/L浓度的丙泊酚培养条件下,绒毛外滋养层细胞HTR8-SVneo增殖能力、与侵袭相关蛋白VEGF及MMP-9表达均呈剂量及时间依赖性降低,提示丙泊酚也可抑制绒毛外滋养层细胞增殖、侵袭能力。
VEGF及MMP-9为绒毛外滋养层细胞入侵子宫内壁过程中的重要调控因子。滋养层细胞中的HLA-G可促进MMP-9降解细胞外基质,调控与糖代谢有关的酶——MDH及与细胞骨架运动有关蛋白prefoldin 1的表达,来促进滋养层细胞的入侵、粘附及运动[16]。Zhong等[17]在子痫前期及胎儿宫内生长受限等妊娠疾病的胎盘组织中检测到MMP-9表达的降低。黑色素瘤转移抑制基因编码的肽类激素,能刺激胞外调节激酶磷酸化,抑制滋养层细胞MMP及VEGF表达来抑制滋养层细胞向子宫内壁侵袭及植入[18]。Pan等[19]发现,胎盘中VEGF表达降低可引起滋养层细胞侵入缺陷、胎盘浅表着床、胎盘绒毛缺血低氧、胎盘血管重塑障碍,导致流产的发生。本研究发现,用丙泊酚处理后,HTR8-SVneo细胞胞质中VEGF及MMP-9阳性表达及微血管密度生成标志蛋白CD34表达降低的同时,细胞增殖、侵袭能力显著降低,与侵袭功能相关的蛋白HLA-G、MDH、prefoldin 1表达也明显降低。这与Xu等[20]发现的丙泊酚通过抑制VEGF/MMP-9通路蛋白表达来抑制食管癌的增殖及侵袭相一致。本研究进一步发现过表达VEGF可明显促进绒毛外滋养层细胞HTR8-SVneo增殖及侵袭能力,逆转丙泊酚对绒毛外滋养层细胞增殖及侵袭的抑制作用。
综上所述,丙泊酚可能通过抑制VEGF/MMP-9通路蛋白表达,抑制滋养层细胞增殖活力及侵袭能力。这可能为妊娠糖尿病、绒毛膜癌等因滋养层细胞过度侵入引起的妊娠疾病的治疗提供一定依据。但滋养层细胞增殖活力及侵袭能力的调控机制复杂,体内与体外研究差异可能较大,丙泊酚在多种妊娠疾病治疗中的作用及机制,还需进一步探究。
