牙龈卟啉单胞菌通过xCT受体调控食管癌细胞谷氨酰胺代谢*
2022-08-19张秀森刘书培王海瑞
张秀森, 刘书培, 王海瑞, 原 翔
河南科技大学临床医学院,河南科技大学第一附属医院,河南科技大学肿瘤研究所,河南省肿瘤表观遗传重点实验室,洛阳 471003
食管癌是常见的消化道恶性肿瘤之一[1],我国是食管鳞癌的高发国家。据一项不完全统计数据显示,2018年全球食管癌新发病例数达57.2万,其中5年生存率仅有30%左右[2]。牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis,Pg)是目前公认的慢性牙周疾病的主要致病菌,它能侵入宿主细胞并逃避宿主的防御机制[3],促进口腔鳞癌的发生发展。由于食管与口腔解剖位置临近,本团队前期研究首次证实,Pg在食管癌患者肿瘤组织中检出率高达42%[4],且Pg阳性的食管癌患者血清中抗Pg抗体IgG和IgA的表达也高于食管炎患者和健康对照组[5]。研究表明,在食管癌中Pg感染与肿瘤驱动基因过度激活及免疫检查点信号异常表达密切相关[6],Pg还可通过TGF-β依赖的Smad/YAP/TAZ信号通路促进食管鳞状细胞癌的进展[7]。此外,Pg携带的主要致病毒力因子,如鞭毛蛋白(fimbriae,FimA)在粘附、促进病原体入侵和感染中发挥着关键作用[8]。综上可见,Pg和食管癌的发生密切相关,对其发病机制的深入探讨可为食管癌的病因学研究和防治策略的制定提供更多科学依据。
xCT是溶质运载蛋白7家族成员11(solute cartier family 7 member 11,SLC7A11),是溶质载体家族负责细胞膜上谷氨酸/胱氨酸逆向转运的功能性基团[9],可特异性地将胞外的胱氨酸和谷氨酸转运至胞内,参与抗氧化剂谷胱甘肽(glutathione,GSH)的合成,进而维持细胞内外氧化还原平衡[10-11]。肿瘤细胞新陈代谢的改变,对其发生发展和治疗耐药性至关重要。研究表明,xCT在谷氨酰胺代谢中发挥了关键作用[12],可促进肿瘤细胞对胞外谷氨酰胺的转运,从而促进肿瘤[13-16]的进展,靶向xCT可诱导细胞凋亡[17]。然而,对于病原体如何通过xCT促进食管癌进展尚未见报道。本研究中,我们结合测序数据及应用分子生物学和细胞生物学手段,探讨xCT作为Pg进入细胞的宿主因子,对其发病机制的深入探索可为食管癌的病因学研究和防治策略的制定提供更多科学依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞及质粒 人食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)细胞株来自河南省肿瘤表观遗传重点实验室。人胚肾HEK293T细胞株来自BNCC公司。质粒均由广州易锦生物技术有限公司和美国GeneCopoeia公司联合开发提供。
1.1.2 实验动物 普通C57小鼠为雄性,7~8周龄,购买于河南斯克贝斯生物科技股份有限公司。xCT基因敲除小鼠由新乡医科大学免疫系统遗传调控基因实验室(GRIS)在国家111工程项目(D20036)支持下构建。实验小鼠饲养于河南科技大学第一附属医院SPF级实验动物中心,所有动物实验根据机构动物护理和使用委员会批准的方案进行。
1.1.3 主要试剂 人类全基因组敲除文库(Human Genome-scale CRISPR Knock-Out v2.0 library,GeCKOv2 libraries)质粒和慢病毒包装购于美国Genewiz公司,NanoBiT©PPI MCS Starter Systems(N2014)购于美国Promega公司。FuGENE©HD转染试剂(E2311)购自美国Promega公司,xCT一抗(PA1-16893),Flag抗体(MA1-91878)和Co-IP试剂盒(88804)购自美国Thermofisher公司。HA抗体(ab9108),谷氨酰胺合成酶1(GLS1)抗体(ab156876),还原型/氧化型谷胱甘肽(GSH/GSSG)试剂盒(ab138881)购自美国Abcam公司。Pg抗体(ANT0085)购于意大利Diatheva公司。Pg特异性探针(16S rRNA特异探针)与RNAscope©试剂盒(322360)购自美国ACD公司。引物定制设计由上海生工生物工程股份有限公司提供。
1.1.4 主要仪器设备 Nikon TE2000倒置荧光显微镜、Promega Glomax 96微孔板发光检测仪、Leica TP1020全自动组织脱水机、Bio-rad凝胶成像分析仪、ZEISS激光共聚焦显微镜。
1.2 实验方法
1.2.1 细胞培养与转染 将KYSE30、KYSE140、KYSE150细胞接种于含1%双抗和10%胎牛血清的RPMI 1640培养液中,HEK293T细胞接种于含1%双抗和10%胎牛血清的DMEM高糖培养液中,在5% CO2、37 ℃的培养箱中培养,每隔1~2 d换液、传代。胰酶消化,收集对数生长期的细胞进行后续实验,实验均重复3次。转染前1 d,将细胞接种于无抗生素含10%胎牛血清的RPMI 1640培养液中,按照密度为1×106个细胞/孔接种于6孔板中。取对数生长期细胞,使用FuGENE©HD细胞转染,10 h后更换培养液。转染24 h后,对细胞进行相应处理,收集细胞进行下一步分析。
1.2.2 GeCKOv2 libraries B库筛选细胞 将细胞接种于6孔板,24 h长到70%汇合时,将包裹慢病毒的B库质粒以MOI=10,与适当比例的Lv-assistance转染试剂混合,感染细胞。24 h后,更换培养液并加入嘌呤霉素,筛选获得稳定敲除的细胞株。对稳定敲除细胞株感染Pg(MOI=10),培养一段时间后,选取存活的细胞进行NGS测序并筛选出差异基因。
1.2.3 细胞活力测定实验 将对数生长期的KYSE150细胞进行细胞计数,稀释为5×103/mL接种于96孔板,添加100 μL培养液,1 d后感染包裹慢病毒的sgRNA,并设对照组,培养1 d后换液并加入嘌呤霉素筛选,2 d后加入MTS试剂,按照试剂盒使用说明书用酶标仪检测吸光度(A)值,根据A值计算每组细胞存活率并对结果进行统计学分析。
1.2.4 免疫共沉淀(co-immunoprecipitation,Co-IP) 收集实验所需细胞加入适量细胞IP裂解缓冲液,4 ℃下裂解30 min,12000 r/min离心30 min后取上清;取少量裂解液以备Western blot分析,剩余裂解液将1 μg相应的抗体和10~50 μL protein A/G-beads加入到细胞裂解液,4 ℃缓慢摇晃孵育过夜;免疫沉淀反应后,在4 ℃下以3000 r/min速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1 mL裂解缓冲液洗3~4次;最后加入15 μL的2×SDS加样缓冲液,沸水煮10 min;Western blot检测分析。
1.2.5 NanoBiT©活细胞实时蛋白相互作用实验方法参见文献[18]。将HEK293T细胞铺到白色96孔板中,在转染当天达到60%~80%的融合度。24 h后根据分组使用FuGENE©HD转染试剂转染构建好的N端或C端带有SmBiT和LgBiT的质粒。转染后30 h,以1∶20的稀释倍数,将NanoBiT©活细胞底物稀释加入细胞中。添加后2 h之内在Glomax 96微孔板发光检测仪上检测发光强度。
1.2.6 Western blot检测 收集相应细胞,加入配置好的裂解液,冰上裂解刮取,4 ℃离心,收集上清,提取蛋白质。采用BCA法测定蛋白含量。用浓度为10%的十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳,转膜后封闭1 h。加入对应一抗,4 ℃下孵育过夜。以含吐温的Tris缓冲液(Tris buffered saline Tween,TBST)清洗4次,加入二抗,室温孵育2 h。以TBST漂洗5次,化学发光液显影,进行图像分析。
1.2.7 xCT基因敲除小鼠的培育 采用CRISPR/Cas9技术建立C57基因敲除小鼠。该技术为通过设计针对目的基因的guide RNA引导Cas9核酸酶对插入位置的基因组进行修饰,从而造成该基因修饰区域片段缺失,将目的位点的目的片段敲除。挑选xCT的外显子exon1作为敲除位点,设计针对该外显子的3条sgRNA,通过胚胎显微注射法引导Cas9内切酶裂解xCT基因。通过非同源末端链接修复断裂,删除xCT的外显子exon1,使该基因的mRNA缺失碱基,产生移码突变,得到F0代小鼠。通过提取鼠尾DNA行PCR检测(图1),将F0代阳性小鼠自交得到F1代小鼠,再次PCR鉴定,培育目的基因缺失型纯合子小鼠至6~8周龄用于实验。
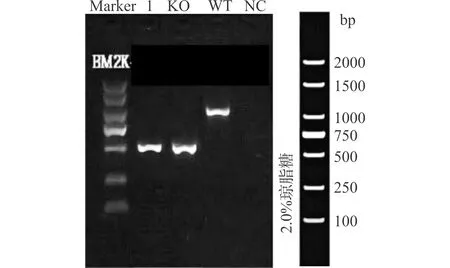
Line 1为xCT敲除阳性对照,KO:基因敲除;WT:野生型;NC:阴性对照图1 小鼠基因型PCR检测结果Fig.1 The PCR genotype results of mice
1.2.8 RNAscope©检测方法 参见文献[19],将Pg灌胃后的小鼠安乐死后进行食管剥离,将分离的食管组织进行石蜡包埋,以2 μm的厚度进行连续切片;60 ℃烤片后二甲苯脱蜡。靶标修复试剂及RNAscope©双氧水处理,加入RNAscope©蛋白酶Plus处理,进行RNAscope©显色检测(含Pg特异性探针[20]杂交)并扫描拍照。
1.2.9 还原型/氧化型谷胱甘肽(GSH/GSSG)检测 收集107~108个细胞,按GSH/GSSG试剂盒说明书操作,最后用荧光微板阅读器监测Ex/Em=490/520 nm处的荧光,并进行分析。
1.2.10 qRT-PCR检测 用Trizol提取小鼠食管组织,和ESCC对应分组细胞的总RNA,反转录得到cDNA,以cDNA为模板,SYBR Green探针进行实时荧光定量PCR,反应体系详见诺唯赞AceQ qPCR SYBR Green Master Mix说明书(Q111-03)。特定引物序列如下:小鼠GLS1上游引物:5′-CA-CTCAAATCTACAGGATTGCG-3′,下游引物:5′-CCAGACTGCTTTTTAGCACTTT-3′;人GLS1上游引物:5′-CACTCAAATCTACAGGATTGCG-3′,下游引物:5′-CCAGACTGCTTTTTAGCAC-TTT-3′。
1.3 统计学方法
应用Graphpad7软件作图,SPSS 26.0软件进行统计学分析。实验数据以均数±标准差表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析。检验水准α=0.05。
2 结果
2.1 全基因组CRISPR筛选识别Pg感染所需的宿主受体分子
在食管鳞癌细胞KYSE150中用GeCKOv2 libraries B库[21]转染筛选,细胞在全基因组敲除后感染Pg能够选择性生存(图2A)。通过NGS测序来识别存活的细胞群中存在的单导体RNA(sgRNA)。评估个体sgRNA丰度变化的显著性,计算相同基因在感染Pg前后样本中的reads数差值,对差值进行log转换,以避免差数范围过大。log2值为正即显示该基因为阳性筛选基因,是细胞在特定条件下生存的必需基因。根据富集分析结果,筛选得到差异最显著的5个基因,分别是xCT、ANPEP、ACE2、PI3KC3和TMEM41B(图2B),其中xCT参与调控谷氨酰胺代谢,将其敲除可能影响肿瘤细胞的增殖。我们将上述关键的5个基因进行进一步验证,细胞活力百分比结果显示(图2C),与对照组比较,xCT转染xCT sgRNA(P<0.0001)、ANPEP sgRNA(P=0.0012)、ACE2 sgRNA(P=0.0009)、PI3KC3 sgRNA(P=0.0043)、TMEM41B sgRNA(P=0.0011)的细胞活力降低,差异有统计学意义,说明敲除这些基因均可显著抑制细胞增殖活性。其中,转染xCT sgRNA组差异最为显著,由此推测,xCT可能作为食管癌细胞系中Pg感染的一个重要的宿主因子。
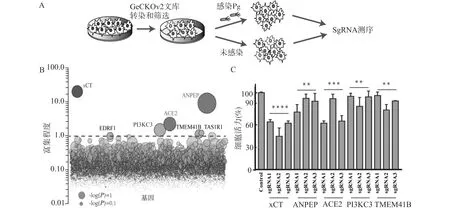
A:筛选流程图;B:富集基因分布图(每个圆圈代表一个基因,其大小对应于富集的显著性;y轴表示与对照组比较,感染Pg样本中sgRNA丰度,每个基因的4个sgRNA丰度的平均变化);C:细胞活力结果统计图,与对照组比较,**P<0.01,***P<0.001,****P<0.0001图2 全基因组CRISPR筛选识别Pg感染所需的宿主受体分子Fig.2 Genome-wide CRISPR screening to identify host receptor molecules required for Pg infection
2.2 受体分子xCT可与鞭毛蛋白FimA互作
2.2.1 Co-IP实验证实xCT和FimA蛋白可相互结合 在HEK293T细胞中,用编码HA标记的FimA cDNA的质粒和编码Flag标记的xCT cDNA的质粒转染,分别使用HA和Flag抗体与磁珠结合后,将蛋白与磁珠进行4 ℃过夜孵育,得到免疫沉淀复合物,用Western blot检测免疫沉淀复合物中HA和Flag即FimA和xCT的表达情况,免疫沉淀结果显示:外源性FimA能够与外源性xCT形成复合物,而与空白对照未结合(图3),表明FimA与xCT能够在细胞内相互结合。
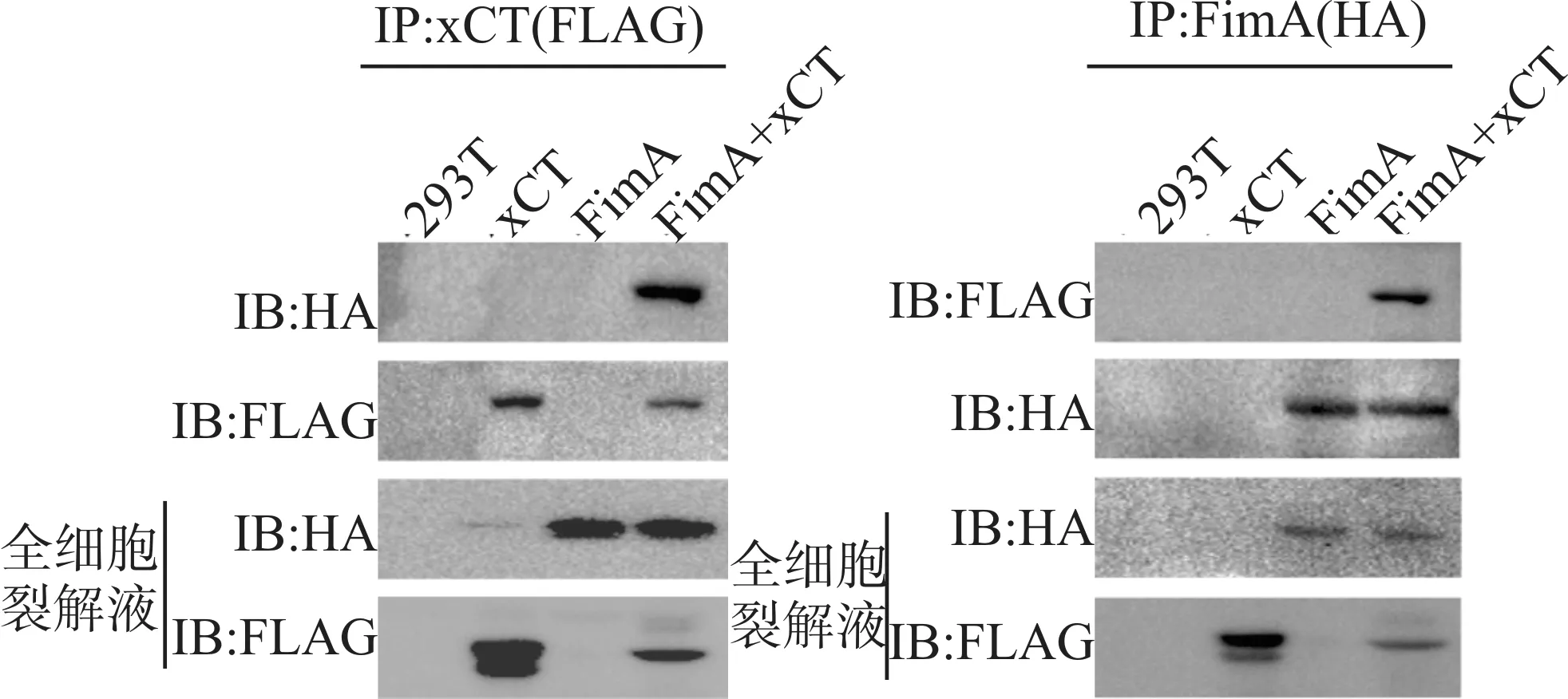
图3 Co-IP实验表明xCT和FimA蛋白相互结合Fig.3 Co-IP experiment shows the binding interaction between xCT and FimA
2.2.2 NanoBiT©实验验证xCT与FimA蛋白的互作 使用常规基因重组技术构建编码FimA基因并N端或C端带有LgBiT或SmBiT标签的质粒和编码xCT基因并N端或C端带有LgBiT或SmBiT标签的质粒,将带有LgBiT或SmBiT标签的xCT或FimA质粒共转染HEK293T细胞,根据不同时间检测底物发光值,NanoBiT©实验结果显示(图4A),在20 min左右,xCT与FimA结合能力最强,根据120 min内的荧光强度值进行统计,结果显示(图4B),SmBiT-FimA和xCT-LgBiT质粒的结合后相对荧光单位(relative light unit,RLU)为(133.00 ± 2.08),阴性对照RLU为(46.52 ± 0.64)(P<0.01),差异具有统计学意义,说明FimA蛋白和xCT可发生互作。
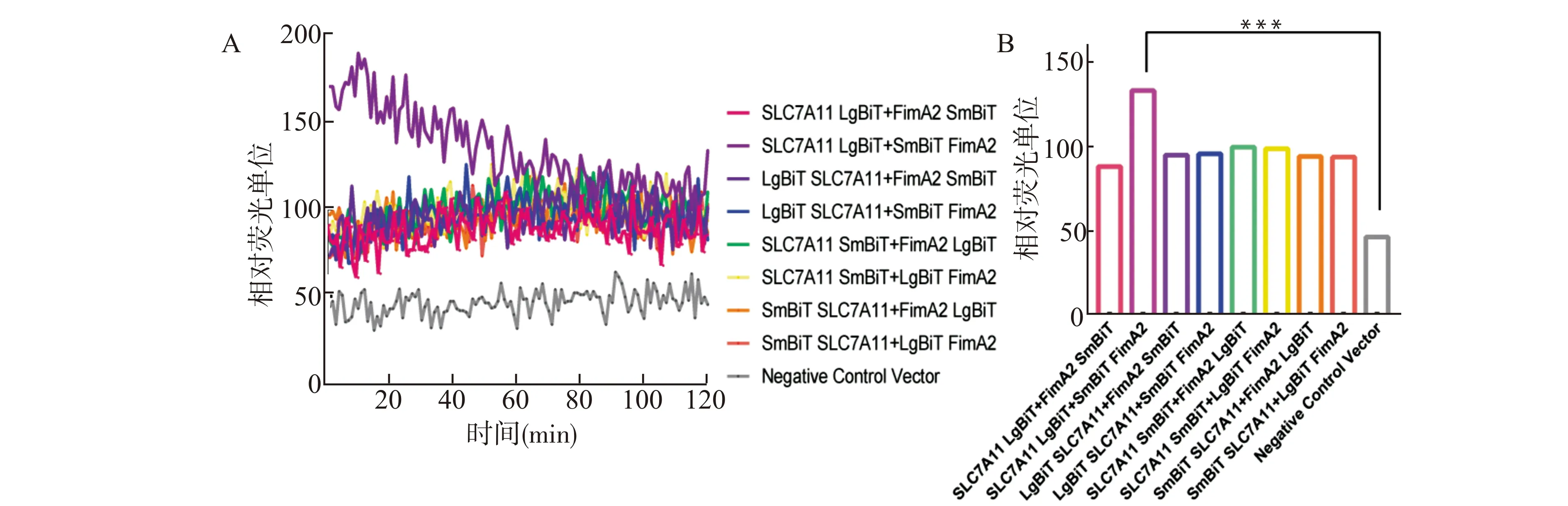
A:不同分组随时间变化的荧光值;B:相应分组120 min内平均荧光值统计图,与阴性对照组比较,***P<0.001图4 NanoBiT©活细胞实时蛋白互作实验证明xCT与FimA互作Fig.4 NanoBiT© cell real-time protein interaction experiment proves the interaction between xCT and FimA
2.2.3 免疫细胞荧光证明xCT与FimA互作 将感染Pg后的食管癌细胞固定,分别进行用FimA一抗与AF488绿色荧光二抗染色,用xCT一抗与AF555红色荧光二抗染色,FimA一抗与AF488绿色荧光二抗及xCT一抗与AF555红色荧光二抗同时染色,进行共聚焦成像,结果显示,当未感染Pg时,仅显示红色荧光,当感染Pg后,FimA被AF488绿色荧光标记,结合红色荧光的xCT和结合绿色荧光的FimA可以出现共定位,两者可以发生互作(图5)。
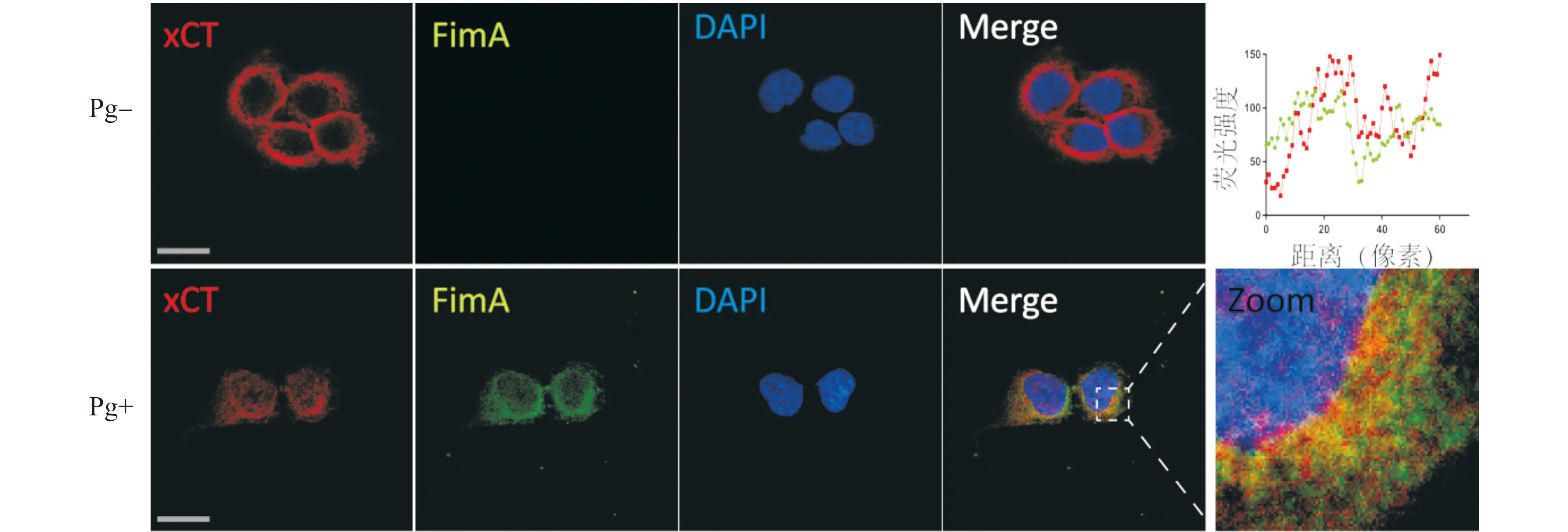
图5 免疫荧光证明xCT与FimA互作(标尺=20 μm)Fig.5 Immune fluorescence proves interaction between xCT and FimA(Scale bar=20 μm)
2.3 xCT -/-小鼠抑制Pg在其食管鳞状上皮细胞的定殖
在小鼠状态稳定后第1~2周喂饲含抗生素(0.2 g/L氨苄青霉素,新霉素和甲硝唑以及0.1 g/L万古霉素)的饮用水,用于清除小鼠自身携带的细菌。对照组为6只野生型(wild type,WT)小鼠正常饲养(未感染Pg),对另一组WT小鼠及基因敲除(knockout,KO)小鼠(各6只),每天进行口腔灌注Pg(1×108/mL浓度的Pg灌注0.1 mL),持续4周,取其食管进行脱水及石蜡包埋,运用RNAscope©检测Pg进入其食管鳞状上皮细胞情况(图6A),以RNAscope©阳性区域占整个小鼠食管面积的百分比计算[19],根据统计结果(图6B),阴性对照组为(5.33±0.61)%,基因敲除小鼠为(10.33±0.95)%,与阴性对照组比较差异有统计学意义(P<0.05),而普通小鼠阳性区域占比为(24.83±2.57)%,与基因敲除组小鼠相比差异有统计学意义(P<0.01)。
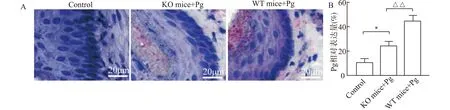
A:小鼠食管上皮RNAscope©检测;B:Pg的表达量统计图,与对照组比较,*P<0.05,与KO mice+Pg组比较,△△P<0.01图6 xCT-/-小鼠抑制Pg在其食管鳞状上皮细胞的定殖Fig.6 Inhibition of Pg colonization in esophageal squamous epithelial cells in xCT-/- mice
2.4 Pg感染诱导食管癌细胞谷氨酰胺代谢增强
提取实验各组小鼠食管组织总RNA,利用qRT-PCR方法检测不同分组中小鼠食管组织谷氨酰胺合成酶GLS1的表达水平。结果表明,与对照组比较,GLS1的表达水平在KO mice+Pg组及WT mice+Pg组均显著升高(均P<0.01)(图7A)。本研究进一步提取不同处理组食管癌细胞系总RNA,以KYSE150转染空载质粒(150+NC)为对照组。结果显示,与对照组比较,GLS1的表达水平在150+NC+Pg组及150+sh xCT+Pg组显著增高(均P<0.01)(图7B)。
GSH/GSSG试剂盒检测发现,Pg感染后24 h谷氨酰胺水平显著升高。在存在谷氨酰胺的情况下,Pg感染细胞的GSH/GSSG比值为(19.33±2.73),较未感染细胞的(6.00±0.33)明显升高,差异具有统计学意义(P<0.01)(图7C)。
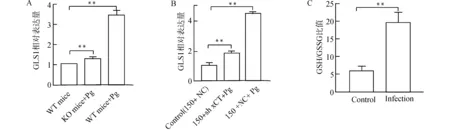
A:小鼠食管组织中GLS1的表达水平,与WT mice比较,**P<0.01;B:食管癌细胞不同处理组GLS1的表达,与对照组比较,**P<0.01;C:感染Pg后谷氨酰胺代谢增强,与对照组比较,**P<0.01图7 Pg感染诱导谷氨酰胺代谢增强Fig.7 Pg infection enhances glutamine metabolism
3 讨论
肿瘤研究中有关病原微生物与宿主之间的作用机制探讨不多,多种病原微生物均可通过影响宿主表面受体分子,在肿瘤细胞中长期定植,促进肿瘤生长,促进其恶性进展[22]。尽管病原微生物感染对肿瘤的作用机制尚不完全明确,但清除病原微生物有助于控制肿瘤的恶性进展[23]。
在本研究中,我们通过探究微生物毒力因子对肿瘤宿主细胞的分子相互结合机制,首次发现促进Pg进入食管鳞癌细胞的宿主因子。肿瘤细胞中xCT的高水平表达及其作为Pg进入细胞的宿主因子,说明肿瘤细胞的膜受体分子在Pg感染期间发挥重要作用。体外实验证实xCT能够与FimA互相结合,促进Pg进入ESCC,从而增强肿瘤细胞对胞外谷氨酰胺的摄取。体内实验表明xCT在Pg进入食管上皮细胞的转运过程中发挥重要作用,在Pg感染食管癌细胞后,细胞谷氨酰胺代谢活力增强,表明xCT在肿瘤细胞代谢过程中可参与维持细胞氧化还原稳态。因此,xCT可作为食管癌防治的潜在靶点之一。虽然本研究尚未探究其他癌种中类似的细胞功能机制,但当xCT被抑制时,具有较高xCT表达的肿瘤细胞均会对细胞侵袭产生类似的影响[24]。
越来越多的科学研究证据表明,细菌在肿瘤发生和化疗耐药中发挥着重要作用[25]。多项研究结果表明,xCT在多种肿瘤中均具有更高的表达水平[26-27]。xCT不仅与细胞的谷氨酰胺代谢相关,还在细胞的铁死亡过程中起着关键作用,对其靶向抑制已被证明可在体内体外抑制多种肿瘤生长。近年研究还发现,活性氧在细胞内的积累可诱导细胞发生自噬,但抑制xCT的表达后是否通过在细胞内积累活性氧诱导肿瘤细胞发生自噬尚不清楚。目前,关于Pg影响肿瘤细胞功能的分子机制尚不完全明确,以及在Pg感染条件下,xCT如何维持食管癌细胞氧化还原稳态的具体机制仍需进一步探讨。
我们的研究结果表明,Pg的鞭毛蛋白FimA可与xCT特异性结合,xCT在调节食管癌细胞恶性演进方面发挥重要作用,提示xCT可作为Pg阳性食管癌患者潜在治疗靶点之一。在进一步提高患者整体预后水平,挖掘影响食管鳞癌发生、发展的危险因素,探寻新的分子治疗靶点中具有重要临床意义。此外,明确xCT在食管肿瘤转移中的作用将有助于其进一步的临床应用。
