小球藻-菌剂联合处理氨氮废水的实验研究
2022-08-19郑思米马湘蒙陈如歌袁思涵黄宇菲李淑媛
郑思米,魏 群,马湘蒙,陈如歌,袁思涵,黄宇菲,李淑媛
(广西大学 资源环境与材料学院,广西 南宁 530004)
0 引 言
随着工业化进程的加快,人类生活中产生的废水逐渐增多,导致环境水质变差[1],其中氨氮是致使水质变差的重要因素之一。氨氮含量过高具有很多危害,比如水体中溶解氧降低,影响水生生物生存、对生态环境和人类健康都有不同程度的影响[2-3]。目前对氨氮废水的处理技术主要有物理化学法和生物法两大类,而这些传统氨氮废水的处理技术存在一定的缺陷,如物理化学方法具有二次污染的缺点,传统生物法中具有曝气量大、污泥产量高等缺点[4]。因此,寻求一种节能环保的氨氮废水处理技术显得尤为重要。
藻菌共生体系可以通过微藻与细菌之间的协同作用来处理废水,其操作简单且无二次污染,还有利于微藻生物质收获,具有重要的环境效益和经济效益。目前,藻菌体系处理氨氮废水的研究主要是通过单因素实验进行分析。该方法具有较大的局限性,且对藻菌共生生长的内在机制及去除氨氮的机理分析也相对甚少。本文以蛋白核小球藻和菌剂构建的藻菌体系为对象,探究了光照强度、菌藻接种比以及初始氨氮浓度等因素对该体系处理氨氮废水的影响,利用响应面实验优化了影响因素参数,通过计算氨氮的去除途径分析了微藻和细菌对氨氮去除的贡献程度,测定体系pH和EPS中的氮素变化,对藻菌体系的共生机制进行了探究,最后采用高通量测序分析了藻菌体系中的微生物群落变化,证明了该体系的优越性,为该体系处理氨氮废水的实际工程应用提供理论依据。
1 材料与方法
1.1 实验材料
实验藻种:蛋白核小球藻(Chlorellapyrenoidosa),购自中国科学院武汉水生生物所。在25 ℃下使用BG11培养基对蛋白核小球藻进行培养[5]。将配制好的培养基用1 mol·L-1盐酸调节pH至7.1±0.2后,在121 ℃下高压灭菌30 min,冷却至室温后用紫外线消毒30 min。在无菌条件下,将藻液接种到装有BG11培养基的1 L锥形瓶中,用白色荧光灯进行连续光照培养[6],光照强度为4 000 lux,温度为(25±2)℃。每天摇晃锥形瓶3次。
实验菌种:微生物菌剂(含硝化细菌、微量元素,呈粉末状),购自南京赛尔特生物技术有限公司。细菌接种于灭菌的培养基中(葡萄糖10 g·L-1、去离子水1 L),于250 mL锥形瓶内振荡培养,温度为(30±2) ℃。
实验废水:采用模拟氨氮废水,模拟废水配方见表1。接种方式:藻液和菌液经4 000 r·min-1离心10 min,弃上清液后获得藻泥和菌泥,用去离子水冲洗3次残余培养基后,接种至模拟氨氮废水中[7]。

表1 模拟废水配方Table 1 Simulated wastewater formula
1.2 实验方法
所有实验组中,单一小球藻组初始接种浓度为0.2 g·L-1、藻菌体系的总接种浓度为0.2 g·L-1。在初始氨氮浓度为100 mg·L-1、菌藻比为3∶1的条件下,考察不同光照强度对氨氮废水的处理效率,设置光强为2 000、4 000、6 000 lux;在初始氨氮浓度为100 mg·L-1、光强为4 000 lux的条件下,考察不同菌藻比对氨氮废水的处理效果,设置菌藻比(质量比)为3∶1、2∶1、1∶1、1∶2、1∶3,并设置单一的蛋白核小球藻组为对照组;在3∶1菌藻比、光强为4 000 lux的条件下,研究小球藻菌体系处理不同初始氨氮浓度的氨氮去除效率,设置初始氨氮浓度为50、100、150、300、600 mg·L-1。藻菌接种至1 L(体积为700 mL)的锥形瓶中,在无曝气条件下处理模拟氨氮废水,温度控制在(25±2) ℃,每日取样测定氨氮、pH、叶绿素a。
响应面实验:以藻菌体系处理模拟氨氮废水的各项单因素最适范围值为基础,进行响应面烧杯实验(见表2)。利用Design Expert 8.0.6响应面软件设计响应面Box-Behnken实验方案进行17组烧杯实验,以氨氮去除率为响应值。

表2 响应面实验各影响因素最适范围值输入表Table 2 Input table of optimum range values of each influencing factor for the response surface experiment
1.3 分析方法
氨氮:纳氏试剂分光光度法;硝态氮:紫外分光光度法;亚硝态氮:分子吸收分光光度法;叶绿素a:分光光度法[8];pH:多参数水质测定仪;光照强度:照度计;微生物群落:高通量测序(上海美吉生物有限公司);T-EPS和L-EPS提取方法如下[9]:取10 mL样品至15 mL离心管,以4 000 r·min-1离心10 min,离心去上清液后,沉淀物中加入0.05%NaCl溶液至10 mL,并以8 000 r·min-1离心10 min,收集上清液得到松散型EPS(L-EPS)。剩余沉淀物中加入0.05%NaCl溶液至10 mL,然后在60 ℃水浴中放置30 min,再以15 000 r·min-1离心20 min,收集上清液获取紧密型EPS(T-EPS)。
游离氨挥发所占比例用式(1)计算[10]:
由表2可以看出,硬度不同的橡胶套对推力杆的整体强度存在一定的影响,随着硬度的增大,管柱的应力值变化较小,销轴受力一端的应力变化也不明显,约束一端的应力值小幅度上升,推力杆头的部分应力值上升明显。综合考虑对推力杆的强度和刚度要求及橡胶本身的强度要求,橡胶的硬度选择HS50为宜。
(1)
式(1)中:T为实验过程中体系的温度,℃。
硝化作用所占比例用式(2)计算[11]:

(2)
式(2)中:C0(NH3-N)为初始氨氮浓度,mg·L-1;C(NO3-N)和C(NO2-N)反应结束后体系的硝态氮和亚硝态氮浓度,mg·L-1。
2 结果与讨论
2.1 光照强度、菌藻接种比及初始氨氮浓度对藻菌体系去除氨氮的影响
图1(a)为实验组在不同光照强度下氨氮浓度变化曲线。由图1(a)可知,实验组中氨氮浓度在前三天都迅速下降,随后缓慢下降至稳定状态,其中2 000 lux组最终稳定在46 mg·L-1,4 000 lux 和6 000 lux组最终稳定在10.22 mg·L-1和23 mg·L-1,低光强条件下(2 000 lux)的藻菌体系对氨氮的处理效果明显不如高光强条件(4 000 lux 和6 000 lux)。光强为4 000 lux组对氨氮的去除效果最好,六天内将氨氮下降至10.22 mg·L-1,氨氮的去除率达到89.57%;6 000 lux 组对氨氮的去除率为76.67%;2 000 lux组对氨氮的去除效果最差,六天内的去除率仅为57.41%。当光强增加时,藻菌体系对氨氮的去除率也会增加,但增加到6 000 lux时,体系对氨氮的去除率会下降,这说明当光强继续提高时,超过了小球藻生长所需的饱和光强[12]。因此,本研究中选择光强为4 000 lux为藻菌体系去除氨氮的最佳光照条件。
图1(b)为不同菌藻比条件下氨氮变化曲线。由图1(b)可知,菌藻比3∶1组对氨氮的去除效果最好,六天后将氨氮降至13.16 mg·L-1,对氨氮的去除率达到了89.61%;单一的小球藻实验组对氨氮的去除效果最差,六天后氨氮降至85.31 mg·L-1,去除率仅为31.84%。从氨氮变化的曲线下降趋势可以看出,实验组在第一天对氨氮的去除速率最快,藻菌实验组处理量均大于单一小球藻组。这说明藻菌共生体系与单一的微藻相比,去除氨氮的优势明显,因此选择菌藻比3∶1为该体系处理氨氮废水的最佳菌藻接种比。
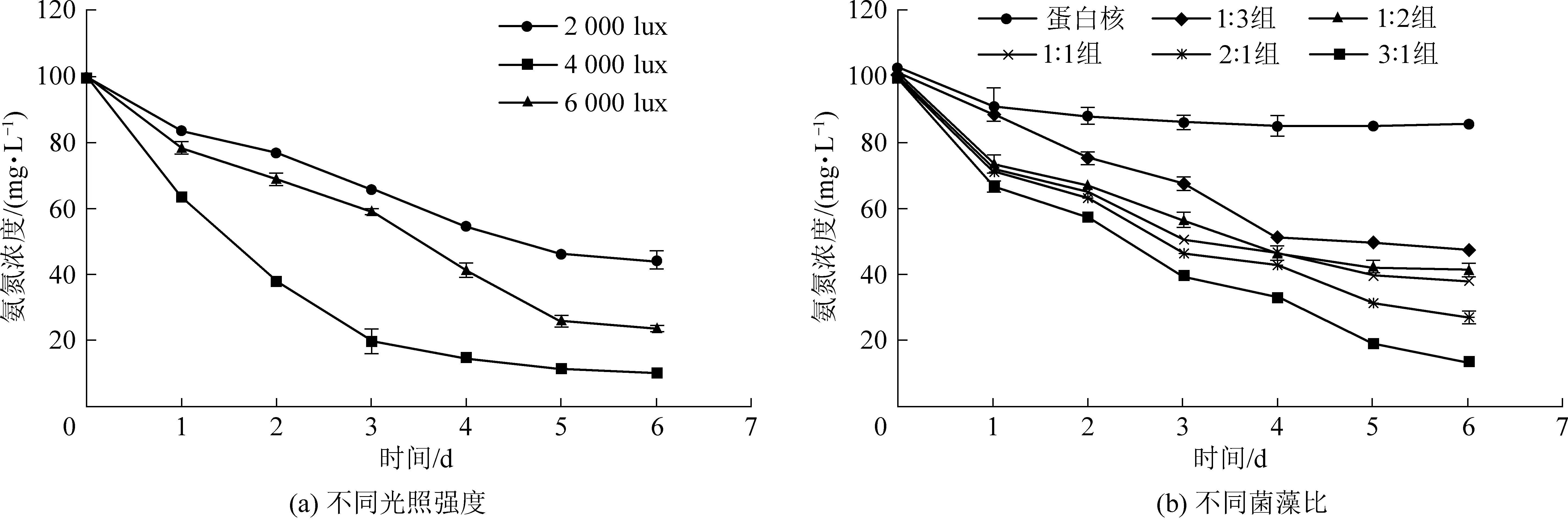
图1 不同光照强度和不同菌藻比条件下的氨氮变化曲线Fig.1 Variation curves of ammonia nitrogen concentration under different light intensities and bacteria-to-algae ratios
不同初始氨氮浓度组的氨氮去除率如图2(a)所示。初始氨氮浓度50 mg·L-1的实验组在整个实验过程中对氨氮的去除率最高,为94.92%,50、100、150 mg·L-1实验组对氨氮的去除率均大于70%,而大于150 mg·L-1的两组藻菌体系对氨氮去除率分别为48.44%和18.76%。图2(b)为不同初始氨氮浓度组氨氮削减量图,初始氨氮为300 mg·L-1组的氨氮削减量最大,为143.07 mg·L-1,而初始氨氮600 mg·L-1组的氨氮削减量为112.74 mg·L-1。这说明在初始氨氮浓度为300 mg·L-1的条件下,微藻仍然能够正常生长且吸收氨氮,当氨氮的浓度继续增加时,由于氨氮过高对微藻产生毒害,导致微藻吸收氨氮量减少[13]。
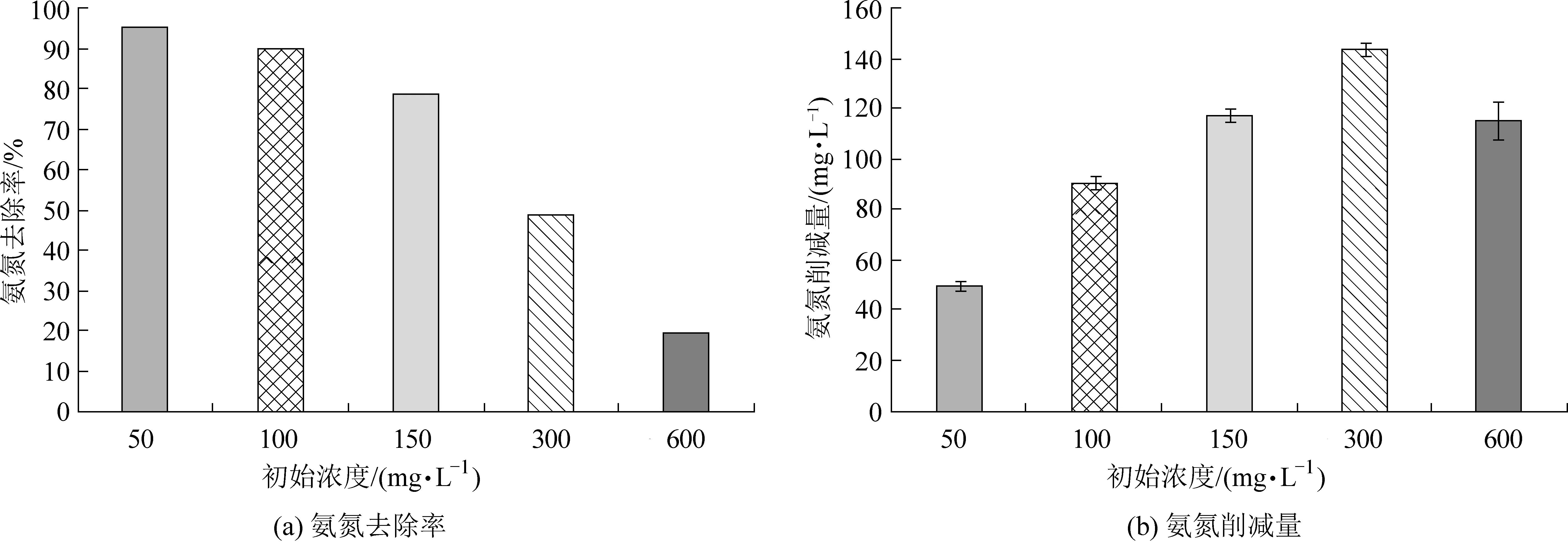
图2 不同初始浓度对氨氮去除率和削减量的影响Fig.2 Removals (%) and reduction amounts of ammonia nitrogen with different initial concentrations
2.2 响应面分析
续表
从响应面的曲线图进行分析,图3为基于中心组合设计(BBC)的氨氮去除率响应面和等高线图,可反映两因素交互作用的强弱[14-15]。从图3(a)和图3(c)响应曲面图可知,随着光强的增加,氨氮的去除率也会随之增加,但是当光强增大到一定程度后,氨氮去除率则会有下降的趋势。从图3(b)和图3(d)的等高线图可以看出,当光强较小时,其等高线表现为平缓,说明菌藻比和初始氨氮浓度对氨氮去除率的影响不显著,在光强为4 000 lux 附近时较显著,因此在响应面曲线图中表现为陡峭。从图3(e)的响应曲面可以看出,随着初始氨氮浓度和菌藻比的增加,氨氮去除率变化不明显;从图3(f)等高线图可知,菌藻比和初始氨氮浓度两因素之间的交互作用不明显。最终由响应曲面的陡峭程度可以看出,光强对氨氮去除率的影响最显著,其次是初始氨氮浓度,这与方差分析的结果一致。

图3 不同的两种因素之间对氨氮去除率影响的响应面图和等高线图Fig.3 Response surface diagram and contour diagram of the influence of two different factors on ammonia nitrogen removal (%)
为了检验模型预测的准确性,以确定的最优参数进行3次重复实验,根据实际情况进行相应调整,具体选择的参数如下:光强4 700 lux、菌藻比3∶1、初始氨氮浓度56 mg·L-1。结果取3次平行实验平均值,得到氨氮去除率为87.96%,与模型预测值的87.31%非常接近,证明响应面法参数优化结果具有有效性。
2.3 氨氮去除机理分析
2.3.1 氨氮去除途径
通过计算氨氮去除途径分析藻菌体系中小球藻和细菌对氨氮去除的贡献程度。在藻菌体系中,氨氮的主要去除途径包括氨挥发、硝化作用及微藻吸收[16]。计算数据基于初始氨氮浓度为50 mg·L-1实验组。通过计算,在实验过程中由于pH维持在8.5左右,氨挥发所占的比例很小,仅为6.64%;而在体系中,最终剩余的氨氮含量为2.9 mg·L-1,硝态氮的剩余含量为0.88 mg·L-1,无亚硝态氮的产生。因此通过硝化作用去除氨氮所占比例为17.50%;体系中还有少量氨氮储存在EPS中,可忽略不计;微藻吸收氨氮占比为75.86%。这说明在氨氮去除的过程中,小球藻的贡献程度大于细菌。
图4为藻菌体系和单一小球藻的pH变化。通过图4的pH变化曲线浅析了藻菌体系去除氨氮过程的机理和优越性。单一小球藻中的pH从第二天开始便迅速降到4以下,随后整个体系始终处于酸性环境中,小球藻也迅速失活。造成这种现象的原因是小球藻去除氨氮的方式是通过同化吸收作用,首先将氨同化为谷氨酰胺并释放H+,然后在谷氨酰胺合成酶的作用下,利用三磷酸腺苷(ATP)作为电子供体与谷氨酸合成氨基酸谷氨酰胺[17]。在这个过程中,小球藻向水体中释放出了大量H+,导致废水pH下降[18-19]。在藻菌体系中,pH可以保持在8左右,也是适合小球藻生长的pH范围,因此体系得以持续去除废水中的氨氮,其原因在于体系中溶于水的CO2会与碳酸氢盐保持动态平衡,见式(3),而来自细菌产生的CO2平衡见式(4)。由于小球藻的活性高于细菌,故小球藻光合作用吸收的CO2就会大于细菌硝化作用释放出来的CO2,导致式(3)的反应速度大于式(4)。因此,小球藻所需的CO2就需要依靠碳酸氢盐的水解补充,这样就导致体系OH-浓度增加,中和了微藻在同化吸收氨氮过程中产生的氢离子,使得pH保持较为稳定。
(3)

(4)
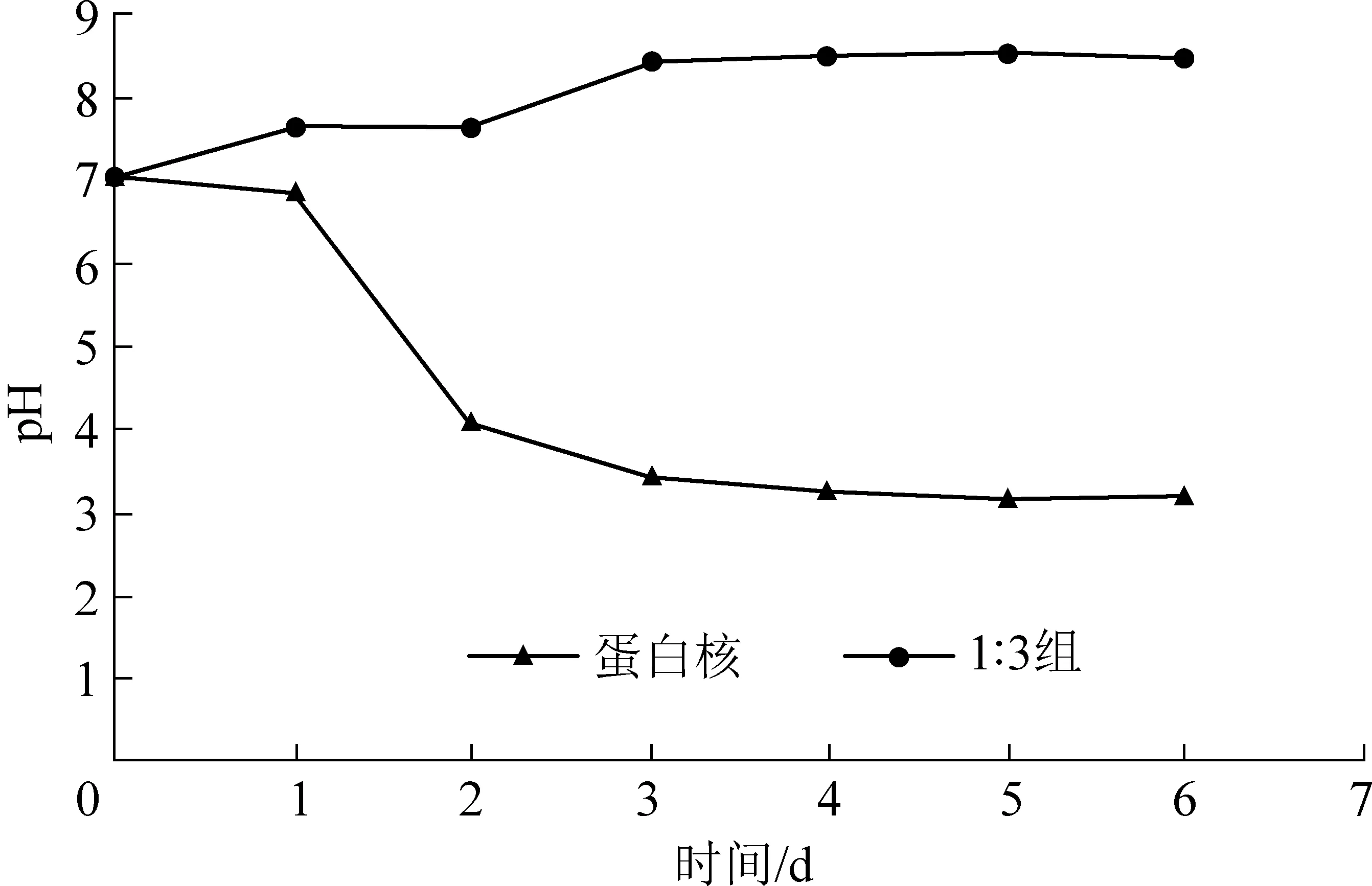
图4 藻菌体系和单一小球藻的pH变化Fig.4 pH changes of the Chlorella-bacteria systemand single Chlorella
2.3.2 藻菌体系共生机制
藻菌体系之所以能够持续保持稳定、高效去除污染物,其中主要的原因之一在于EPS在体系中发挥了重要的作用。EPS是藻菌互利共生的关键介质。研究表明,EPS在藻菌体系中是重要的营养物质储存和转化场所[20]。
通过测定松散型EPS(L-EPS)和紧密型EPS(T-EPS)中的氨氮、硝态氮浓度变化,分析了藻菌共生体系中物质交换的机理。由图5可以看出,在T-EPS中,氨氮始终处于下降趋势,且没有硝态氮的生成,说明T-EPS是氮元素的转移场所而不是转化场所。因此,在T-EPS中,吸附的氨氮和游离在废水中的氨氮一样,都被微藻直接吸收。由图5可知,氨氮在L-EPS中的含量逐渐升高,一天后到最高点,然后开始下降,第三天后基本稳定,而硝态氮在L-EPS中逐渐增加后趋于稳定,说明废水中的氨氮一部分被微藻直接吸收利用,一部分被细菌硝化过程转化为硝态氮且储存在了EPS中,还有一部分直接存至EPS中。另外,在废水中存在Ca2+和Mg2+,这两种离子是微藻用于自身细胞壁的合成和叶绿素的形成的关键元素,Ca2+和Mg2+会主动转运至微藻细胞,且微藻周围带负电荷的EPS与带正电荷的离子(主要是Ca2+和Mg2+)也会充分接触,这使得EPS上会吸附大量Ca2+和Mg2+,让微藻细胞产生更多的叶绿素,从而增强了微藻细胞的光合作用活性[21]。因此,微藻会产生更多的氧气提供给细菌,而细菌产生二氧化碳让微藻生长得到充分的碳源,同时,微藻和细菌的活性增强又进一步促进了EPS的分泌,形成了良性循环,藻菌与EPS间的关系如图6所示。总之,藻菌体系通过EPS这个关键纽带维持着较高的稳定性,从而保证该体系可以高效地去除氨氮。
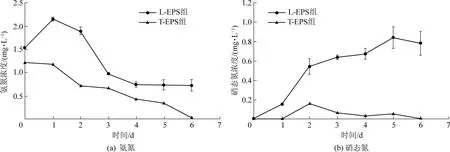
图5 L-EPS和T-EPS中氨氮和硝态氮的变化Fig.5 Changes of ammonia nitrogen and nitrate nitrogen in L-EPS and T-EPS
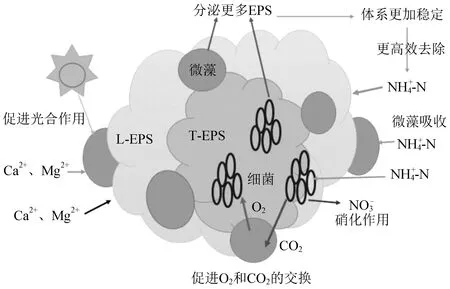
图6 藻菌与EPS间的关系Fig.6 Relationship between Chlorella,bacteria and EPS
2.4 藻菌体系微生物多样性分析
生物群落多样性可用Shannon和Simpson指数来评价。Shannon指数值越大,说明群落多样性越高,而Simpson值指数越大,表明群落的Alpha多样性越差[22-23]。测序结果表明三组的覆盖度均为0.999,说明本次测序结果能很好地代表样本中微生物的真实情况,见表4。由Shannon和Simpson指数可知,随着时间的增加,藻菌体系的微生物Alpha多样性增加,大于初始阶段,到第七天时,其多样性指数保持相对稳定,证明该体系的群落结构较为稳定。

表4 藻菌体系中不同时期的微生物多样性分析Table 4 Analysis of microbial diversity in the Chlorella-bacteria system at different periods
图7(a)为属(Genus)水平上藻菌体系在第一天、第三天、第七天时处理模拟氨氮废水后的微生物群落丰度分布。第一天,产卟啉杆菌属(Porphyrobacter)的相对丰度为26.57%,是体系中的优势菌属,其次为根瘤菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium)的19.06%、短波单胞菌属(Brevundimonas)的12.14%,这几种菌属均为变形菌门(Proteobacteria);第三天,体系中的优势菌属发生了变化,Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium成为了优势菌属,相对丰度变为36.03%,Porphyrobacter的相对丰度降至15.13%;第七天,优势菌属依然是Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium,其次是Porphyrobacter,两者的相对丰度几乎保持稳定,分别为40.24%和17.39%。结合体系溶解氧(见图7(b))和生物群落变化分析,第一天到第三天,体系内的溶解氧从最高点迅速下降,此时Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium的活性最高,因为该菌属生长主要依赖的氮源为氨氮[24],所以在此阶段该菌属对氨氮的硝化作用增强,在这个过程中消耗了体系中大量的氧气供自身生长。因此,该菌属的相对丰度增加。Porphyrobacter的相对丰度的减少可能是由于该菌属是光合不产氧细菌[25],会与微藻竞争光照,而微藻的生长导致了该菌属相对丰度的下降。随着时间的推移,Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium和Porphyrobacter两种菌属的相对丰度保持稳定,这可能是由于EPS在体系中能持续提供营养物质,使得细菌与小球藻能很好地共生生长。有研究表明,Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium具有促进微藻生长的作用[26],而Porphyrobacter能促进微藻的絮凝[27],这也证明了该体系有利于微藻的生物质收获,同时能改善水环境水质。
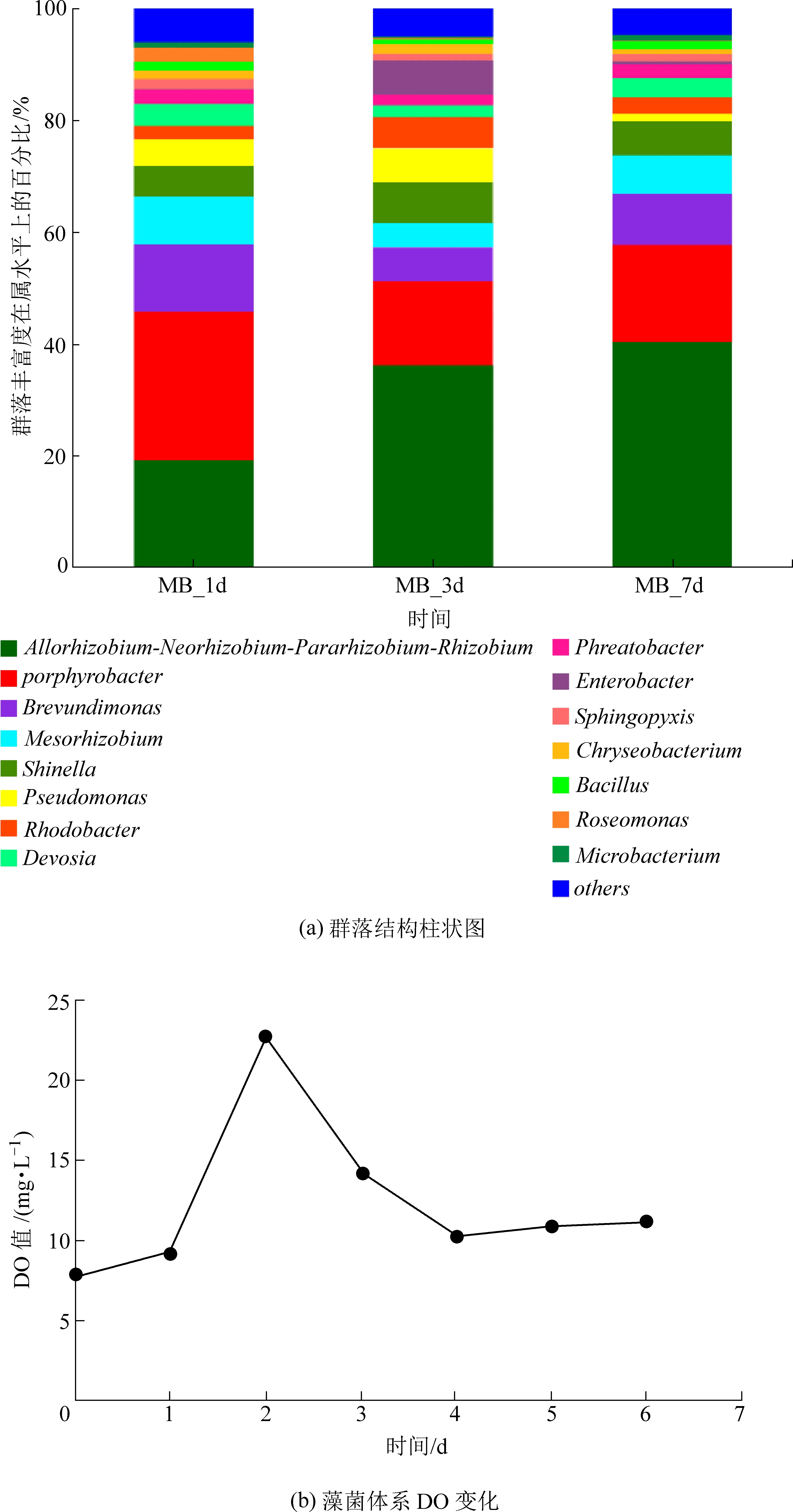
图7 藻菌体系在不同时期的属水平群落结构和DO变化曲线Fig.7 Genus level community structure and curve of DO chang ofthe Chlorella-bacteria system in different periods
3 结 论
(1)单因素实验结果表明:光照强度为4 000 lux时,藻菌体系对氨氮去除效果最好;菌藻比为3∶1 是该体系处理氨氮废水的最佳菌藻接种比;当初始氨氮浓度为50 mg·L-1时,氨氮去除率最高,为94.92%。
(2)藻菌体系去除氨氮的因素影响主次关系为:光照强度 > 初始氨氮浓度 >菌藻比。通过响应面进行参数优化后得出,在光强4 700 lux、菌藻比3∶1、初始氨氮浓度56 mg·L-1的最佳组合下得到氨氮去除率的结果(87.96%)与预测值(87.31%)接近。
(3)当系统内氨氮浓度较低时,小球藻对氨氮的去除起主要作用,而氨氮能够得到有效去除可能是由于细菌的存在维持了体系内的pH,从而使小球藻保持一定的活性;EPS作为藻菌间进行物质交换,互利共生的关键介质,维持着体系的良性循环。
(4)在藻菌体系中,根瘤菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium)和产卟啉杆菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium)的相对丰度保持稳定,前者具有促进微藻生长的作用,而后者能促进微藻的絮凝,证明了该体系不仅能促进微藻生长,还有利于微藻的生物质收获,同时改善水环境水质。
