茶树油微囊乳液对水蛭的驱避效果研究
2022-08-19刘一婧胡静璐杜丽娜
刘一婧,胡静璐,杜丽娜,3
(1.山东中医药大学药学院,山东 济南 250355;2.军事科学院军事医学研究院辐射医学研究所,北京 100850;3.河南大学药学院,河南 开封 475004)
水蛭唾液腺会分泌一种具有极强的抗凝血酶活性以及抗血小板聚集作用的单链多肽水蛭素,因此被水蛭叮咬后流血较多[1],咬坏真皮组织会形成终生疤痕[2]。目前尚没有专门有效驱避水蛭的制剂,因此开发一种安全、有效的水蛭驱避剂尤为迫切。植物精油是提取自芳香植物的次生代谢产物,由多种化学成分(如萜烯类、醇类、酚类、醛类、酯类、酮类等)组成的混合物[3]。植物精油对昆虫的影响具体表现在驱避、熏蒸毒性、抑制生长发育等方面[4-5],将其作为驱避剂使用,具有不易产生抗药性、易降解、环境友好等优点[6]。但植物精油化学性质不稳定、具有局部刺激性等缺点限制了其广泛应用[7-8],因此需将其制备成适宜的剂型以适应驱避需求。
微囊是利用天然或合成高分子材料包封固态或液态药物的一种载体[9]。复凝聚法制备微囊因工艺简单、成本低及产率高的特点而备受关注[10]。2种或多种水溶性高分子溶液由于电荷中和而凝聚,通过包裹芯材形成微囊。明胶是胶原水解得到的一种蛋白质,结构与生物体组织结构相似,具有良好的生物相容性和生物可降解性。海藻酸钠作为一种天然阴离子多糖,具有良好的黏附性。本文以明胶-海藻酸钠为囊材,采用复凝聚法制备茶树油微囊[11],对其粒径、形貌、结合方式等性质进行表征,再用司盘80作为乳化剂制备茶树油乳液,将茶树油微囊分散到茶树油乳液中即得茶树油微囊乳液,再以日本医蛭为模型,考察茶树油微囊乳液对日本医蛭在不同环境中的驱避作用,以期为天然精油作为驱避剂应用提供新思路(图1)。

图1 茶树油微囊乳液的制备与驱避效果评价示意图Fig.1 The schematic diagram of preparation and evaluation of tea tree oil microcapsules emulsion to repel leeches
1 材料与方法
1.1 药物与试剂
茶树油(批号:20190916,广东富阳生物科技有限公司);吐温20(批号:001018,广州天马精细化工厂);驱蚊酯驱避剂(批号:20180125,太仓荣德生物技术研究所);司盘80(中国医药公司北京采购供应站);戊二醛(批号:KTBGE16,北京伊诺凯科技有限公司);明胶(批号:000221,北京化学试剂公司);海藻酸钠(批号:F20050418,国药集团化学试剂有限公司);氢氧化钠(批号:20091022,北京市博迪化工有限公司);醋酸(批号:20160920,国药集团化学试剂有限公司);无水醋酸钠(批号:20080504,国药集团化学试剂有限公司);正己烷(批号:20200713,国药集团化学试剂有限公司);胰酶(批号:200831,北京鸿润宝顺科技有限公司);BCA蛋白定量测定试剂盒(批号:20210125,南京建成生物工程研究所);乙酰胆碱酯酶(AchE)测定试剂盒(批号:20210121,南京建成生物工程研究所);谷胱甘肽S转移酶(GST)测定试剂盒(批号:20210121,南京建成生物工程研究所);羧酸酯酶(CarE)活性测定试剂盒(批号:20210125,南京建成生物工程研究所);去离子水、超纯水(自制)。
1.2 仪器
KM-822D超声波清洗机(广州市科洁盟仪器有限公司);DHG-9140A电热鼓风干燥箱(上海一恒科学仪器有限公司);LGJ-30冷冻干燥机(北京松源华兴科技有限公司);Spectrum Two傅里叶变换红外(IR)光谱仪[珀金埃尔默企业管理(上海)有限公司];RVDV-ⅢU场发射扫描电镜(美国Brookfield);PB-10 pH计(德国Sartorius);BT-9300ST激光粒度仪(丹东百特仪器有限公司);TU-1901紫外分光光度计(北京普析通用仪器有限公司);VS-555高速分散均质匀浆机(无锡沃信仪器制造有限公司);EL×800酶标仪(美国BioTek);KI-Ⅱ高速组织研磨仪(武汉谷歌生物科技有限公司);H2-16KR高速冷冻离心机(湖南可成仪器制造有限公司);DSC214差示扫描量热仪(德国Netzsch)。
1.3 实验动物及分组
日本医蛭(体质量0.1~0.4 g)源自天津市宝坻区。经适应性饲养3 d后,随机分为对照(生理盐水)组、空白微囊乳液组、阳性对照(驱蚊酯)组、茶树油水溶液组、茶树油微囊乳液组,每组10只。
1.4 茶树油水溶液的制备
称取0.5 g吐温20加去离子水至50 mL配成1%吐温20水溶液。取2 mL茶树油加入1%吐温20水溶液至10 mL,配成20%(v/v)茶树油水溶液。
1.5 茶树油微囊处方及工艺优化
1.5.1 明胶等电点(pI)的测定 分别配制0.1 mol·L-1醋酸和醋酸钠水溶液,1%(w/v)明胶水溶液。用醋酸和醋酸钠水溶液分别配得pH值为4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6的一系列缓冲溶液;取3 mL上述缓冲液和1 mL明胶溶液,混合均匀;再加入4 mL无水乙醇,边加边振摇,直至都出现不同程度的浑浊。用紫外分光光度计在400 nm处测定溶液吸光度(A)。A值最大处溶液pH值即为明胶pI值。
1.5.2 最佳复凝聚pH值的测定 分别配制1.5%(w/v)明胶溶液和0.5%(w/v)海藻酸钠溶液,二者等体积混合后于650 r·min-1、45 ℃的条件下搅拌;用醋酸调节pH值至2.8、3.0、3.3、3.6、3.9、4.2、4.5、4.8,继续搅拌1 h进行复凝聚反应。反应结束后可得到不同pH值复凝物悬浊液,离心取上清液,测定其在400 nm处A值。上清液A值越小,复凝聚反应越完全,比较不同pH条件下上清液A值,确定最佳复凝聚pH值,此时复凝聚法产率最高。
1.5.3 明胶与海藻酸钠最佳配比 配制浓度为1%、1.25%、1.5%、1.75%、2%、2.25%、2.5%、2.75%的明胶溶液,分别与0.5%(w/v)海藻酸钠溶液等体积混合,并在650 r·min-1、45 ℃的条件下搅拌,用醋酸调节混合溶液pH,在最佳复凝聚pH值条件下反应1 h,反应结束后离心、清洗、干燥得到复凝物;计算各组复凝物产率从而得到明胶与海藻酸钠的最佳配比[12]。

1.5.4 正交设计实验确定茶树油微囊乳液处方组成 先将茶树油、司盘80加入海藻酸钠溶液进行第1次高速搅拌,然后加入明胶溶液进行第2次高速搅拌,2次高速搅拌条件均为10 000 r·min-1、5 min,配制成含一定质量分数的明胶与海藻酸钠的茶树油乳液。用醋酸调节乳液至最佳复凝聚pH值进行复凝聚反应,反应条件为45 ℃、600 r·min-1搅拌1 h。冰水浴降温至5~10 ℃,加入戊二醛水溶液(m明胶∶m戊二醛=1∶1),再用1 mol·L-1的NaOH溶液调节体系pH值至8~9,400 r·min-1搅拌固化1 h,并使体系温度缓慢升至室温。整个操作期间不断搅拌。反应完成后,抽滤,洗涤,得湿微囊。空白微囊中不含茶树油,制备方法同茶树油微囊。
取适量茶树油与司盘80加入海藻酸钠中搅拌,后加入明胶溶液搅拌,搅拌条件与上述相同,制得茶树油浓度为5.7%的乳液。加入一定量的茶树油微囊,涡旋混匀,所得茶树油微囊乳液含5%(w/v)茶树油。空白微囊乳液除不含茶树油,配制方法与茶树油微囊乳液相同。
以明胶-海藻酸钠含量(A)、茶树油/明胶-海藻酸钠(B)、乳化剂司盘80用量(C)为考察因素,每个因素选取3个水平(表1),按照L9(34)正交表进行正交试验设计。以粒径和包封率为考察指标。
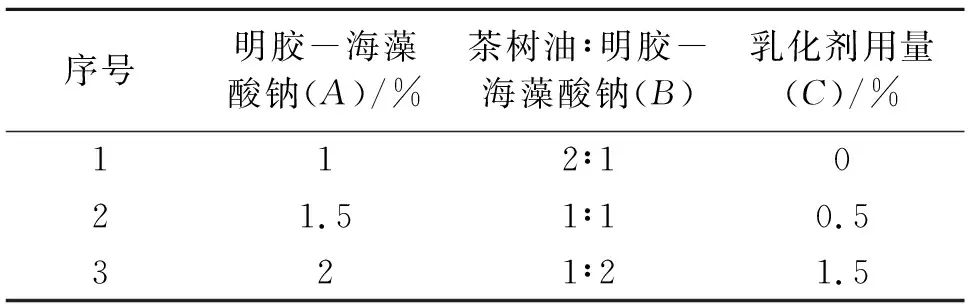
表1 茶树油微囊乳液制备正交因素水平Table 1 Orthogonal test of tea tree oil microcapsules emulsion
1.6 茶树油微囊的表征
1.6.1 粒径分布 取茶树油微囊加去离子水稀释10倍,均匀分散至超纯水中。采用激光粒度分析仪进行测量。
1.6.2 扫描电镜观察形貌 微囊冻干后,取少量样品均匀黏附在有胶带的金属载片上,放入离子溅射仪中进行喷金处理,置于扫描电镜中对样品进行观察。
1.6.3 傅里叶变换IR光谱 分别取少量明胶、海藻酸钠、茶树油、空白微囊以及茶树油微囊样品,在4 000~600 cm-1波数范围内进行IR光谱扫描分析。
1.6.4 差示扫描量热法分析(DSC) 取适量样品于铝坩埚内,参比为空白铝坩埚,测温区间为30~400 ℃,升温速率为10 ℃·min-1,N2环境,分别测定茶树油、空白微囊及茶树油微囊的DSC曲线。
1.6.5 包封率的测定 精确称量0.1 g茶树油于10 mL容量瓶,用正己烷定容。分别取40、60、80、100、120、150、180 μL于10 mL容量瓶中,定容得到浓度分别为0.04、0.06、0.08、0.10、0.12、0.15、0.18 mg·mL-1的标准溶液,用紫外分光光度计在264 nm处测定标准溶液的A值。
称取一定量经清洗、抽滤过的湿微囊,加入到浓度为0.25%(w/v)的胰蛋白酶溶液中,37 ℃反应60 min,使微囊内部芯材完全释放出来,形成乳状液,精密加入5 mL正己烷萃取,超声后离心取上清,测定其在264 nm下的A值。

1.7 茶树油微囊乳液驱避效果评价
1.7.1 滤纸圈法评价驱避效果 取外圆直径为20 cm、内圆直径为12 cm的同心圆形滤纸圈,涂抹相同体积的茶树油微囊乳液、茶树油水溶液、空白微囊乳液、驱蚊酯(阳性药组)及生理盐水(对照组)后,立即将水蛭放入滤纸圈中,观察每组水蛭2 h内在滤纸圈中的分布情况并记录各组水蛭的逃出数(n)。若内圈中的水蛭没有逃出滤纸圈,表明该驱避药物有驱避作用;若内圈中的水蛭在实验过程中陆续从滤纸圈中逃出,或出现在有驱避药物的滤纸圈上且无任何异状,则对水蛭没有驱避效果[13]。
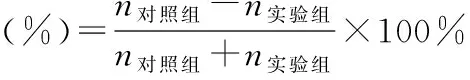
分别用茶树油微囊乳液、茶树油水溶液及生理盐水涂抹滤纸圈后,将滤纸圈在室温下预先放置2 h,再另取3组水蛭放入滤纸圈中进行2 h驱避实验,计算驱避率评价微囊乳液对水蛭的长时间(4 h)驱避效果。
1.7.2 评价水中20 min内驱避效果 在诱饵(大鼠肝脏0.4 g)上分别涂抹0.1 mL茶树油微囊乳液、茶树油乳液及生理盐水,静置1 min使药物完全附着在肝脏上。将大鼠肝脏放入水中,观察记录各组诱饵上正在叮咬的水蛭数量(N)。
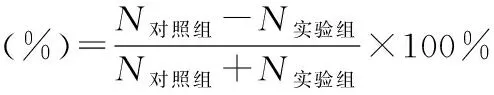
1.8 茶树油制剂驱避机理探讨
1.8.1 酶活性测定样品的制备 收集经过驱避效果评价的水蛭并处死,准确称取0.1 g,4 ℃预冷的生理盐水清洗后滤纸拭干,研磨,制备成10%(w/v)样本组织匀浆液。在4 ℃、2 400×g条件下离心20 min,取上清。
1.8.2 AchE、GST、CarE活性测定 取10%(w/v)水蛭样本组织匀浆上清液50 μL,加入9倍量4 ℃预冷的生理盐水稀释成1%(w/v)组织匀浆液,作为蛋白质含量待测液。取50 μL 10%(w/v)组织匀浆上清液,加入19倍量4 ℃预冷的生理盐水稀释成0.5%(w/v)组织匀浆液,作为AchE待测液。取匀浆上清液100 μL作为GST待测液。具体操作方法按照BCA、AchE及GST测定试剂盒说明书操作进行。分别设置样品孔、对照孔、标准孔和空白孔。测定各孔562 nm处的A值,计算总蛋白含量(C蛋白)。测定各孔405 nm处的A值,计算组织匀浆液中AchE、GST活性。
其中,C标准品:20 μmol·mL-1;V取样量:100 μL;T:反应时间。
1.8.3 CarE活性测定 取10%(w/v)样本组织匀浆液,4 ℃、4 800×g离心30 min,取上清液。实验设置空白孔和样品孔,具体操作方法按照CarE测定试剂盒说明书进行操作,于450 nm处分别测定上清液在10 s和190 s的A值。
其中,ΔA=ΔA190 s-ΔA10 s;V总体积:反应体系总体积(mL),1.005 mL;Cpr:上清液蛋白质浓度(mg·mL-1);V样:加入反应体系中上清液体积(mL),0.005 mL;T:催化反应时间(min),3 min。
1.9 统计学分析
2 结果
2.1 茶树油微囊制备的主要影响因素
茶树油微囊制备的主要影响因素包括明胶pI值、最佳复凝聚pH值、明胶与海藻酸钠比例。溶液最大A值的pH值为4.8,即为明胶的pI值(图2A)。pH在3.6以下时,上清液在400 nm波长处的A值最小,表明复凝聚反应最完全,因此选择最佳复凝聚pH为3.5(图2B)。当明胶浓度为1.5%时,复凝物产率最高,二者反应也最充分(图2C)。

注:A.明胶pI值测定;B.最佳复凝聚pH值测定;C.不同比例明胶/海藻酸钠复凝物产率图2 制备工艺相关条件筛选Fig.2 Optimization of the preparation techniques
2.2 正交设计得到茶树油微囊乳液最优处方
紫外检测结果表明,茶树油在264 nm处线性回归方程为A=4.639C-0.000 095(r=0.999 8),表明茶树油在0.04~0.18 mg·mL-1浓度范围内,线性关系良好。
根据表2中的R值可知,上述处方中3个因素对茶树油微囊包封率的影响程度大小依次为:A>C>B,即明胶-海藻酸钠总浓度对包封率影响程度最大,乳化剂司盘80用量次之,茶树油与总囊材(明胶-海藻酸钠)用量比影响程度最小。当囊材浓度过低时,可包覆茶树油的有效成分较少,制得的微囊颗粒稀落分散,成囊率低;当囊材浓度过高时,形成的胶体溶液较黏稠,分散性较差,制备得到的微囊颗粒较难分散,易出现团聚现象,几乎无微囊形成。综合影响包封率的考察指标,选择包封率大的处方,即A3B3C2。正交实验得出最佳工艺参数为总囊材(明胶-海藻酸钠)浓度为2%(w/v)、茶树油∶总囊材(明胶-海藻酸钠)为1∶2、乳化剂用量为0.5%(w/v),此处方制备得到的微囊分散均匀,包封率高。
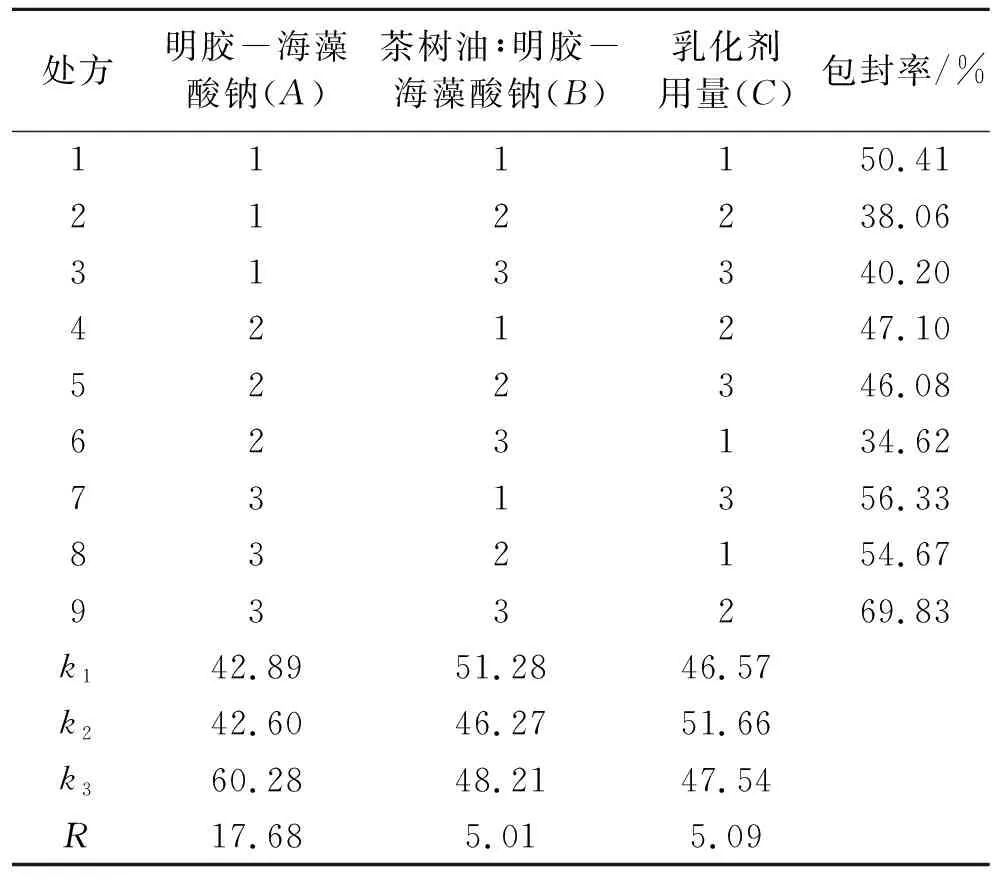
表2 处方组成对茶树油微囊乳液包封率的影响Table 2 The influence of composition on the encapsulation efficiency
2.3 茶树油微囊的表征
2.3.1 扫描电镜观察 茶树油微囊平均粒径为139 μm,粒径分布范围相对较宽,表明茶树油微囊粒径分布不均一。不同粒径微囊表面积不一样,释放速率不同,更有利于持续发挥驱避作用。采用扫描电镜观察微囊形貌较完整,表面粗糙,呈多孔状,有明显褶皱,无聚集粘连,分散性较好,是较为理想的微囊结构(图3A)。
2.3.2 傅里叶变换IR光谱测定 明胶的IR光谱图表明,3 340 cm-1出现的吸收峰是N—H伸缩振动的IR吸收带,酰胺羰基(C=O)的伸缩振动峰为1 638 cm-1[14]。海藻酸钠中1 596 cm-1处是它的羰基(C=O)IR特征峰,是由羰基非对称伸缩振动引起的,1 407 cm-1是羰基对称伸缩振动峰,1 027 cm-1是C—H面内弯曲振动峰[15]。2 959 cm-1是茶树油中CH3不对称伸缩振动吸收峰,2 924 cm-1是茶树油中CH2的不对称伸缩振动峰,1 376 cm-1和1 446 cm-1分别是CH2和CH3的变形振动和芳环骨架振动的重叠峰,这些峰是茶树油中有效成分的特征吸收峰。茶树油微囊IR图谱与空白微囊相似,但有1 452 cm-1的茶树油特征峰(图3B)。

注:A.茶树油微囊扫描电镜图;B.IR光谱分析;C.DSC图谱图3 茶树油微囊乳液的表征Fig.3 Characterization of tea tree oil microcapsules emulsion
2.3.3 DSC测定 DSC曲线中茶树油在约230 ℃处有一较大的吸热峰,可能与其受热分解有关。茶树油固有的特征峰在茶树油微囊中消失,茶树油微囊的DSC曲线与空白微囊更相似(图3C),表明茶树油被包裹制备成微囊。
2.4 茶树油微囊乳液驱避水蛭药效学评价
2.4.1 茶树油微囊乳液对水蛭的驱避效果明显 茶树油微囊2 h内水蛭驱避率为100%,驱避效果明显优于其他组,茶树油水溶液也有较好的驱避效果,但作用时间较短。空白微囊组未见明显驱避作用。与对照组相比,茶树油微囊乳液组与茶树油水溶液组2 h驱避率均具有显著性差异(P<0.01);与茶树油水溶液组相比,茶树油微囊乳液2 h驱避率具有显著性差异(P<0.01)(图4)。
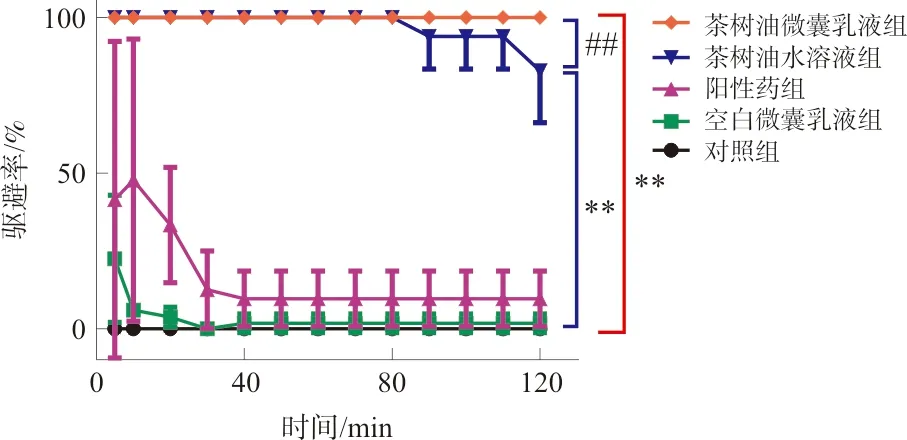
注:与对照组相比,**P<0.01;与茶树油水溶液组相比,图4 茶树油微囊乳液2 h内的水蛭驱避率Fig.4 The repellent rate of different preparationson leeches within 2 h
茶树油微囊乳液4 h时驱避率高于90%,茶树油水溶液4 h时驱避率约为50%。与对照组相比,茶树油微囊乳液组与茶树油水溶液组4 h时驱避率均显著提高(P<0.01);与茶树油水溶液组相比,茶树油微囊乳液4 h时驱避率显著提高(P<0.01)(图5)。
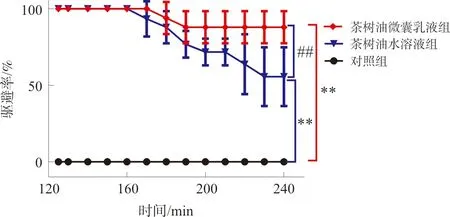
注:与对照组相比,**P<0.01;与茶树油水溶液组相比,图5 茶树油微囊乳液2~4 h内的水蛭驱避率Fig.5 The repellent rate of tea tree oil microcapsulesemulsion on leeches from 2 h to 4 h
2.4.2 茶树油微囊乳液在水中驱避效果明显 茶树油微囊在水中10 min内驱避率>90%,20 min内驱避率>80%;而茶树油水溶液10 min驱避率为60%,20 min降为40%。随时间延长,诱饵上驱避剂逐渐扩散到水中,浓度减小,驱避效果逐渐下降。20 min时,2组驱避率仍显著高于对照组(P<0.01);与茶树油水溶液组相比,茶树油微囊乳液水中20 min时驱避率具有显著性差异(P<0.01)(图6)。

注:与对照组相比,**P<0.01;与茶树油水溶液组相比,图6 茶树油微囊乳液在水中20 min内的驱避率Fig.6 The repellent rate of tea tree oil microcapsulesemulsion on leeches within 20 min in water
2.5 茶树油微囊乳液改变水蛭体内酶活性发挥驱避作用
2.5.1 AchE活性提高 相比于对照组,阳性药组、茶树油微囊乳液组水蛭AchE活力显著增强(P<0.05)(图7A)。
2.5.2 GST活性降低 与对照组比较,茶树油微囊乳液组GST活性降低最为显著(P<0.01)(图7B),表明茶树油微囊乳液能够显著抑制水蛭体内GST活性,降低水蛭自我保护能力从而产生毒性。
2.5.3 CarE活性降低 相比对照组,茶树油水溶液组、茶树油微囊乳液组CarE活性均有显著降低(P<0.05)(图7C),表明茶树油降低水蛭的抗药性。
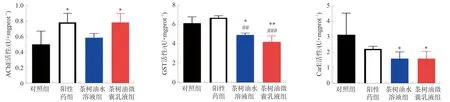
注:与对照组相比,*P<0.05,**P<0.01;与阳性药组相比,图7 水蛭体内AchE(A)、GST(B)及CarE(C)变化Fig.7 The activities of AchE (A), GST (B) and CarE (C) in vivo
3 讨论
本研究将茶树油制备成分散均匀、稳定均一的微囊乳液剂型,乳液能较好地分散挥发油,最大程度地快速释放茶树油,起到快速发挥药效的作用;微囊使茶树油与外界环境隔离开,但其性质基本保持不变,稳定性得到提高,减少挥发散失或药物吸收进入体内,能有效延长茶树油作用时间。2种制剂复合使用既可以使驱避成分快速起效,又能实现缓慢释放延长驱避剂作用时间,提高驱避效率。
采用复凝聚法制备茶树油微囊,囊材为明胶和海藻酸钠。明胶是具有两性离子特性的蛋白质,溶于水时分子链上的NH2和COOH会部分解离成NH3+和COO-,正、负离子数目受溶液pH值的影响;当溶液的 pH 值低于明胶的pI值时,COOH的电离小于NH2与H+的结合,溶液中NH3+的数目多于COO-呈正电性;当pH值高于明胶pI值时则相反,溶液呈负电性[16]。海藻酸钠是一种阴离子天然多糖,溶于水时会电离出大量COO-而呈负电性[12]。当明胶-海藻酸钠混合液的pH值低于明胶的pI值时,混合液中大量NH3+和COO-会由于静电作用结合形成不溶于水的复合凝聚物,当2种高分子电解质总的电荷最小时,相互作用最强,此时形成的复凝聚物最多。
关于驱避效果评价的参考文献较少。本实验以水蛭为模型,采用自行设计的滤纸圈法、水中驱避等行为学实验证明了茶树油微囊乳液对水蛭驱避效果良好,也为其他驱避剂的药效学评价提供了可靠的评价模型。AchE是动物体内一种神经递质水解酶,在生物神经传导中起关键作用,通过降解乙酰胆碱终止神经递质,保证神经信号在生物体内的正常传递[17]。AchE活性过高,神经递质乙酰胆碱水解增强,影响正常的神经信号传导,导致水蛭中毒[18]。GST是动物体内重要的解毒酶,在许多脊椎动物和无脊椎动物体内参与代谢过程和免疫防御,有抗氧化、解毒等保护细胞的作用[19]。当生物受到有毒物质侵害后,体内的GST表达量会有相应的变化以进行自我保护。CarE广泛分布于植物、动物和微生物体内,此酶能够通过螯合或阻断作用,使有毒物质不能与体内大分子结合[20],从而保护自身细胞免受损伤,该酶活性的提高是害虫产生抗药性的重要标志之一[21]。本文通过检测AchE、GST和CarE的活性变化[22],阐明茶树油微囊乳液通过提高体内AchE活性、抑制GST及CarE活性发挥驱避作用。茶树油微囊乳液驱避效果显著,使用安全、方便,可用于水蛭、蚊虫等驱避,为植物精油用于驱避剂提供新思路和新评价方法。
