蒿甲醚对食管癌细胞株ECA-109细胞增殖的影响
2022-08-18王琳琳石玉琪王子见
王 威,王琳琳,刘 婷,石玉琪,马 慧,王子见
(1.河北省秦皇岛市山海关人民医院,河北 秦皇岛 066200;2.西安文理学院 生物与环境工程学院;西安秦岭天然产物开发与创新药物研究重点实验室;西安文理学院 基因工程实验室,西安 710065)
癌症是严重危害人类健康的主要疾病之一,发病率和死亡率呈现逐年递增的趋势.食管癌是一种常见的癌症,发病率排在第6位,而死亡率排在第4位,超过了发病率高的结直肠癌、乳腺癌,2020年全世界大概有54万人死于这种癌症[1].食管癌的临床症状表现为不同程度的吞咽困难、梗阻、胸骨后疼痛[2].食道癌是一种临床上具有挑战性的疾病,需要多学科的治疗方法.内窥镜手术越来越多地用于治疗癌前和早期食管肿瘤.对于晚期食管癌,一线治疗目前仅限于氟嘧啶加铂类化疗[3].化疗或放化疗的新辅助治疗已作为局部晚期食管癌标准治疗的补充手术.最新研究表明,一线治疗食管癌的PD-1免疫检查点抑制剂帕博利珠单抗联合含铂化疗能够治疗不可切除或不适合根治性放化疗的局部晚期或转移性的食管癌或胃食管交界部癌[4].目前,食管癌的化疗联合免疫疗法已经在临床研究有了突破,但是小分子药物因其简单方便仍然具有不可替代的优势.
青蒿素是一种从菊科植物黄花蒿中提取到的倍半萜内酯类药物,它已被评定为世界上唯一有效治疗疟疾的药物.它的衍生物主要包括青蒿素甲醚(蒿甲醚)、青蒿素乙醚、双氢青蒿素以及青蒿琥酯等.青蒿素及衍生物不仅在抗疟方面有很好的作用,还能够抑制肿瘤细胞增殖,促进细胞凋亡,具有抗肿瘤作用.研究显示,蒿甲醚包含独特的内过氧桥结构,具有很好的抗肿瘤作用[5].因此,本研究通过CCK-8方法,探讨蒿甲醚对食管癌ECA-109细胞增殖的影响,探讨蒿甲醚的抗癌效果,从而为蒿甲醚在治疗癌症方面的作用机制以及临床应用提供理论依据.
1 材料和方法
1.1 实验材料及分组
食管癌细胞株ECA-109由西安秦岭天然产物开发与创新药物研究重点实验室成晓霞老师馈赠,细胞分成空白对照组(未处理组)、DMSO处理组、不同浓度的蒿甲醚处理组(0.1 μM、1 μM、10 μM、100 μM)六个组,处理时间分别为2 h、4 h、6 h和24 h.因蒿甲醚为脂溶性,溶解在DMSO试剂里,所以将DMSO单独加药设为阴性对照组.蒿甲醚(Artemether;71963-77-4)购自北京百灵威科技有限公司;RPMI 1640培养液(批号:SH30809.01)购自Hyclone公司;青霉素/链霉素(批号:SV30010)购自Hyclone公司;胎牛血清(批号:16060501)购自浙江天杭生物科技有限公司;Cell Counting Kit-8试剂盒(批号:C0038)购自碧云天公司;DMSO(批号:D4540)购自Sigma Life Science公司;PBS(批号:BF005)购自西安赫特生物公司;0.25%Trypsin(批号:SH30042.01)购自Hyclone公司.
1.2 主要仪器与设备
酶标仪(型号:Elx800)厂家为Gene Company Limited公司;流式细胞仪(型号:BD Accri C6)厂家为BD;二氧化碳培养箱(型号:Shell Lab 3503-02)厂家为Shell Lab;倒置显微镜(型号:Olympus CorporationCKX41)厂家为Olympus;生物安全柜(型号:SG403A-HE-INT)厂家为Baker Company.
1.3 CCK-8细胞增殖检测方法
该方法是一种基于WTS-8的快速高灵敏检测试剂盒,广泛应用于检测细胞增殖和细胞毒性.将食管癌细胞株ECA-109铺板至96孔板,每孔接种8 000个细胞,加RPMI 1640培养液200 μL,放置37℃恒温培养箱培养24 h,待细胞贴壁生长至每孔孔底的80%以上.加药处理,设置空白对照组(不加药),阴性对照组(DMSO)以及药物处理照组(四组:不同浓度蒿甲醚溶液0.1 μM,1 μM,10 μM,100 μM),每个组设置5个复孔.加药2 h后,每孔加入20 μL CCK-8溶液,在细胞培养箱内继续孵育0.5h,用酶标仪在450nm处检测OD值,以及持续检测加药4h、6h以及24h的OD值.
1.4 数据及统计学分析
以空白对照组(Untreated)、DMSO对照组与不同浓度的蒿甲醚药物处理组为横坐标,相对于DMSO组的OD值为纵坐标.黑色实心圆为空白对照组数据,灰色空心圆为DMSO组数据,黑色实心方块为蒿甲醚在0.1 μM浓度时数据,黑色实心上三角为蒿甲醚在1 μM浓度时数据,黑色实心下三角为蒿甲醚在10 μM浓度时数据,黑色实心菱形为蒿甲醚在100 μM浓度时数据.CCK-8独立性实验次数n=4,每次5个重复孔;采用GraphPad Prism 9软件进行统计学分析,两两比较采用T-test.*表示P<0.05,**表示P<0.01,***表示P<0.001.
2 实验结果
2.1 蒿甲醚处理2 h能够抑制食管癌细胞株ECA-109增殖
将处于对数生长期的食管癌ECA-109细胞铺板到96孔板,设置不加药的空白对照组、DMSO阴性对照组以及不同浓度的蒿甲醚实验组(0.1 μM,1 μM,10 μM,100 μM),处理2 h后,加入20 μL CCK-8试剂,反应0.5 h后采用酶标仪检测450 nm的光吸收值(OD值).结果表明(图1),浓度为100 μM的蒿甲醚对食管癌ECA-109细胞处理2 h后,对细胞增殖具有抑制作用,且相对于DMSO对照组具有统计学意义(P<0.05).
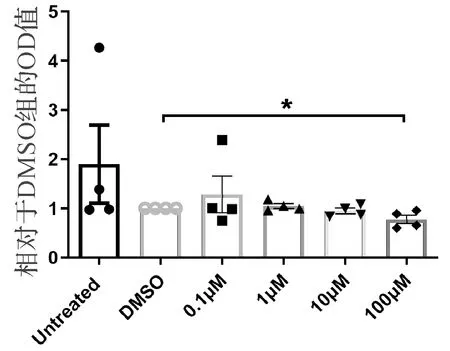
图1 不同浓度的蒿甲醚处理2 h对食道癌细胞株ECA-109增殖的影响
2.2 蒿甲醚处理4 h能够抑制食管癌细胞株ECA-109增殖
将处于对数生长期的食管癌ECA-109细胞铺板到96孔板,设置不加药的空白对照组、DMSO阴性对照组以及不同浓度的蒿甲醚实验组(0.1 μM,1 μM,10 μM,100 μM),处理4 h后,加入20 μL CCK-8试剂,反应0.5 h后采用酶标仪检测450 nm的光吸收值(OD值).结果表明(图2)浓度为100 μM的蒿甲醚对食管癌ECA-109细胞处理4 h后,对细胞增殖具有抑制作用,且相对于DMSO对照组具有统计学意义(P<0.01).

图2 不同浓度的蒿甲醚处理4 h对食管癌细胞株ECA-109增殖的影响
2.3 蒿甲醚处理6 h显示出抑制食管癌细胞株ECA-109增殖的趋势
将处于对数生长期的食管癌ECA-109细胞铺板到96孔板,设置不加药的空白对照组、DMSO阴性对照组以及不同浓度的蒿甲醚实验组(0.1 μM,1 μM,10 μM,100 μM),处理6 h后,加入20 μL CCK-8试剂,反应0.5 h后采用酶标仪检测450 nm的光吸收值(OD值).结果表明(图3),浓度为100 μM的蒿甲醚对食管癌ECA-109细胞处理6 h后,对细胞增殖具有抑制作用的趋势,但没有统计学意义(P=0.07).

图3 不同浓度的蒿甲醚处理6 h对食管癌细胞株ECA-109增殖的影响
2.4 蒿甲醚处理24 h抑制食管癌细胞株ECA-109增殖的效果减弱
将处于对数生长期的食管癌ECA-109细胞铺板到96孔板,设置不加药的空白对照组、DMSO阴性对照组以及不同浓度的蒿甲醚实验组(0.1 μM,1 μM,10 μM,100 μM),处理24 h后,加入20 μL CCK-8试剂,反应0.5 h后采用酶标仪检测450 nm的光吸收值(OD值).结果表明(图4),浓度为100 μM的蒿甲醚对食管癌ECA-109细胞处理24 h后,对细胞增殖没有显著抑制作用.
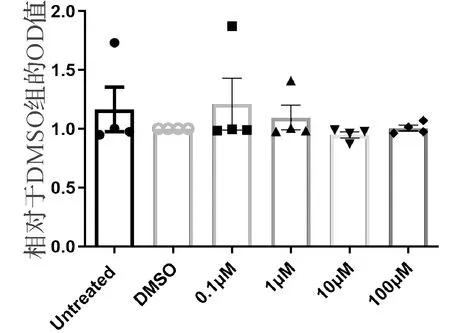
图4 不同浓度的蒿甲醚处理24 h对食管癌细胞株ECA-109增殖的影响
3 结论
食管癌是消化道肿瘤最常见的恶性肿瘤之一,随着医学技术的进步,在临床治疗取得很大进展.目前治疗肿瘤的主要方法有手术治疗以及化学治疗,但这些治疗手段只能抑制病情的发展速度,不能彻底治愈,而且这些方法对患者的身体也会造成伤害[1].因此,寻找一种对身体毒性低,副作用小的小分子化合物尤为重要.青蒿素是从植物黄花蒿茎叶中提取出来的一种无色晶体,主要用来进行抗疟治疗.通过对青蒿素修饰改造产生的衍生物也应用于抗疟治疗中.研究表明,青蒿素及其衍生物可以抑制多种肿瘤细胞的增殖,具有抑制肿瘤生长的作用[6].而且,青蒿素类药物副作用低,毒性小,联合其他化疗药物治疗肿瘤的效果加倍,据此我们检测蒿甲醚对食管癌细胞株ECA-109增殖的抑制作用.
在本研究中,我们通过CCK-8法测定不同浓度梯度及不同时间梯度的蒿甲醚对食管癌ECA-109细胞增殖的影响.实验结果表明,与DMSO阴性对照组相比,在蒿甲醚浓度为100 μM,处理2 h以及4 h后对ECA-109细胞的增殖有抑制作用,且数据具有统计学意义(P<0.05).在浓度为100 μM的蒿甲醚对食管癌ECA-109细胞处理4 h后增殖抑制作用效果最为明显.这表明加入蒿甲醚进行药物处理后,细胞增殖受到抑制,随着作用浓度的增加,显示抑制作用增强,但处理24 h后,抑制效果消失,可能是时间较长药物效果消失.
青蒿素及其衍生物不管是在抗疟疾还是抗肿瘤的治疗中,都是最近研究的热点[7].近年来,食管癌的发病率及其死亡率越来越高,但治疗手段依然没有较大突破,而蒿甲醚对食管癌ECA-109细胞增殖抑制作用的发现,不仅在临床前研究方面提供了科学依据,而且为食管癌的临床治疗提供了新思路.
