机械感受器Piezo离子通道激活与调控机制
2022-08-18郭雨松
郭雨松
华中科技大学 同济医学院基础医学院,武汉 430030
生物体感受外界机械刺激并做出正确的反应对其维持正常生理功能十分重要。将环境中的机械信号转化为电化学信号的过程称为机械转导,是触觉、听觉、机械痛觉等感觉形成的核心信号转导过程,也是渗透压调节等机体稳态维持的关键途径。完成机械转导这一重要功能的分子机器即生物体的机械感受器,在机体中分布广泛而稀疏,因此与集中于特定感觉器官的其他感受器(如视网膜上的光感受器,味蕾、鼻黏膜上的化学感受器)相比,研究难度更大。长期以来,人们在细菌、线虫、果蝇等模式生物中找到了一些机械敏感分子,但其在哺乳动物中没有同源蛋白,或者有同源蛋白但其并不具有机械敏感特性[1]。直到2010年,美国加州Scripps研究所Ardem Patapoutian教授研究组首次在哺乳动物中鉴定了介导机械转导的蛋白分子,并命名为Piezo(希腊语意为“压力”)[2]。
Piezo是一类大型跨膜蛋白,在细胞膜上以三聚体组成机械力门控的离子通道[3-6]。Piezo通道受力时激活,打开孔道使阳离子通过,并存在失活现象(inactivation),即在作为门控刺激的机械力持续存在的情况下,Piezo通道依然会在打开后迅速自发关闭[7]。基于细胞膜内外的离子浓度和电化学势,在一般生理条件下,通过Piezo的离子主要包括流入细胞的钠离子和钙离子。因此,Piezo通道开放可以具有两种效应:改变膜电位,可引起其他电压门控的离子通道开放,进而触发动作电位;同时,改变细胞内钙离子浓度,钙离子作为第二信使引发下游信号转导通路。
Piezo在哺乳动物中有两个亚型,Piezo1和Piezo2,两者均具有机械敏感性,在人体各组织中广泛分布,并具有多种重要生理功能[8]。Piezo1目前发现参与淋巴管[9-10]和血管[11]等内皮的发育和形态建成、红细胞渗透压调节[12-14]、神经元轴突生长及再生[15]、神经干细胞基于环境的分化[16]、肺毛细血管中的静水压响应[17]及泌尿系统功能[18-20]等。Piezo2与Piezo1结构类似[21],但电生理特性不同,主要表现为失活更快[2,22]以及对Yoda1等激动剂不敏感[23]。Piezo2主要在触觉[24-26]、本体感觉[27-28]、痛觉[29-31]的产生和传递中发挥关键作用。Piezo1和Piezo2还共同调节颈动脉窦-主动脉弓压力感受性反射[32]、关节软骨发育和损伤信号转导[33-35]、消化道功能[36-37]等。
可见,Piezo与机体健康密切相关。正因为此,发现并深入研究Piezo的Patapoutian教授被授予2021年诺贝尔生理学或医学奖。目前发现的Piezo1突变可造成红细胞或淋巴管发育异常疾病[38],而Piezo2突变疾病则表现为本体感觉缺陷、远端关节挛缩畸形[39]等。Piezo的表达水平和功能异常可使上述多种重要生理功能发生紊乱,与高血压[40]、慢性疼痛、偏头痛[41]等疾病高度相关。值得注意的是,Piezo通道可通过影响血管生成[42]、细胞增殖迁移[43]以及免疫调节[44]等途径而影响多种肿瘤的发生发展[45]。因此,阐明Piezo激活与调控的工作机理,将从调节机械转导的角度为相关疾病的诊断、治疗、药物研发带来新思路和新靶点。
1 经典的机械门控原理
在Piezo通道发现之前,人们已经针对其他已发现的机械敏感离子通道进行了大量电生理学、生物化学和结构生物学等方面的研究,其中研究最充分的是细菌中的MscL通道[46-47]。MscL是细菌的“压力应急阀”,当细菌受到较大渗透压变化时打开巨大孔道,使大量物质通过,迅速平衡细胞膜两侧的渗透压差,使细胞免于破裂。通过比较MscL通道在打开和关闭两种状态之间的构象差异[48-51],人们发现,MscL打开巨大孔道的过程中,在膜平面上的横截面积增加了约20 nm2。在膜受到张力的情况下,这一面积增加使得整个通道-膜系统的自由能下降,从而使通道的打开构象在受力情况下更为稳定[52]。该系统从通道关闭到打开这一过程中的自由能变化可以用以下公式来描述:
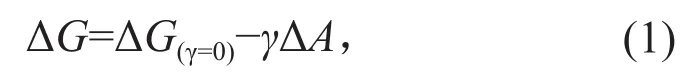
其中ΔG(γ=0)即系统在张力为0时的自由能变化,γ为膜所受到的张力,ΔA为通道打开过程中膜平面上的横截面积变化[53]。从这个公式可以得到:
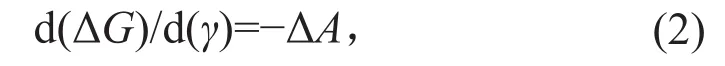
即相对于通道的关闭状态,其打开构象的稳定性(ΔG)与膜所受到的张力(γ)成正比,而比例常数正是膜平面上的横截面积变化。也就是说,通道从关闭到打开过程中在膜平面上的横截面积增加越大,其对机械力越敏感。这一发现奠定了机械门控原理的物理基础。
人们通过对MscL通道的机械门控原理研究建立了一个经典的“force from lipids”模型[54],即通道门控所受到的力来自于磷脂双分子层中脂质分子与通道蛋白之间的相互作用,不需要其他蛋白质的参与。这一模型随后在其他机械敏感通道的门控研究中也有报道,比较典型的包括机械敏感钾离子通道K2P(如TRAAK)[55-56]。人们发现,K2P跨膜横截面积也随孔道打开而扩张,可达2.7 nm2,从而使通道的开放构象在受力时能量上更稳定。晶体结构中还可以直接观察到磷脂分子与通道蛋白的特异性结合[56]。
此外,机械门控通道还可以与其他蛋白质高度关联,包括细胞外的基质蛋白以及细胞内的细胞骨架[57]。来自胞内外的力可通过这些栓系蛋白传递到机械门控通道上,这一作用模式被称为“force from filament”或栓系模型。比较典型的是内耳毛细胞上的听觉通道与微绒毛的肌动蛋白纤维之间的栓系[58],在线虫、果蝇、斑马鱼等模式生物中发现的一类TRP通道NOMPC与胞内的微管之间也存在明确的物理和功能联系[59-60]。
Piezo通道如何进行机械门控?Piezo门控机制与已知模型有什么区别和联系?这些信息将如何帮助我们理解机械传导过程及相关疾病?围绕这些问题,人们运用了多种先进技术方法从不同角度开展了大量研究。
2 研究方法
结构与功能相结合一直是蛋白质工作机制研究的有效手段,离子通道也不例外。不管是获得2003年诺贝尔化学奖的第一个离子通道结构[61],还是前文提到的MscL机械门控机理研究,结构生物学提供的直观构象信息都发挥着至关重要的作用。要阐明Piezo通道如何受力开放,我们同样需要从这两方面入手。
在功能方面,以膜片钳技术为主体的电生理学是离子通道研究的经典方法。Piezo通道发现之初,其基本通道特性即通过电生理学被阐明,包括离子选择性、电导率、激活及失活的时间常数、压力激活曲线等[2,7]。在此基础上,人们探索了不同的施力方法,以模拟Piezo在复杂多样的生理环境中响应位移、形变、震动、渗透压、剪切力等不同机械刺激的场景,包括小滴脂双层(droplet lipid bilayer)[62]、弹性微柱阵列(elastomeric pillar array)[63]、磁力[22,64]、超声[65-66]、原子力显微镜[67-68]等。小分子激动剂或抑制剂是离子通道研究的重要工具,同时也是药物开发的潜在先导分子。针对Piezo通道的小分子药物筛选,目前已发现以Yoda1为代表的一系列Piezo1特异性激动剂[23,69],尽管其作用机理还未知,但已为Piezo相关的细胞、生理、病理等各类研究提供了极大便利[70-71]。
在结构方面,随着冷冻电镜技术的发展,包括离子通道在内的膜蛋白结构解析工作大大加速。目前小鼠Piezo1[4-6](图1)和Piezo2[21]关闭构象的高分辨率结构均已解析,为理解Piezo工作机理提供了核心支持。不过,通道门控是一个动态过程,而目前Piezo结构解析仅捕捉到静态构象。原子力显微镜则能够在给样品施加力的同时进行实时成像,其在XY平面上分辨率约为1 nm,为高分辨率的静态结构提供了很好的补充[68]。值得一提的是,随着高质量结构数据的增多,以实验结构为起点、基于经典牛顿力学运动的分子动力学模拟近年来发展迅速。尤其针对Piezo的受力动态过程,在当前实验技术的限制下,分子动力学模拟有其独特的优势[72]。
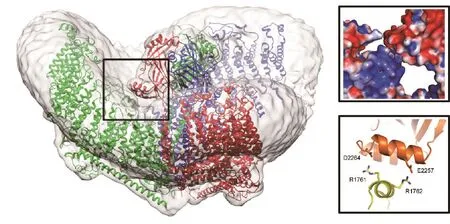
图1 Piezo1关闭状态结构。小鼠Piezo1三聚体结构模型(PDB ID 6B3R),三个亚基分别为红、绿、蓝,灰色为电子密度图。黑色方框所示为C端胞外结构域与一个旋臂之间的静电相互作用区域。右上小图为左图黑框部分的表面静电势图,最蓝为电势值+2 kBT/e,最红为电势值-2 kBT/e。右下小图为左图黑框部分的丝带模型图,其中参与静电相互作用的关键氨基酸由棒状模型显示(修改自参考文献[4])
3 “膜穹顶”激活机制
利用上述研究方法,目前,Piezo机械激活机制的基本原理已经有了被广泛认可的解释。根据多个冷冻电镜结构[4-6,21],Piezo通道由蛋白三聚体组成,共有114条跨膜螺旋,是目前已知最大的膜蛋白之一。Guo和MacKinnon发现,Piezo关闭构象中,三辐对称的庞大旋臂围绕中央的孔道,将整个通道及附近的去垢剂胶束或磷脂双分子层弯曲成圆顶状,由此提出了“膜穹顶机制(membrane dome mechanism)”:Piezo通道通过曲率变化来控制开关,受力时弯曲的Piezo通道变得较平并打开孔道,其在膜平面上的投影面积变化与其机械敏感度成正比[4]。这一过程可表示为:
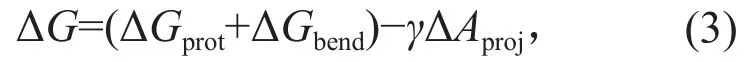
其中,ΔGprot和ΔGbend分别是从通道关闭到打开过程中来源于Piezo蛋白和细胞膜的自由能差,ΔAproj为Piezo关闭到打开构象在膜平面上的投影面积变化。ΔGprot为正值,即不受力时Piezo蛋白倾向于保持在弯曲关闭的状态,而ΔGbend为负值,即不受力时磷脂膜倾向于展平,这两者相互抵消。ΔGprot绝对值比ΔGbend略大,使ΔGprot+ΔGbend为一个正值,即当张力γ为0时,整个通道-膜系统的自由能差ΔG为正,通道从关闭到打开的过程不会发生。而当张力γ逐渐增加,直至γΔAproj这一项的绝对值大于ΔGprot+ΔGbend时,整体自由能差ΔG为负,通道打开的过程即会发生。
由此可见,虽然与MscL相比,Piezo打开的是一个只允许阳离子通过的小孔径通道[2],电导率约为MscL的1%[73],仅通过打开孔道获得的横截面积有限,但Piezo具有巨大的曲率,受力时可以通过变平而使得Piezo-膜系统在膜平面上的投影面积(Aproj)发生巨大变化(图2),由此获得极高的机械敏感性。
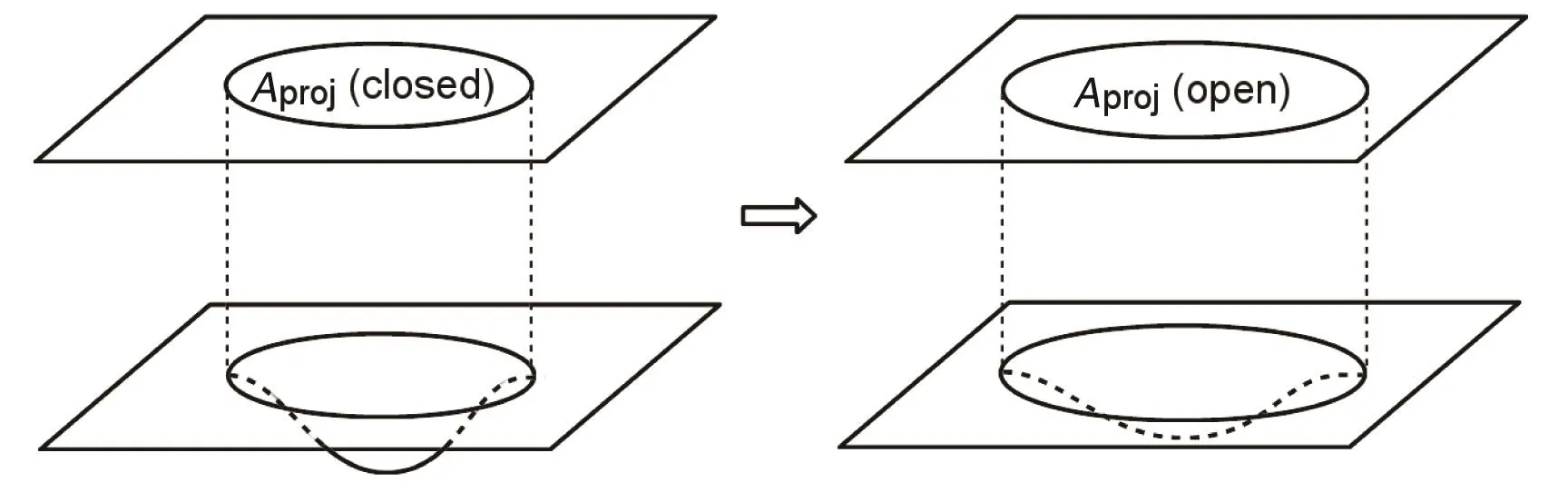
图2 Piezo膜穹顶机制。从关闭(左图)到开放(右图)过程中,Piezo通道与膜系统的投影面积(上层平面)随膜曲率(下层平面)变化(修改自参考文献[4])。
MacKinnon研究组进一步与Scheuring研究组合作证实了Piezo在受力时变平的可逆构象变化[68]。首先通过脂质体成像明确Piezo在磷脂环境中曲率可变,并使用高速原子力显微镜精确定量地描绘Piezo膜穹顶机制:受力时变平,在膜平面上的面积增大;力撤走后恢复弯曲,膜平面上的面积减小。此外,由实时受力值、形变值、自由能差推算得到的Piezo打开概率为50%的张力值,与电生理数据相符,支持了原子力显微镜在机械敏感离子通道定量研究中的可行性。
Piezo膜穹顶机制假设随后由更多团队从不同角度提供了依据。在Piezo的弯曲构象中,通道中央的C端胞外结构域(CED)中有一片富含负电荷的区域,与旋臂的胞外卷曲中一片富含正电荷的区域具有静电相互作用(图1黑框部分,图3)。破坏该静电作用可使旋臂更容易变平,根据膜穹顶机制预测,即会使得通道更容易打开;相反,如果通过半胱氨酸突变在这两片区域之间引入二硫键,则会使旋臂保持在弯曲状态,据预测将会阻碍通道打开。Grandl研究组的电生理学测量结果正是如此[74]。Luo和Kalli研究组分别在不同的环境设定下通过分子动力学模拟了Piezo1的打开构象[75-76]:不论是由分子聚集(crowding-induced)还是直接增加膜张力引起的通道开放,Piezo的旋臂都呈现出变平、延展的构象。最近,肖百龙教授研究组解析了Piezo1在磷脂中处于受力平展状态的中等分辨率结构,进一步证实Piezo受力变平的构象变化,并提示了跨膜螺旋等主体结构模块受力时的变化轨迹(图3)[77]。由于孔道部分的分辨率限制,此状态下的Piezo是否开放还不明确。基于Piezo快速失活的特性,在脂质体中稳定受力的Piezo可能处于孔道关闭的失活状态。
图3 Piezo受力时的结构重排模型。左图为Piezo不受力时的弯曲构象(PDB ID 7WLT),右图为Piezo受力后变平的构象(PDB ID 7WLU),其中C端胞外结构域(CED)为橙色,位于CED与旋臂中发生静电相互作用的两段螺旋分别为品红和青绿色,形成孔道的内侧跨膜螺旋为红色,外侧跨膜螺旋为黄色,其他跨膜螺旋为灰色,灰度从N端到C端逐渐加深,胞内横梁(beam)为蓝色,序列在跨膜螺旋28号与29号之间的交叉螺旋(cross helices)为青色,孔道正下方的基座(base)和肘状(elbow)螺旋为柠檬绿色,发卡(hairpin)螺旋为绿色(结构数据来自文献[77])
以膜穹顶为起点进行的理论计算和模拟显示(图4),Piezo在穹顶以外的膜区域上可形成更大的膜足迹(membrane footprint)[78],其形状与几个关键要素相关:Piezo穹顶的基本形状(曲率)、膜的弯曲模量(硬度)、Piezo-膜系统所受的张力。膜足迹的存在使得Piezo可通过膜与邻近的其他Piezo分子进行相互作用,影响彼此在膜上的分布及门控特性。不同组织细胞甚至同一细胞上的不同膜区域具有不同的脂质成分,可通过其硬度的差异来调节Piezo的机械激活特性。此外,细胞骨架将细胞膜间隔成不同大小的自由区域,可因此改变Piezo膜足迹的形状大小,从而影响Piezo门控性质。

图4 Piezo膜穹顶与膜足迹。灰色部分为包含Piezo通道蛋白的膜穹顶,蓝色部分为纯脂质成分的膜足迹(修改自文献[78])
至此,关于Piezo激活的膜穹顶机制模型主体框架已基本明晰,但Piezo变平与使离子通透的孔道开放这两者之间的关联还没有确认。由于Piezo开放构象的结构还未解析,Piezo在受力开放时发生的具体变化,特别是孔道部分的结构细节还没有明确。肖百龙教授研究组对此做出许多国际领先成果,结合Piezo1[6]、Piezo2[21]和相关异构体[79]的关闭构象以及Piezo1平展构象[77]的结构信息和电生理功能研究,针对Piezo受力后各结构域的相互运动关系,目前已提出功能区模块化作用[80]、杠杆作用[69]、双门控作用[21]、以及门塞和闩锁作用[79]等多个机制假说(图3)。
在上述膜穹顶机制的基本原理基础上,我们可以深入理解Piezo通道在不同组织器官中,响应不同机械刺激并发挥不同生理功能的精细调控机制。
4 调控机制
目前在哺乳动物中鉴定明确的机械敏感离子通道非常有限。TRAAK通道几乎只分布在郎飞结(node of Ranvier),且作为钾离子选择性通道,只能引起膜电位的超极化和复极化,不能在受力时触发动作电位[81]。TMC1/2最近被确认为听觉通道[82],但听觉以外的功能只在对线虫、果蝇和斑马鱼研究中有报道[83]。许多TRP通道对机械刺激有一定的响应,其中TRPN/NOMPC在线虫、果蝇等模式生物中被明确为机械敏感离子通道[84-86],但相应的机械传导功能表型并没有在哺乳动物中发现。植物机械敏感通道OSCA在动物中的同源蛋白TMEM63使异源表达293细胞获得机械敏感性,其机械转导的生理功能尚有待鉴定[87]。最近有报道认为哺乳动物TACAN蛋白为机械敏感通道[88-89],但多个独立团队展示了相反的实验结果[90-92]。
与此形成鲜明对比的是Piezo通道在哺乳动物中极其广泛的组织分布及复杂多样的生理功能[2,93]。这就意味着Piezo1和Piezo2这仅有的两种Piezo通道需要依靠十分精细的调控来适应体内不同的机械环境,包括力刺激的强度、形式、频率等,从而保证机体对这些机械刺激做出适当的反应。目前已发现Piezo在不同细胞类型中可具有差异明显的动力学特征[94-96]。具体生理环境中,细胞膜成分、细胞内外的相互作用分子、细胞骨架及胞外基质等可能共同决定相同的Piezo分子具有特异性的通道特征并在相应环境中行使相应的机械传导功能,而Piezo动力学的具体调控机制以及相应的生理功能目前还在积极的研究当中。
4.1 Piezo蛋白
蛋白质本身的氨基酸序列、理化性质变化可直接影响Piezo通道门控特性,这正是Piezo突变造成各类遗传疾病的原因[97]。在生理条件下,Piezo也可以通过可变剪接改变其序列从而实现功能的精细调控。Piezo2在非神经元组织中主要表达为一种异构体,而在不同类型的神经元中呈现多种剪接类型,并在离子通透性、对钙离子的敏感性以及失活特性等方面均有明显差异[98]。不同剪接异构体之间的区别主要是结构尚未解析的几段胞内序列的差异缺失,可能参与来自细胞骨架的力传递[99]。对于Piezo1,其“门塞”部分被剪接去除后形成异构体Piezo1.1,单通道电导升高,机械敏感性增加,且可以与野生型Piezo1形成异源三聚体,并具有中等水平的电导值[79]。
根据Piezo膜足迹预测,相互聚集的Piezo会影响彼此的门控[78]。有STORM超分辨成像显示Piezo在质膜上聚集成簇,且聚集动态受胆固醇影响,而去除胆固醇可降低Piezo的机械敏感性和激活速率[100]。在分子动力学模拟中,Piezo的膜足迹可相互重叠,从而降低膜曲率,使通道在不受力的状态下开放[75]。初步细胞膜片钳实验却发现,不同密度的Piezo分布对其机械敏感性没有明显影响[101]。膜上的通道密度对Piezo具体产生什么作用,还需要更多研究探索。
翻译后修饰是蛋白质功能调节的常见机制。对于离子通道,修饰一方面可通过改变胞内运输而影响细胞膜上的通道数量;另一方面可通过调节通道动力学来影响通道的活性[102-103]。目前关于Piezo翻译后修饰的报道还较少,有研究发现Piezo胞外结构域上的两个天冬酰胺残基可发生N-连接糖基化,并影响Piezo在胞内的有效运输[104]。
4.2 脂质
首先要明确的是,Piezo感受机械力这一根本功能并不需要其他蛋白质参与。Patapoutian研究组将纯化的Piezo蛋白重构到脂质体当中,在不同磷脂成分、渗透压等条件下对Piezo脂质体或小滴脂双层进行电生理测量[62,105],证实了Piezo蛋白自身即可组成具有功能的机械敏感通道,不需要其他辅助蛋白形成通道复合体,或依赖胞外基质或细胞骨架进行力的传递,符合“force from lipids”模型。在这一模型中,脂质可以直接对通道功能起到调控作用。
膜穹顶机制可以预测脂质对Piezo激活过程产生怎样的影响[4,68,78]。以一个简化的模拟场景为例,从公式(3)中可以看到,通道从关闭到打开过程的自由能差,与来自磷脂膜的内在自由能变化值ΔGbend相关。较硬的磷脂膜,较容易保持在展平的状态,其ΔGbend的负值较大,那么较小的张力即可以使通道-膜系统整体自由能差为负,从而让通道打开。也就是说,其他条件不变的情况下,使磷脂膜变硬的因素可让Piezo通道对机械力更敏感。考虑到Piezo膜足迹,则脂质的成分和硬度对Piezo门控的影响更为复杂、显著[78]。此外,脂质还可能通过直接结合Piezo蛋白或改变膜的曲率对Piezo造成影响。
在实验中人们已经观察到了许多脂质对Piezo的调节现象。饮食中常见的饱和脂肪酸十七烷酸可增加膜硬度并抑制Piezo激活,而多不饱和脂肪酸二十碳五烯酸则可以降低膜硬度并调节Piezo的失活效应[106]。磷脂酰肌醇及其磷酸盐(PIPs)是重要信号分子,其缺失可抑制Piezo功能[107-108]。通过药物去除质膜中的胆固醇可使Piezo电流减弱,对机械力敏感性降低[95,100]。质膜中的鞘磷脂被鞘磷脂酶水解为神经酰胺后,因脱去磷酸头部而改变膜曲率,此时Piezo失去其快速失活特性而保持在激活状态[109]。此外,机械敏感通道的非特异性抑制剂GsMTx4蜘蛛毒素[110]和阿尔茨海默病的致病因子之一Aβ肽[111],都可能是通过其两亲性来改变磷脂膜性质,从而影响Piezo功能。
在上述电生理实验中,来源于细胞膜的膜片脂质成分难以控制,且存在细胞内多种其他因素的干扰。要明确脂质对Piezo的作用,需保证实验中的膜性质参数稳定,最好使用成分明确、可调的巨大脂质体(giant unilamellar vesicle,GUV),但Piezo通道在GUV中的电生理测量目前稳定性和可重复性还较低,不能满足计算精度的要求,因此脂质成分完全可控的脂质体电生理研究还很有限[105]。
分子动力学模拟针对脂质对Piezo的作用提供了一些新角度。包括Piezo和磷脂膜系统的多项模拟研究发现Piezo中一系列与胆固醇和磷脂酰肌醇-4, 5-二磷酸(PIP2)的结合位点,其中包括与疾病相关的多个关键氨基酸残基[75,112-113],其实际生理病理意义有待进一步鉴定。
4.3 互作蛋白
尽管Piezo不需要其他蛋白就可以完成机械传导的基本功能,但Piezo与其他蛋白的相互作用可从多个方面对Piezo的受力激活过程产生影响,包括直接与Piezo发生物理联系,以及通过改变Piezo所处的环境间接调节Piezo功能。
与多囊肾病相关的Polycystin-2蛋白在肾小管上皮细胞中可抑制Piezo电流,且在瞬时转染的COS细胞中与Piezo1存在免疫共沉淀现象[18]。可结合胆固醇的STOML3蛋白能够调节Piezo机械敏感性,并在过表达的HEK-293细胞中与Piezo1和Piezo2均可发生免疫共沉淀[63]。Schmidt研究组通过免疫亲和纯化和高分辨率质谱获得了Piezo2在小鼠背根神经节中的互作蛋白组,并从中鉴定了中心体蛋白Pericentrin[114]和磷脂酰肌醇磷酸酶Mtmr2[108]与Piezo2在细胞中共定位,并可以调节Piezo电流。肌质网钙离子ATP酶(SERCA)与Piezo1之间的相互作用通过免疫共沉淀和荧光共定位得到确认,SERCA通过Piezo1/2中的一段linker连接序列对其产生抑制作用,并由此影响内皮细胞迁移[96]。
Piezo互作蛋白中比较特殊的一类即细胞骨架。由于细胞骨架可直接参与力的传导,人们很早就在关注Piezo受细胞骨架的影响。全细胞膜片钳实验中,使用细胞松弛素D破坏胞内肌动蛋白,可减弱Piezo电流[115]。在渗透压应激形成的缺乏细胞骨架的细胞膜泡(membrane bleb)中,Piezo更易被激活[116]。通过药物抑制肌球蛋白Myosin II可抑制Piezo产生的钙信号[16],而磷酸化靠近细胞外周的Myosin II可激活Piezo[117]。此外,作为基底板成分的Ⅳ型胶原可使Piezo对机械拉力更为敏感[67]。最新报道发现,cadherinβ-catenin复合体将Piezo1栓系到胞内肌动蛋白上[118]。药物破坏肌动蛋白骨架,siRNA敲降E-cadherin或β-catenin,或通过破坏E-cadherin与Piezo1多个结构域之间的分子间相互作用,均可显著降低Piezo1对机械力的敏感性。由此,在“force from lipids”主体模型的基础上,肌动蛋白的参与也为Piezo激活调控明确增加了“force from filament”的元素。
另有一类蛋白通过影响Piezo周围的脂质来调节Piezo功能。如:TRPV1通道激活可减少质膜中的磷脂酰肌醇,从而抑制Piezo[107];鞘磷脂酶水解鞘磷脂可改变膜曲率并调节Piezo失活。G蛋白偶联受体也被发现可调节Piezo活性,可能是通过Gβγ下游的磷脂酰肌醇激酶PI3K改变其PIP2产物的含量[119]。前述Piezo的直接互作蛋白也可以同时改变Piezo脂质环境,如STOML3可减少质膜中胆固醇[95],Mtmr2可调节PIP含量[108],即同一调控蛋白可能存在多个作用模式。
4.4 小分子药物
针对Piezo通道的药理学研究进展比较缓慢。最早经过高通量筛选发现的Piezo1特异性激动剂Yoda1,可以显著提高Piezo1对机械力的敏感性,并减缓失活过程,但对Piezo2没有影响[23,70]。随后筛选得到的Jedi1和Jedi2结构类似,也是Piezo1的特异性激动剂,可提高Piezo1的机械敏感性,且效果可与Yoda1叠加,因此与Yoda1的作用位点可能不同[69]。在Yoda1结构基础上进行改造得到的Dooku1[120],以及从中药提取物筛选得到的土贝母皂苷甲[121],均是Yoda1的拮抗剂。目前还未见Piezo1特异性抑制剂或针对Piezo2的小分子药物。
关于这些小分子药物调节Piezo功能的机制还不明确。有表面等离子共振(surface plasmon resonance, SPR)实验提示Yoda1、Jedi1和Jedi2直接与Piezo1结合[69]。分子动力学模拟在Piezo1中央孔道外约40 Å定位了一个Yoda1的结合口袋,且结合Yoda1的旋臂在受到张力时伸展变平的位移比未结合Yoda1的旋臂更大,从而对机械力更敏感[122]。但是这个模拟的结合口袋序列在Piezo1和Piezo2之间是保守的,无法解释Yoda1对Piezo1的特异性。此外,也有观点认为,Yoda1具有疏水性,可能通过改变磷脂膜的性质间接影响Piezo1功能,而这同样留下关于特异性的疑问[23]。
对于小分子调节剂的筛选、设计以及作用机制的研究是未来将其应用于Piezo相关药物干预的重要基础,还有待于多个交叉领域的共同探索[123]。
5 总结和展望
从2010年Piezo通道被发现以来[2],围绕其通道特性、生理功能,以及相关疾病的研究层出不穷。关于Piezo最核心的机械激活过程,膜穹顶机制较好地解释了其基本原理[4]。Piezo具有特征性的高度弯曲构象,在受力时Piezo曲率降低,在膜平面上的投影面积增大。根据细菌MscL通道的相关研究,机械门控离子通道对机械力的敏感性与其在膜平面上的面积变化成正比(公式(1)和(2))[47-48,50]。Piezo通道正是可以通过曲率的变化在保持阳离子选择性的小孔道条件下获得极大的机械敏感性。
Piezo受力变平是一个形态上的整体变化,具体到三个亚基各个结构域的运动细节还有待Piezo开放构象的实验结构解析。目前门控机制研究得较为清楚的离子通道,通常都有其开放和关闭等不同状态的高分辨率结构信息作为解释门控分子机理的关键依据。在机械门控通道领域,同样是开关构象均已解析的MscL通道向人们揭示机械敏感性与膜平面上通道横截面积变化的关系,奠定了理解机械门控离子通道的物理基础[48]。包括Piezo在内的其他机械门控离子通道,虽然许多已有关闭构象的结构被解析[59,124-127],但由于缺乏开放构象,一系列基于突变及电生理实验观察的结构功能关系研究[6,69,79],以及分子动力学模拟的机制假说[76,112-113,122]无法得到明确的证实。对于配体敏感的通道或受体分子,加入相应的配体通常即可使其处在激活状态,用于后续的结构研究。对于机械敏感通道,虽然大量筛选结晶条件有可能获得通道处于激活状态的晶体类型(如MscL和K2P)[48,56],但膜蛋白结晶依然困难较大。在目前主流的冷冻电镜结构解析过程中施加机械力仍是一项挑战。选择特定脂质重构纳米盘(nanodisc)在细菌MscS通道研究中有所应用[128],但推广到Piezo在内的其他机械敏感通道仍存在技术限制。最近解析的Piezo平展结构使用的是蛋白脂质体样品,虽然受力状态稳定,但6.8 Å的分辨率尚不足以揭示孔道打开的细节[77],需要在样品制备、数据收集及处理上进行更多探索。
此外,Piezo通道失活现象的具体机制同样尚不明确。目前发现膜电位[74]、膜成分[106,109]、环境pH值[129]、细胞类型[94]、小分子药物[23]等都可以影响失活过程的有无或快慢。Piezo通道的失活异常可由C端胞外结构域及形成孔道的内侧跨膜螺旋中几个关键氨基酸的点突变所导致[22,74,130-131],并且与红细胞脱水性贫血等许多疾病相关[38,132-134]。Piezo静息/关闭-开放-失活的完整受力状态变化循环的过程及其具体机制还缺失许多重要信息。
在研究Piezo机械门控机制的基础上,人们可以更好地理解Piezo的功能如何受其环境调控。膜穹顶机制解释并预测了一系列在电生理等实验中观察到的Piezo调控现象,包括膜硬度、磷脂成分、通道密度等对Piezo机械敏感性的影响,为人们深入理解Piezo功能并针对性地进行调控奠定了基础。此外,Piezo蛋白本身的机械属性、小分子药物、互作蛋白等都对Piezo功能提供了更为复杂精细的调节空间,有待更加深入、充分地研究探索。
Piezo功能异常与多种疾病相关,包括对个人生活质量和社会经济都造成重大负担的肿瘤、心血管疾病、慢性疼痛等。因此,我们期望针对Piezo功能调控的相关研究能够有助于从纠正机械转导的角度为这些疾病的防治提出新思路。需要注意的是,Piezo在人体各组织中分布广泛,直接靶向Piezo的药物很可能会对非病变组织中的Piezo造成影响,从而导致各种副作用。因此,以目标组织中特异的Piezo调控机制作为靶标,比如通过抗体或小分子药物特异性地阻断Piezo与某种互作蛋白之间的物理联系,可能是更好的选择。
