锌基-MOFs对氨吸附制冷性能的分子模拟研究
2022-08-18苏亭宇王丽伟吴韶飞刘治鲁
苏亭宇 王丽伟 吴韶飞 张 宸 刘治鲁
(1 上海交通大学中英国际低碳学院 上海 201306;2 上海交通大学制冷与低温工程研究所 动力机械与工程教育部重点实验室 上海 200240;3 华中科技大学能源与动力工程学院 武汉 430074)
据国际能源署统计,目前全球使用传统压缩式空调和电扇制冷所消耗的电能约占建筑用电的20%[1],不仅对电力系统造成巨大的压力,也大幅增加了全球碳排放。吸附式制冷可以利用太阳能、工业余废热等低品位热能实现制冷和制冰,从而有效降低制冷电能消耗,显著降低碳排放[2-3]。决定吸附式制冷性能的关键是选择合适的吸附剂/制冷剂工质对。基于氨沸点低、蒸发潜热大、成本低廉、臭氧消耗潜能(ozone depletion potential,ODP)和全球变暖潜能(Global Warming Potential,GWP)为零等特点,以氨作为制冷剂的吸附式制冷系统具有制冷量大、传质速度快、系统驱动力大等诸多优点,越来越多的研究人员使用氨作为吸附制冷系统的制冷剂[4]。对于吸附剂,相比沸石等传统吸附剂,具有更优异吸附性能的新型吸附剂金属有机骨架材料(MOFs)受到越来越多的关注[5-6]。
MOFs是由金属离子或金属簇与有机配体通过自组装连接形成的具有周期性网络结构的材料,具有比表面积大、孔隙率大等特点[7-8],在吸附[9-10]、催化[11-12]、生物医药[13-14]等方面具有广阔前景。根据结构和性能等方面的不同,MOFs材料可分为沸石咪唑酯骨架材料(ZIFs)[15-17]、网状金属有机骨架材料(IRMOFs)[18]、莱瓦希尔骨架材料(MILs)[19]等。
ZIFs是与沸石多孔材料具有相似骨架结构(Si-O-Si)的一类新型金属有机骨架材料。结构是用金属离子取代沸石骨架中的Si,咪唑酯环取代沸石骨架中的O,从而构成键角也为145°的M-Im-M骨架结构单元[20]。ZIFs材料结合了无机沸石的高热稳定性、高化学稳定性、耐水解和耐各种有机溶剂腐蚀的优点[21],可以通过调节金属离子及有机配体获得不同的结构和功能。其中ZIF-8(Zn)是目前研究广泛、具有代表性的一种ZIFs材料,因稳定性高、制备较简单、成本较低等优点[22],被应用于吸附分离[23-24]、气体储存[25-26]、催化[27-30]等多个领域。
近年来,很多研究人员对ZIF-8(Zn)进行了研究。J. Pérez-Pellitero等[31]模拟了ZIF-8(Zn)等几种不同多孔材料对CO2、CH4和N2等气体分子的等温吸附曲线,使用通用力场(universal force field,UFF)的模拟结果和实验结果具有很高的一致性,两者得以相互验证。Zhang Zhijuan等[32]研究了ZIF-8(Zn)吸附CO2的性能,并针对吸附量较小的问题对ZIF-8(Zn)进行了改性,使吸附量提高约两倍,同时H2O/CO2/N2吸附选择性也得到显著提高。胡江亮等[33]在研究中证明ZIF-8(Zn)具有良好的化学稳定性,能够在强酸、强碱和强极性的溶剂中保持结构稳定性,并得到了298 K下CH4/N2的分离因子和吸附热。
目前,NH3在ZIF-8(Zn)中的吸附机理尚未研究,ZIF-8(Zn)/NH3工质对的制冷性能有待全面评价。因此,本文采用巨正则蒙特卡洛(Grand Canonical Monte Carlo,GCMC)方法探索了ZIF-8(Zn)吸附氨的微观机理。结合分子模拟的结果和吸附式制冷的热力学循环,研究了不同蒸发温度下ZIF-8(Zn)/NH3工质对的制冷性能,以期为MOFs/NH3工质对在吸附制冷中应用提供参考。
1 模型与吸附原理
1.1 分子模型与模拟
ZIF-8(Zn)由Zn离子与甲基咪唑酯中的N原子相连形成的ZnN4四面体结构单元构成,拓扑结构与方钠石(sodalite,SOD)类似[34]。ZIF-8(Zn)的单元晶胞含有276个原子,包含2个SOD笼,每个SOD笼直径为1.16 nm,SOD笼之间通过6个Zn原子组成的六元环笼口相连,六元环笼口直径为0.34 nm[35]。ZIF-8(Zn)的结构如图1所示。

图1 ZIF-8(Zn)结构
本文选用GCMC分子模拟方法[36],模拟NH3分子在ZIF-8(Zn)中的吸附特性。模拟输入文件包括力场文件、控制文件、ZIF-8(Zn)结构文件和NH3结构文件。力场文件中主要定义势能类型、单原子以及原子对的势能参数,不同原子之间的相互作用全部采用Lorentz-Berthelot规则计算,截断半径设为14 Å。ZIF-8(Zn)的Lennard-Jones(LJ)势能参数采用UFF力场,NH3采用TraPPE (transferable potentials for phase equilibria)的LJ参数[37];控制文件设置了模拟过程的各种条件,本文的模拟是Montecarlo(MC)类型,判断系统平衡的初始化步数设置为20 000步,用于状态统计的MC模拟步数也设置为20 000步;ZIF-8(Zn)结构文件主要定义该吸附剂原子位置和电荷,采用刚性模型的骨架结构,确定了分子构型、晶胞参数、每个原子的位置和电荷;NH3结构文件主要定义吸附质分子NH3的原子、键和角,NH3分子采用刚性分子结构模型,按照物化手册和其分子结构确定其结构文件。
其中,由于采用刚性分子模型,ZIF-8(Zn)与NH3的键伸缩能、键角弯曲能、二面角扭转能和键角面外弯曲能可忽略,各原子间的相互作用由范德华能和静电能组成,如下式所示[38]:
Etotal=EVDW+Eelec
(1)
(2)
(3)
以上各项参数通过计算及单位转换为标准单位后得到如表1所示的结果。

表1 ZIF-8(Zn)吸附NH3的原子势能参数
1.2 吸附制冷热力循环
依据多孔固体吸附剂对制冷剂吸附能力随温度变化而变化的原理,可以构建吸附式制冷热力循环。图2(a)所示为吸附热力循环的热力图,过程1-2-3-4代表吸附床内的相关变化,过程1-2-5-6代表制冷剂NH3的循环。吸附热力循环可以分为4个阶段,分别为图2(a)的等容加热过程(1-2)、等压解吸过程(2-3)、等容冷却过程(3-4)和等压吸附过程(4-1)。实际吸附制冷循环部件包括吸附床、冷凝器、储液罐、节流阀和蒸发器,循环示意图如图2(b)所示。
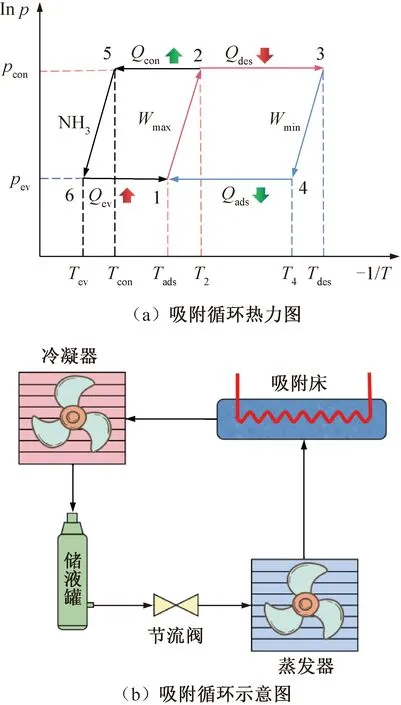
图2 吸附制冷循环图
等容加热过程(1-2):循环从处于低温的点1开始,吸附床被加热故温度升高,压力也逐渐升高到达到NH3冷凝温度对应的饱和压力pcon,该过程中吸附剂为完全饱和状态,吸附床与蒸发器、冷凝器之间的阀门保持关闭,吸附量保持最大值Wmax近似不变。
等压解吸过程(2-3):对吸附床加热使温度从初始解吸温度T2继续升高,从点2开始越来越多的NH3气体被解吸,解吸出的NH3气体在冷凝器中被冷凝,并放出热量Qcon(过程5-2)。由于在该过程中打开了吸附床与冷凝器的阀门,所以可以保持温度升高NH3气体溢出压力不变。当吸附床的温度升至最大值解吸温度Tdes且吸附量到达最小值Wmin时,该过程结束。
等容冷却过程(3-4):从点3开始吸附床被冷却温度下降,压力也逐渐降至NH3蒸发温度对应的饱和压力pev,该过程吸附床与蒸发器、冷凝器之间的阀门关闭,吸附量保持最小值Wmin近似不变。
等压吸附过程(4-1):继续冷却吸附床使其温度从初始吸附温度T4持续下降,同时打开吸附床与蒸发器之间的阀门,开阀导致蒸发器的压力突然变化从而使蒸发器中的液体NH3开始蒸发,吸收热量Qev完成制冷(过程6-1),蒸发后的气体制冷剂进入吸附床被吸附,直至吸附床的温度为吸附温度Tads,该过程完成,此时吸附床吸附的制冷剂吸附量再次达到最大值。吸附剂和制冷剂再次达到初始状态,之后可以循环往复地进行循环。
总体而言,该循环由吸附、蒸发和解吸、冷凝两个过程交替进行。可将每个循环分为两个阶段:工作过程和再生过程。工作过程是指吸附和蒸发制冷过程,再生过程是指解吸、冷凝,使吸附剂再生达到初始状态的过程。在该吸附式制冷系统中,蒸发和冷凝压力分别为NH3饱和状态下蒸发和冷凝温度下的压力,同时也分别与吸附压力和解吸压力相对应。初始解吸温度T2由该循环的最大吸附量Wmax和冷凝压力决定,初始吸附温度T4由该循环的最小吸附量Wmin和蒸发压力决定。即在该热力循环中,当蒸发、冷凝、吸附和解吸温度确定,循环的其余各项参数均可随之确定。
2 结果与讨论
2.1 吸附热力学特性
2.1.1 吸附量
研究图2所示的吸附循环,若点1处的吸附温度Tads为298 K,点3处的解吸温度Tdes为398 K,模拟这两个温度及303 K下不同压力的吸附情况,得到图3所示关于298、303、398 K下ZIF-8(Zn)吸附NH3的吸附等温线。由图3可知,随着压力升高,吸附量逐渐增加,但在分压力约为0.2时增长速度显著变缓。压力升高至饱和压力时ZIF-8(Zn)对NH3的吸附量为各温度下的最大值,此时298、303、398 K的最大吸附量分别为0.305、0.302、0.231 g/g。
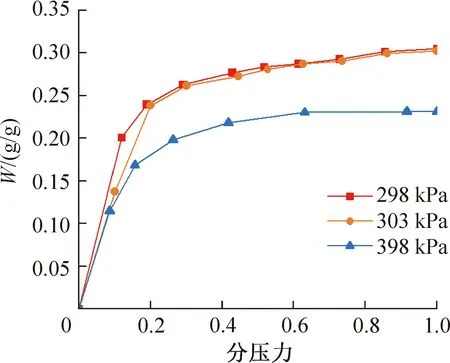
图3 ZIF-8(Zn)吸附NH3等温线
图4所示为615、857、1 167 kPa下在293~413 K的吸附等压线。由图4可知,随着温度的升高,吸附量逐渐减小,中间温度部分减小得最快,其吸附等压线呈“S”型。在图4所示的温度范围中,温度为293 K时吸附量最大,此时615、857、1 167 kPa下的ZIF-8(Zn)对NH3的吸附量分别为0.303、0.305、0.309 g/g。

图4 ZIF-8(Zn)吸附NH3等压线
相比于其他已被报道过的MIL-101(Cr)等MOFs材料[39],ZIF-8(Zn)对NH3的吸附量较低,其吸附等温线在上升阶段上升速率较小,等压吸附线最大吸附量也较小。分析发现这与ZIF-8(Zn)的孔径较小密切相关。1.1节提到,ZIF-8(Zn)结构与方钠石类似,SOD笼直径为1.16 nm,六元环笼口直径为0.34 nm。除此六元环形成的孔外,ZIF-8(Zn)还存在其他孔径的孔道[40]。对于孔径小于NH3临界直径为0.44 nm[41]的孔道而言,NH3分子难以通过孔道进入ZIF-8(Zn)的内部,可能会在其表面凝结形成液膜,所以ZIF-8(Zn)的自身结构限制了NH3的吸附量。
2.1.2 吸附热
吸附过程中NH3分子被ZIF-8(Zn)吸附放出的热量即吸附热,大小与吸附焓值相等。吸附热的大小不仅关系着吸附剂和吸附质的相互作用强度,还是解吸再生成本的重要衡量指标。总吸附热分为两个部分,分别为ZIF-8(Zn)与NH3相互作用产生的吸附热和NH3分子间相互作用产生的吸附热,如图5所示。当温度为298 K时,总吸附热随着分压力的增加而增加,约至40 kJ/mol后增长速度变缓,其曲线与吸附等温线的趋势相似。ZIF-8(Zn)和NH3相互作用产生的吸附热在不同压力下均维持在约15 kJ/mol,NH3自身相互作用产生的吸附热随着压力增大而不断增大。当温度为398 K时,总吸附热在压力增至饱和压力时增至36.65 kJ/mol,ZIF-8(Zn)和NH3相互作用产生的吸附热较为稳定地维持在约14 kJ/mol,NH3分子间相互作用产生的吸附热也随着压力升高而不断增大。总体而言,随着压力的增加,吸附热逐渐增加,这主要是NH3分子间相互作用的吸附热增加所致,而NH3分子间相互作用的吸附热随着压力的升高而增大可能与高压力下更多的NH3被吸附有关。
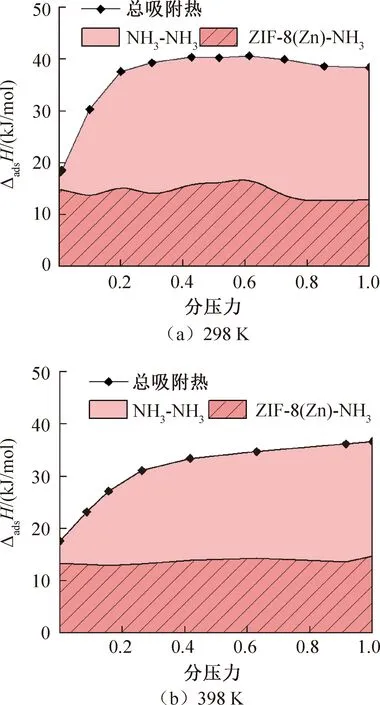
图5 不同温度下ZIF-8(Zn)和NH3的吸附热
2.1.3 吸附密度
图6所示为298 K和398 K不同压力条件下ZIF-8(Zn)吸附NH3的吸附密度分布示意图。图中为归一化处理后的吸附密度概率分布,颜色越深表示吸附密度越高。当压力较低时,大部分位置的颜色较浅,说明此时各位置的吸附密度较低。结合ZIF-8(Zn)的键和分子位置可知,此时金属位点附近和ZIF-8(Zn)分子笼的表面吸附密度较高。随着压力的增加,吸附密度分布示意图的颜色逐渐加深,说明吸附密度逐渐增加。特别是金属位点附近,压力增至饱和压力时,金属位点附近的吸附密度非常高,ZIF-8(Zn)分子SOD笼内部和表面的吸附密度均有增加。298 K和398 K的吸附密度分布图均符合以上规律。这也与2.1.1节中的吸附等温线变化规律相符。即同一温度下,随着压力的增加,各位置的吸附密度和吸附量逐渐增大。另一方面,通过对比温度、压力分别为298 K、1 003 kPa和398 K、857 kPa的吸附密度分布图可知,前者各位置的吸附密度较高,说明压力较高,温度较低的工况更适宜ZIF-8(Zn)吸附NH3分子,这与2.1.1节中的吸附等压线的分析相符。
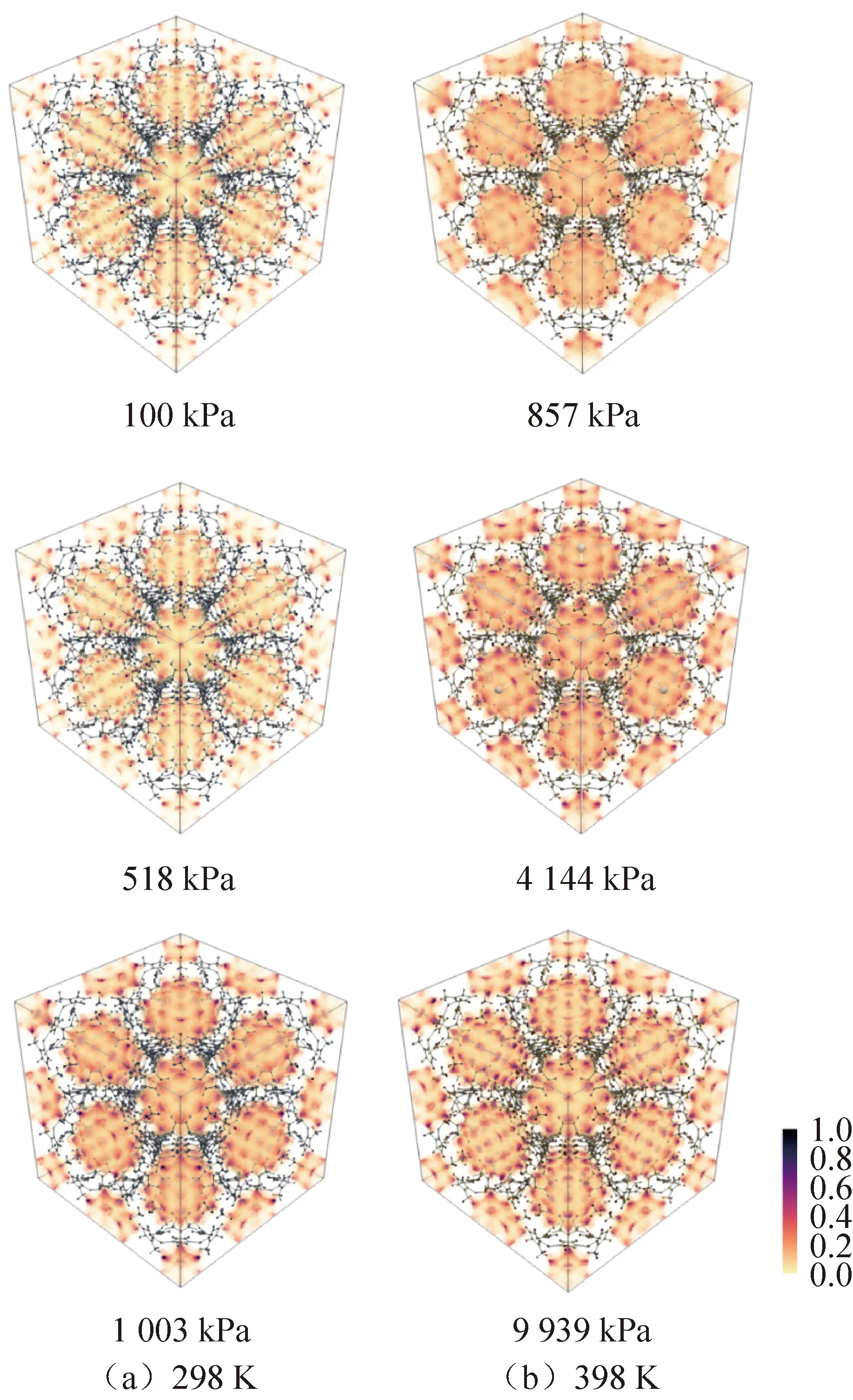
图6 吸附密度分布示意图
通过观察吸附密度分布图可知:1)ZIF-8(Zn)的金属位点处吸附密度最先增加,吸附密度也最大。这是因为相较于其他点,金属位点与NH3分子间的相互作用较强。2)仔细观察ZIF-8(Zn)孔的位置,可以看到很多孔道表面的NH3密度较高,这可能就是2.1.2节提到的NH3液膜。由于ZIF-8(Zn)中很多孔道的直径不足0.44 nm,所以在吸附过程中会有很多NH3分子无法通过孔道,可能在其表面形成一层NH3液膜。3)ZIF-8(Zn)的SOD笼内部的吸附密度也较高,说明成功通过ZIF-8(Zn)孔道的NH3分子在其内部聚集。
2.2 制冷性能
通过以上GCMC模拟得到了吸附温度为298 K,解吸温度为398 K时的吸附量和吸附热等数据。为了评估ZIF-8(Zn)吸附NH3的吸附系统制冷性能,考虑理想情况下以吸附模拟的结果计算得到制冷性能系数(coefficient of performance,COP)。
在图2(a)所示的吸附制冷系统中,温度为吸附温度,压力为蒸发压力时的点1处吸附量W最大。温度为解吸温度,压力为冷凝温度的点3处吸附量W最小。当系统Wmax和Wmin确定后,可通过式(4)计算得到系统循环吸附量ΔW:
ΔW=Wmax-Wmin
(4)
对应地,系统反应热为ΔadsH(Wmax)和ΔadsH(Wmin),此处近似用式(5)确定ΔadsHave:
(5)
SCE为该系统产生的制冷量,在数值上等于蒸发器的蒸发热量Qev,即:
(6)
Qin为该系统的输入能量,在数值上近似等于解吸放出的热量Qdes,即:
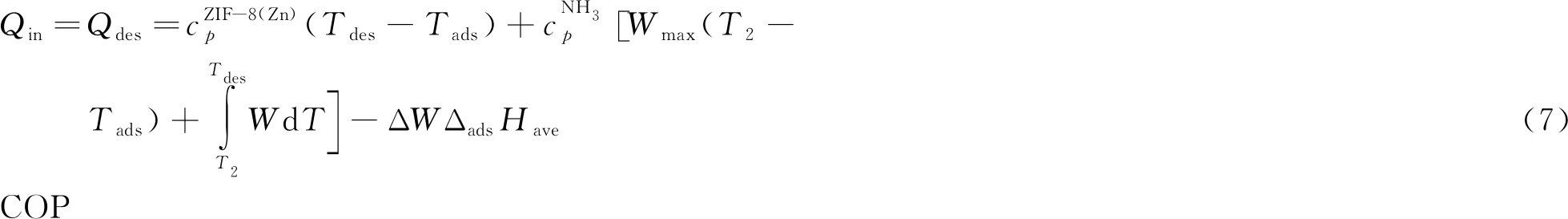
(8)
将式(6)和式(7)代入式(8),可以计算出该吸附制冷系统的COP,以此来评估其制冷性能。值得注意的是,其中T2是按照等容加热过程吸附量不变的条件确定的,即最大吸附量Wmax在冷凝温度的吸附等压线中对应的温度。
吸附式制冷系统的制冷量由蒸发器释放,故蒸发温度及压力在此系统中尤为重要。本文研究适用于空调、冰箱及冷冻冰柜的工况,图7所示为不同蒸发温度及压力下的相关参数。图6(a)所示为不同蒸发温度下的循环吸附量ΔW和平均吸附热ΔadsHave。蒸发温度由243 K增至283 K时,循环吸附量由0.147 2 g/g增至0.234 0 g/g,平均吸附热ΔadsHave由1 675.21 kJ/mol逐渐增至1 877.01 kJ/mol。图6(b)所示为不同蒸发温度下的输出制冷量SCE、系统输入能量即解吸热Qdes和制冷系数COP。当蒸发温度由243 K增至283 K时,SCE由165.67 kJ增至276.37 kJ,即使系统解吸热也相应地由425.67 kJ增至632.74 kJ,系统COP仍由0.38增至0.43。
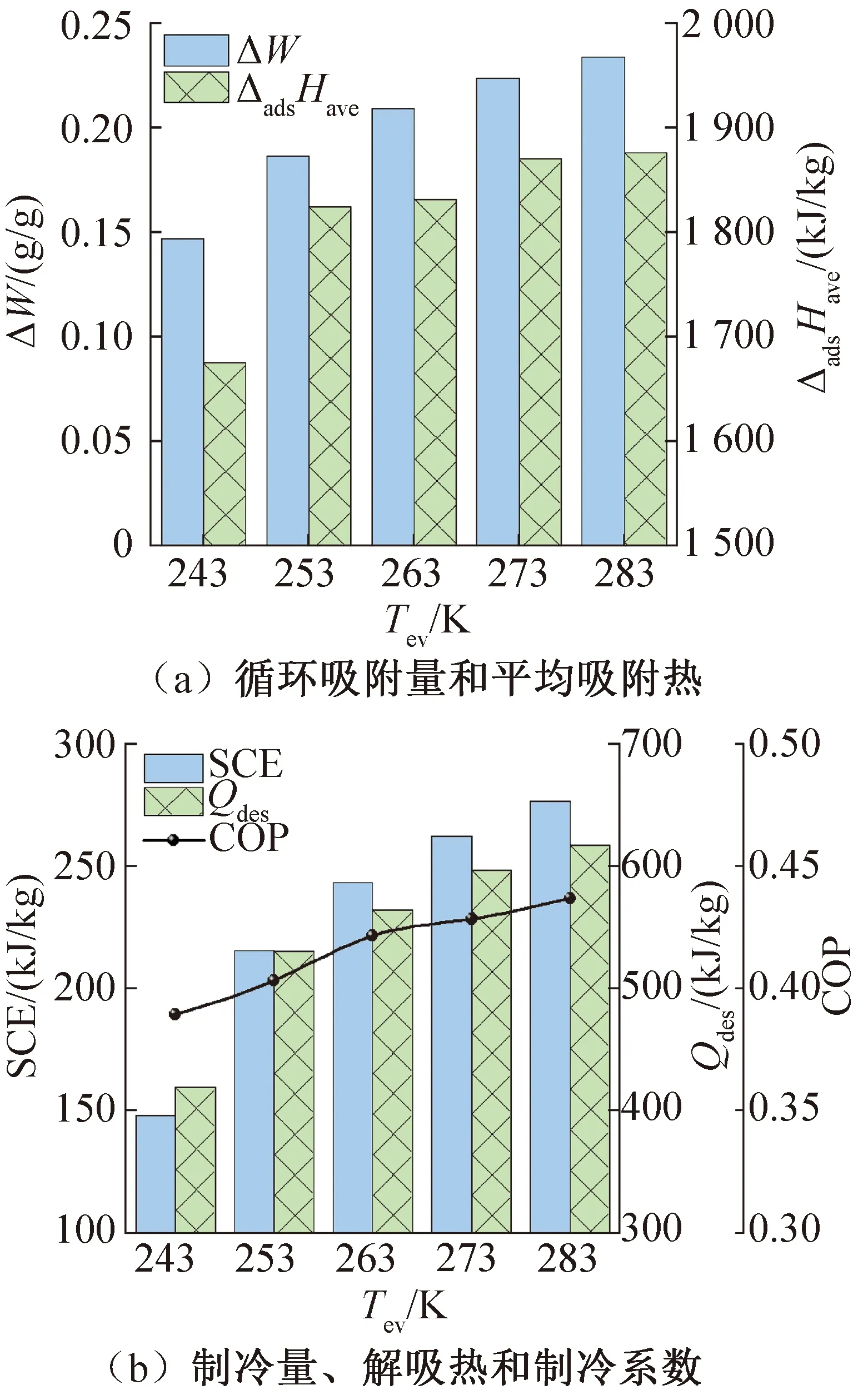
图7 不同蒸发温度下系统的制冷性能相关参数
由图2可知,在本文分析中,蒸发压力等于吸附压力,冷凝压力等于解吸压力。所以不同蒸发温度下NH3的饱和压力等于该蒸发温度下的系统蒸发压力和吸附压力。当蒸发温度较高时,蒸发焓ΔevH(Tev)较高。同时,最大吸附量Wmax和达到最大吸附量时的吸附热ΔadsH(Wmax)较大,则循环吸附量ΔW和平均吸附热ΔadsHave也相应较大。在蒸发焓ΔevH(Tev)和循环吸附量ΔW的共同影响下,蒸发温度较高时的制冷量较大。在循环吸附量ΔW和平均吸附热ΔadsHave的共同影响下,蒸发温度较高时的解吸热较大。由计算可知,制冷量和输入能量的比值,即制冷系数COP在蒸发压力大的工况下也较大,制冷性能较为优越。
3 结论
本文采用UFF和TraPPE力场,通过GCMC的分子模拟方法,对ZIF-8(Zn)吸附NH3分子的吸附特性进行了系统研究。针对模拟结果分别从热力学性能和制冷性能两方面进行了分析,绘制了ZIF-8(Zn)吸附NH3分子的吸附量曲线,分析了吸附量不同温度压力下的变化趋势,同时讨论吸附热的变化趋势及原因。根据模拟结果绘制了吸附密度分布图,并总结了前人的理论,解释了吸附密度分布的原因。最后基于吸附式系统可用于制冷循环,研究了ZIF-8(Zn)吸附NH3的制冷特性。得到结论如下:
1)ZIF-8(Zn)吸附NH3的吸附量随压力的升高而逐渐增大,在分压力约为0.2时增大速度放缓,至饱和压力处达到最大,298、303、398 K在其各自饱和压力下的饱和吸附量分别为0.305、0.302、0.231 g/g。ZIF-8(Zn)吸附NH3的吸附量随温度的增大而逐渐减小,其吸附等压线成“S”型。
2)等温条件下,ZIF-8(Zn)和NH3的总吸附热随压力升高而增加,主要是NH3分子间相互作用产生的吸附热增加所致,而作为总吸附热另一部分的ZIF-8(Zn)与NH3分子相互作用产生的吸附热在不同压力下较为稳定。
3)大量NH3分子因与金属位点的相互作用较强而在金属位点处被吸附,NH3分子无法通过ZIF-8(Zn)中孔径小于临界孔径的孔道而可能会在其表面形成NH3液膜,而顺利通过孔道的NH3分子在ZIF-8(Zn)笼的内部聚集。
4)以ZIF-8(Zn)和NH3为工质对的吸附式制冷系统制冷性能较为稳定,对温度有较好的适应性,特别是在低温区其制冷性能较为优越。理想情况下制冷温度为283 K时制冷系数为0.43,制冷温度为243 K时制冷系数仍可达到0.38。
符号说明
Etotal——原子间的相互作用,kcal/mol
EVDW——范德华能,kcal/mol
Eelec——静电能,kcal/mol
DIJ——势阱深度,kcal/mol
xIJ——范德瓦尔斯键长,Å
Qi——电荷数
Qj——电荷数
ε——介电常数,本文UFF力场中取常数1
Rij——原子间的距离,Å
Tev——蒸发温度,K
Tcon——冷凝温度,K
Tads——吸附温度,K
Tdes——解吸温度,K
ΔW——循环吸附量,g/g
Wmax——最大吸附量,g/g
Wmin——最小吸附量,g/g
ΔadsHave——系统平均反应热,J/g
ΔadsH(Wmax)——最大吸附量时对应的反应热,J/g
ΔadsH(Wmin)——最小吸附量时对应的反应热,J/g
ΔevH(Tev)——蒸发焓,J/g
Qev——蒸发器的蒸发热量,J/g
Qdes——解吸过程放出的能量,J/g
Qin——系统的输入能量,J/g
SCE——制冷量,J/g
COP——制冷性能系数
