临床铜绿假单胞菌对头孢他啶异质性耐药研究
2022-08-18李金玲李文茹张建设黄旭斌廖康谢小保
李金玲,李文茹,张建设,黄旭斌,廖康,谢小保
(1.浙江海洋大学国家海洋设施养殖工程技术研究中心,浙江舟山 316022;2.广东省科学院微生物研究所,华南应用微生物国家重点实验室,广东省菌种保藏与应用重点实验室,广东广州 510070;3.中山大学附属第一医院呼吸与危重症医学科,广东广州 510080;4.中山大学附属第一医院医学检验科,广东广州 510080)
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是一种引起院内感染的主要条件致病菌,能适应恶劣的生存环境,且分布广泛,常存在于水体、土壤以及空气等自然环境中以及人类的皮肤、消化道和呼吸道等位置。该菌可引起肺炎、烧伤感染、血流感染等多种感染,致死率高。PA 具有庞大的基因库,极易产生耐药,对多种抗生素具有较强耐药性[1-4]。据中国细菌耐药监测网(CHINET)报道2005-2020 年铜绿假单胞菌的临床分离率均位于革兰氏阴性菌的前五[5-11],一直是治疗院内感染亟待解决的问题,给临床抗感染治疗带来了极大困扰,已成为临床关注焦点[12-13]。近年来,关于PA 异质性耐药(heteroresistance,HR)的报道也越来越多,使其临床治疗越发棘手。
异质性耐药是细菌中的不同细胞亚群对抗生素的敏感性不同,是细菌由敏感菌株发展成耐药菌株的中间阶段[14-15]。异质性耐药现象最早见报于1947年[16],但1970 年这种现象才被命名为“异质性耐药”[17]。NICOLOFF,et al[18]研究者认为当某种细菌在临床检验中主要群体为药敏,但存在最低抑菌浓度(minimum inhibitory concentration,MIC)与最高不抑菌浓度(maximum non inhibitory concentration,MNIC)比值大于8,且发生频率大于1×10-7的耐药亚群,则可以确认为是异质性耐药。1997 年,有研究者发现对甲氧西林异质性耐药的金黄色葡萄球菌[19],后续有研究人员相继在肺炎克雷伯菌、肺炎链球菌、结核分枝杆菌等多种常见致病菌中发现了异质性耐药现象[20-24]。但对PA 异质性耐药的研究较少,大多局限于PA 对碳青霉烯类抗生素的异质性耐药,目前PA 对头孢菌素类抗生素异质性耐药的相关报道较少,其异质性耐药机制也尚不明确。
1 材料与方法
1.1 材料
1.1.1 实验菌株
实验菌株为中山大学附属第一医院检验科临床分离的50 株PA,质控菌株为铜绿假单胞菌ATCC27853,由广东省科学院微生物分析检测中心保存。
1.1.2 试剂及培养基
Kirby-Bauer(K-B)药敏纸片:CAZ(30 μg),购自英国Oxoid 公司;头孢他啶粉剂,购自北京索莱宝科技有限公司;水解酪蛋白胨(Mueller-Hinton,MH)琼脂培养基、Luria-Bertani(LB)肉汤培养基,购自广东环凯微生物科技有限公司;阳离子调节Mueller-Hinton(MH)肉汤(CAMHB)培养基,购自北京酷来搏科技有限公司;哥伦比亚血平板,购自广州市左克生物科技发展有限公司。
1.2 方法
1.2.1 菌株保存
菌株保存采用甘油保存法,采集的菌株于平板上划线培养,37 ℃恒温培养过夜,挑取单菌落接种于LB 肉汤培养基中,37 ℃、180 r·min-1条件下振荡培养至对数生长期,将高温消毒后的50%甘油与处于对数生长期的菌液按1:1 的比例混匀,置于-80 ℃冰箱保存。
1.2.2 最小抑菌浓度测定
公共图书馆服务对象广泛,涉及各个年龄段,一般采用调查问卷的方式来采集用户评价。调查问卷包含3各部分,第一部分是用户基本信息,如年龄、性别、家庭住址等;第二部分是调查问卷的核心内容,即LibQUAL+TM的各个指标;最后一部分是开放性问题,如用户对图书馆服务的建议与意见。调查问卷的核心是用户对LibQUAL+TM各指标的满意情况,每一指标可分若干种满意程度,并用不同分值计量。通过调查问卷的回收统计,对公共图书馆各服务层面进行客观总结,以便提高图书馆服务质量。
CAZ 对PA 的MIC 测定按照标准微量肉汤稀释法进行[25]。在12×8 孔板中每孔各加入100 μL CAMHB培养基,设置CAZ 浓度梯度为0.5、1、2、4、8、16、32、64、128、256 μg·mL-1,以指数生长期的PA 细胞配制菌悬液,实验菌株终浓度为5×105CFU·mL-1。本实验阳性对照孔内无CAZ,阴性对照孔内无菌液,实验均设置3 个平行。将加好样的孔板在37 ℃静置培养16~20 h 后读取结果。本实验所用质控菌株为铜绿假单胞菌ATCC27853。根据CLSI 2020版[25]进行结果判读,裸眼观察到的孔内无明显细菌生长的最低CAZ 浓度判定为MIC。阳性对照孔内细菌正常生长,阴性对照孔内没有细菌生长,参考质控菌株的抗生素MIC 结果在指南要求范围内。
1.2.3 K-B 药敏实验
K-B 药敏纸片扩散法的实验操作步骤参考临床和实验室标准协会(Clinical and Laboratory Standard Institute,CLSI)2020版[25]。挑取血平板上过夜生长的单菌落配制菌悬液,使用生理盐水将菌悬液浓度调整为(1~2)×108CFU·mL-1。以上述菌液浓度接种,使用无菌棉签浸入菌悬液后均匀的涂布于MH 琼脂平板上,将CAZ 药敏纸片平置于涂布菌液的平板中央。37 ℃条件下恒温培养16~18 h,测定CAZ 抑菌圈的直径。根据CLSI 2020版[25]进行结果判读。通过裸眼观察抑菌圈内是否有菌落出现,抑菌圈内出现菌落生长则初步判断为异质性耐药。本实验所用质控菌株为铜绿假单胞菌ATCC27853。
1.2.4 菌落谱型分析(population analysis profile,PAP)
菌落谱型分析法作为一种菌落计数的相对定量方法,也被认为是异质性耐药确证的金标准[26]。使用MHA 培养基配制CAZ 浓度梯度为0、0.25、0.5、1、2、4、8、16、32、64、128、256 μg·mL-1的MH 平板,以指数生长期的PA 细胞配制菌悬液,菌液浓度为107~102CFU·mL-1。以上述菌液浓度取100 μL 均匀涂布于MH平板上,实验均设置3 个平行。37 ℃静置培养48 h 后进行菌落计数,使用Microsoft Excel 处理数据并作图,若菌株MIC 与MNIC 比值大于8,且耐药亚群发生频率大于1×10-7,则可以确认为是HR 菌株。对照菌株为非异质性耐药的铜绿假单胞菌ATCC27853 和临床分离的耐药菌株PAS96。
1.2.5 适应成本测定
生长实验主要是检测实验菌株的生长曲线特征[27]。本实验主要是通过对比亲本菌株和异质性耐药亚群两者在相同培养条件下的生长速率是否有显著差异以判断异质性耐药菌株是否产生适应成本。
在12×8 孔板中每孔各加入100 μL 的LB 肉汤培养基,用处于指数生长期的PA 菌株配制菌悬液,实验菌株终浓度为1×106CFU·mL-1。实验设置3 个平行。孔板置于全波长酶标仪37 ℃振荡培养24 h,每小时测定1 次OD600值,直至24 h。根据数据绘制时间生长曲线图,对测量结果进行生物统计学分析,判断生长速度是否有显著差异。
1.2.6 耐药稳定性测试
耐药稳定性实验是为了证实CAZ 异质性耐药亚群在无抗生素压力下是否能够稳定遗传。挑取PAP实验中最高CAZ 浓度平板上的耐药亚群,制备甘油管于-20 ℃冰箱保存。按照1%的接种量在无抗生素的MH 平板上进行传代培养,37 ℃恒温培养箱孵育过夜,连续传代50 代并且在超低温冰箱(-80 ℃)保存菌株。使用CAMHB 培养基对原始菌株和耐药亚群以及传代菌株进行MIC 值的测定。
2 结果
2.1 MIC 药敏结果
根据CLSI(2020)发布的M100-S30 文件中所制定的PA 的CAZ 耐药标准[25],采用肉汤稀释法根据MIC值判断药敏结果为:MIC 值≤8 μg·mL-1为敏感(susceptible,S),MIC 值≥32 μg·mL-1为耐药(resistant,R),MIC 值是16 μg·mL-1时为中介(intermediate,I)。本次研究对50 株临床分离的PA 对CAZ 的MIC 范围为1~256 μg·mL-1,其中,37 株菌株的MIC 值在1~8 μg·mL-1范围内,判定为CAZ 敏感;1 株菌株MIC 值为16 μg·mL-1,判定为中介;12 株菌株MIC 值在32~256 μg·mL-1范围内,判定为CAZ 耐药(表1)。其中菌株PAS56、PAS73、PAS95 的MIC 为4 μg·mL-1,菌株PAS81 的MIC 为8 μg·mL-1。
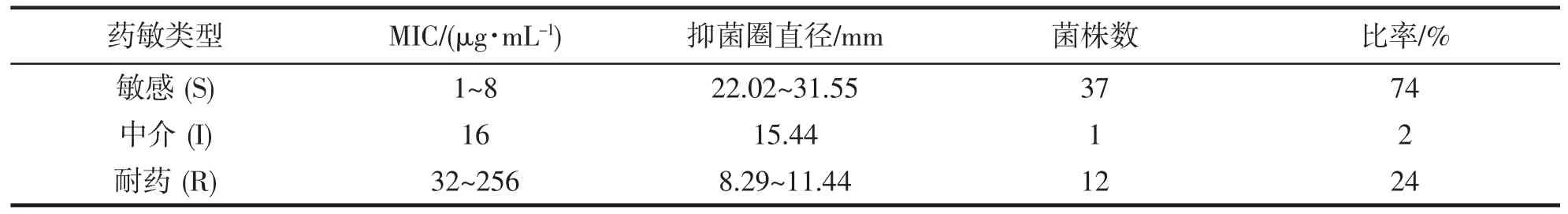
表1 50 株铜绿假单胞菌对头孢他啶的药敏结果Tab.1 Experimental results of 50 P.aeruginosa strains susceptibility to CAZ
2.2 异质性耐药菌株的初筛
根据CLSI(2020)中所制定的PA 的CAZ 耐药标准[25],采用纸片扩散法并根据抑菌圈直径大小判断其药敏结果为:抑菌圈直径≥18 mm 为敏感,抑菌圈直径≤14 mm 为耐药,抑菌圈直径介于15 mm 与17 mm 之间的为中介耐药,标准菌株ATCC27853 的抑菌圈直径质控范围为22~29 mm。
本次研究对50 株临床分离的PA 进行了K-B 药敏实验,结果如表1 所示。50 株PA 对CAZ 的抑菌圈直径的范围为8.29~31.55 mm,其中,37 株菌株的抑菌圈直径范围为22~32 mm,判定为CAZ 敏感,占比74%;1 株菌株的抑菌圈直径则为15 mm,判定为中介,占比2%;12 株菌株其抑菌圈直径范围为8~11 mm,判定为CAZ 耐药,占比24%。
PA 对CAZ 的K-B 药敏表型如图1 所示,通过观察抑菌圈内是否出现大小不等的菌落生长,对实验菌株进行异质性耐药情况的初步筛选。质控菌株铜绿假单胞菌ATCC27853 的K-B 药敏结果,抑菌圈的直径为28 mm 且圈内无菌落生长,根据CLSI 标准该菌株为CAZ 敏感(图1A);临床分离株PAS64 的抑菌圈直径为25 mm,根据CLSI 标准该菌株为CAZ 敏感(图1B);临床分离株PAS96 的抑菌圈直径为9 mm,根据CLSI 标准该菌株为CAZ 耐药(图1C);临床分离株PAS81 的抑菌圈直径为26 mm,CAZ 纸片抑菌环的边缘出现了一些菌落(透射光下裸眼可见),这些菌落是可能的异质性耐药菌落(图1D),初步判定为CAZ 异质性耐药。初步筛选到异质性耐药菌株20 株,占总实验菌株的40%。
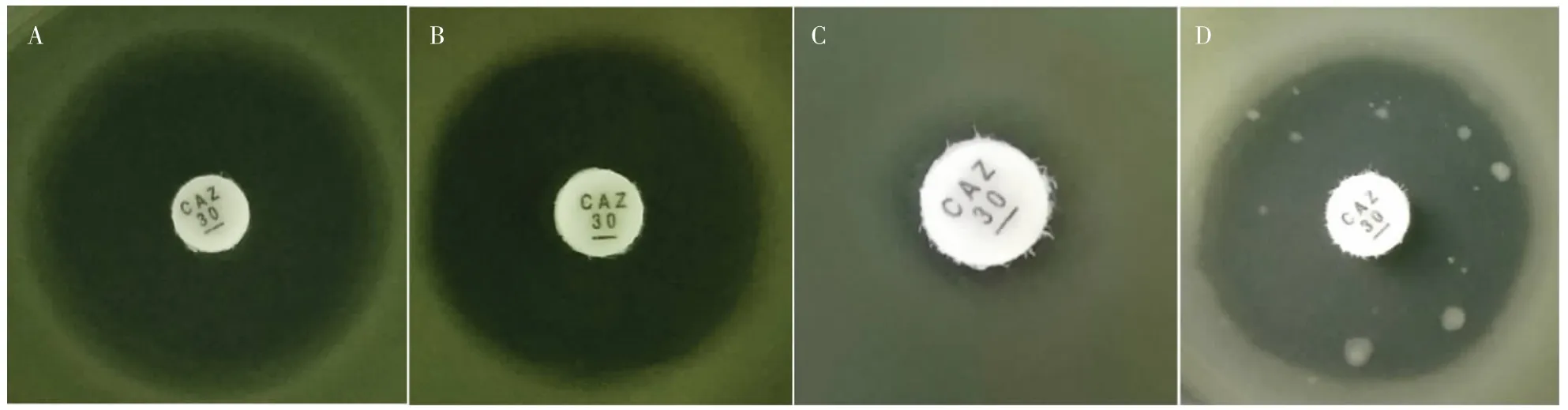
图1 铜绿假单胞菌对头孢他啶的K-B 药敏表型Fig.1 Phenotypic susceptibility of P.aeruginosa to CAZ by K-B test
2.3 异质性耐药菌株的确认
本研究对初步筛选出的20 株异质性耐药菌株进行菌落谱型分析验证,实验结果表明,有4 株为异质性耐药菌株(图2)。敏感菌株ATCC27853 在CAZ 浓度达到8 μg·mL-1无菌落生长;耐药菌株PAS96 在药物浓度为128 μg·mL-1时,仍保持稳定生长;而这4 株(PAS56、PAS73、PAS81、PAS95)异质性耐药菌株的曲线则是缓慢下降,随着头孢他啶浓度的增加,菌株可以在平板上生长的耐药亚群数量也逐渐减少,且MIC 与MNIC 比值大于8,异质性耐药亚群的发生频率也均大于等于1×10-7(表2)。其中图2A 中铜绿假单胞菌ATCC27853 的MIC/MNIC 值为4,判定为CAZ 敏感菌株;临床分离株PAS96 的MIC 值大于32 μg·mL-1,且在药物浓度为128 μg·mL-1时,仍保持稳定生长,判定为CAZ 耐药菌株;临床分离株PAS56 的MIC/MNIC 值为32,判定为CAZ 异质性耐药菌株;临床分离株PAS81 的MIC/MNIC 值为16,判定为CAZ 异质性耐药菌株;图2B 中临床分离株PAS73 的MIC/MNIC 值为64,判定为CAZ 异质性耐药菌株;临床分离株PAS95 的MIC/MNIC 值为32,判定为CAZ 异质性耐药菌株。这4 株(PAS56、PAS73、PAS81、PAS95)异质性耐药菌株的MIC 值均表现为CAZ 敏感,而PAP 实验结果显示一部分亚群细胞对CAZ 耐药。当耐药发生频率大于10-7时,将抗生素浓度最高的平板上生长的菌落数除以对照(无抗生素)平板上的菌落数,计算得到本次这4 株菌株的异质性耐药亚群的发生频率范围为1×10-7~1.2×10-5。

图2 6 株铜绿假单胞菌对头孢他啶的菌落谱型分析曲线图Fig.2 Population analysis profiling curves of 6 P.aeruginosa strains to CAZ

表2 4 株铜绿假单胞菌头孢他啶异质性耐药菌株的菌落谱型分析结果Tab.2 Population analysis profiles results of 4 P.aeruginosa heteroresistance to CAZ
2.4 异质性耐药菌株的适应成本
生长曲线的实验结果如图3 所示,图3A 中异质性耐药菌株(亲本菌株)PAS56 与其两株PAP 实验中最高CAZ 浓度平板上的耐药亚群在对数生长期(4~12 h)的生长速率均没有表现出统计学差异(PAS56-1(P=0.079 4)、PAS56-3(P=0.084 3)),但同样从PAP 实验中最高浓度平板上分离的耐药亚群(记作PAS56-2)则比亲本菌株在对数生长期(4~8 h)的生长速率明显慢许多,有极显著差异(P=0.007 7),而在9~12 h 时则无统计学差异(P=0.059 6),从整体来看,生长速率并无统计学差异;图3B 中PAS95 与3 株PAP 实验中最高CAZ 浓度平板上的耐药亚群在对数生长期的生长速率(4~12 h) 均表现为有极显著差异(P<0.01) (PAS95-1(P=1.4E-7)、PAS95-2(P=3.2E-7)、PAS95-3(P=5.8E-7)),3 株耐药亚群在对数生长期的生长速率与亲本菌株相比明显快许多,并且亲本菌株的细菌总量相对较少。本结果表明异质性耐药菌株的耐药亚群的生长速率与亲本菌株相比没有显著差异。

图3 铜绿假单胞菌头孢他啶异质性耐药菌株的生长曲线Fig.3 Growth curve of P.aeruginos heteroresistance to CAZ
2.5 异质性耐药菌株的耐药稳定性
将PAP 实验中最高CAZ 浓度平板上生长的的耐药亚群接种在无抗生素的平板上连续传代50 代后,每5 代进行1 次MIC 值的测定,结果如表3 所示。PAS56 亲本菌株经微量肉汤稀释实验测定MIC 为4 μg·mL-1,其耐药亚群(PAS56-1、PAS56-2、PAS56-3)的初始MIC 为32 μg·mL-1,耐药亚群的MIC 值是亲本菌株的8 倍。经过在不含抗生素的平板传代50 代后,PAS56-1 和PAS56-2 亚群的MIC 值一直保持在32 μg·mL-1,未发生CAZ 敏感性回复。耐药亚群PAS56-3 的MIC 值在10-15 代左右由32 μg·mL-1回复为16 μg·mL-1,并且在后续传代过程中MIC 值保持在16 μg·mL-1,是亲本菌株的4 倍,回复为CAZ 中介。PAS95 亲本菌株的MIC 经实验测定为4 μg·mL-1,其耐药亚群(PAS95-1、PAS95-2、PAS95-3)的初始MIC 均为32 μg·mL-1,耐药亚群MIC 是亲本菌株的8 倍,在经过50 代传代后,PAS95-1、PAS95-2、PAS95-3 的MIC 均保持在32 μg·mL-1,CAZ 敏感性未发生回复。结果表明,除PAS56-3 亚群分离株CAZ 敏感性传代后回复为中介,其他亚群分离株PAS56-1、PAS56-2、PAS95-1、PAS95-2、PAS95-3 传代后耐药亚群的CAZ 敏感性均未发生回复,耐药表型稳定。

表3 铜绿假单胞菌头孢他啶异质性耐药菌株耐药稳定性实验Tab.3 Resistance stability test of P.aeruginos heteroresistance to CAZ
3 讨论
本研究基于药敏实验(K-B test)并结合微量肉汤稀释法对临床分离的PA 进行异质性耐药菌株的初筛,50 株PA 中有37 株对CAZ 敏感,占比74%(37/50);1 株对CAZ 中介,占比2%(1/50);12 株对CAZ 耐药,占比24%(12/50)。其中,37 株CAZ 敏感菌株有20 株初步判定为异质性耐药,占比40%(20/50)。吴婷婷[28]研究发现PA 对头孢他啶(CAZ)药敏纸片的耐药率为23.5%,与本研究结果一致。本研究通过对初筛结果中的异质性耐药菌株进行菌落谱型分析验证,显示PA 对CAZ 的异质性耐药率为8%(4/50)。本研究PA 对CAZ 异质性耐药率低于许磊[29]研究中PA 对多粘菌素的异质性耐药率35%(7/20),略低于吴婷婷[28]研究中PA 对亚胺培南的异质性耐药率11.6%(36/310),且明显低于何建春[30]研究中PA 对亚胺培南和美罗培南的异质性耐药率(54.3%,72.5%),以及JIA Xiaojiong,et al[31]研究中PA 对头孢吡肟的异质性耐药率(57.3%)。本课题组选用这50 株PA 对哌拉西林异质性耐药进行研究,研究发现PA 对哌拉西林的异质性耐药率为26%(13/50),表明同一PA 可能对不同抗生素产生异质性耐药率不同[32]。筛选到的异质性耐药菌株的比例差异与多种因素有关,如实验菌株的来源、抗生素的种类以及检测异质性耐药菌株的实验方法的不同等。本研究发现通过K-B 法初筛的异质性耐药率与PAP 实验后确证的异质性耐药率相差较大,因此不能将K-B 法的结果作为临床使用的标准,需结合K-B 和PAP 实验结果进行综合判定。前人也发现使用K-B 法以及Etest 法这2 种方法检测异质性耐药菌株仍存在较高的假阴性率,导致异质性耐药菌株的漏检[33]。K-B 法以及E-test 法两种方法判断是否为异质性耐药菌的依据都是通过裸眼观察药敏纸片所形成的抑菌圈内是否有菌落生长。此类方法的优点是对于临床上来说操作简单快捷,结果判定一目了然;但其缺点是国际上目前对异质性耐药菌株的判断没有标准,只能通过主观方面进行判断,抑菌圈内的耐药亚群的发生频率不能准确计算,而且由于菌株对抗生素敏感性可能存在的差异性而导致异质性耐药菌株的漏检。目前菌群谱型分析法(PAP)被认为是判断异质性耐药细菌的金标准[19],但是该方法的缺点也十分明显,实验成本高、耗时长且操作繁琐,只适合在实验室中实施,不适用于临床上的快速检测。
4 株异质性耐药菌株经过PAP 实验验证后发现,其耐药亚群少数能在大于不抑制绝大多数群体生长的最高药物浓度8 倍以上的抗生素平板上生长,极少数亚群甚至发展为高水平的耐药。本次4 株异质性耐药菌株耐药亚群的发生频率为1×10-7~1.2×10-5。POURNARAS,et al[34]研究中指出PA 对亚胺培南和美罗培南这两种碳青霉烯类抗生素异质性耐药耐药亚群的发生频率为1.2×10-7~6.9×10-5。吴婷婷[35]研究中临床分离的PA 对亚胺培南异质性耐药的发生频率介于4.5×10-9与8.9×10-7之间。许磊[29]研究发现PA 对多粘菌素的异质性耐药的发生频率范围为3.5×10-7~2×10-6。与本研究结果对比发现,PA 对CAZ 异质性耐药的发生频率相对较高。课题组研究发现PA 对哌拉西林异质性耐药亚群的发生频率为7.3×10-7~1.2×10-5[32],与本研究结果相近。有研究指出异质性耐药细菌中表现为高耐药性的亚群在无抗生素作用下培养5~10 代后,有少数亚群仍保持高耐药性,绝大多数亚群回复为敏感且保持异质性耐药特性[36]。而本研究对挑取的高水平耐药亚群进行无抗生素传代50 代培养,结果发现其耐药表型可以保持稳定遗传,即高水平耐药亚群保持高水平耐药,低水平耐药亚群保持低水平耐药。本实验结果表明PA 对CAZ 异质性耐药的菌株极易发展为完全耐药菌株。PAS95 亲本菌株与其3 个耐药亚群在生长速率上表现出极显著差异,耐药亚群生长速率均大于亲本菌株,且其耐药稳定性实验表明耐药亚群保持高水平耐药。高耐药性亚群的稳定遗传将对临床上抗生素的抗菌效果产生影响,其机制仍待进一步研究。
本研究中所有的样本均来自临床分离,数量有限,研究可能具有一定的局限性。从以上分析可以看出,PA 对CAZ 的异质性耐药率相对较低,但其耐药亚群的高耐药性可以稳定遗传,极易发展成完全耐药菌株,应当引起重视。异质性耐药菌株在临床上不易检出,常规药敏实验中常表现为“假敏感”,导致用药失效,进而发展为耐药菌株。由于目前临床上还没有实用的方法来准确检测出异质性耐药菌株,因此开发新的检测方法是当务之急。本研究在PA 对CAZ 异质性耐药表型等方面做了一定的探究,在后续工作中将对其异质性耐药机制进行深入研究,为相关临床感染治疗提供一些有效的依据。
