井冈山地区龙脑樟来源真菌多样性和抗菌活性研究
2022-08-18刘文杰张晓寒吴佳欢唐佳慧姜淑玲郭文强
刘文杰 张晓寒 吴佳欢 唐佳慧 姜淑玲 郭文强
(井冈山大学,吉安 343009)
来源于植物的微生物,如植物内生菌,由于栖息于植物组织,但对植物没有危害,因此一直未受到重视,直到20世纪90年代,从中发现了紫杉醇和紫杉烷及喜树碱等具有重要药用价值的天然产物,这些植物来源的微生物才引起了广泛的关注[1]。基于植物来源真菌次级代谢产物的大量研究发现,其在抗病毒、抗炎、抗菌和抗肿瘤等方面表现出巨大的开发潜力,已经成为特殊生态环境来源新药研发的热点[2-5]。井冈山国家自然保护区地处我国江西省腹地,是一个极具南方红壤丘陵特色、又兼顾森林地貌的生态环境,微生物群落丰富多样[6]。植物龙脑樟作为井冈山地区重要的药用樟品种,其枝叶精油中富含右旋龙脑,是提取天然冰片的主要来源。目前,国内外对龙脑樟关注的焦点集中在包括冰片在内的挥发性精油方面,鲜有其内生菌方面的研究[7]。文献报道,龙脑樟内部微环境富含小分子精油,作为微生物的一种特殊的生存压力,预示着与该植物相关的真菌可能具有独特的代谢途径。对樟树来源真菌次级代谢产物开展的抗菌研究发现,其对导致花卉植物根部坏死的病原菌隐地疫霉(Phytophthora cryptogea)具有较强的生物活性[8]。植物微环境的特殊性,使得与其相关的微生物具有产生潜在药用价值化合物的可能性。
本研究选择物种资源丰富的井冈山地区,聚焦内部微环境特殊的龙脑樟组织及树周苔藓,开展了可培养真菌的分离工作,并对其发酵产物进行抗菌活性检测,以期获得具有抗菌活性真菌菌株,为新活性化合物发现和全面了解井冈山地区药用真菌资源奠定基础。
1 材料和方法
1.1 材料
1.1.1 实验样品
新鲜健康的龙脑樟树皮、树叶、种子及树周苔藓样品于2019年10月采集于江西省吉安市罗霄山脉中段。每个采样区域采集的2~4份样品,并按样品类别分别合并为大样品,用于可培养真菌的分离纯化,样品信息见表1。样品采集后装入无菌自封袋中,运抵实验室后置于4℃冰箱中保藏。

表1 罗霄山脉中段采集的样品信息Tab.1 Information of samples collected from middle part of Luoxiao Mountains
1.1.2 实验仪器
循环水式真空泵(型号:SHK-Ⅲ,郑州科泰实验设备有限公司);旋转蒸发仪(型号:RE-2000A,郑州科泰实验设备有限公司);恒温培养箱(型号:DNP-9082P03Ⅳ,上海新苗医疗器械制造有限公司);超净工作台(型号:SW-CJ-2D,苏州苏洁净化设备有限公司);高压灭菌器(型号:KXQ-LS,上海博讯有限公司);低温冷却液循环泵(型号:DLSK-5/20,郑州科泰实验设备有限公司);电子天平[型号:BSA-124SNMR,赛多利斯(上海)贸易有限公司],高效液相色谱仪[型号:1515,沃特世科技(上海)有限公司]。
1.1.3 指示菌
草分枝杆菌BNCC359483、枯草芽胞杆菌BNCC109047、耻垢分枝杆菌BNCC134980、金黄色葡萄球菌BNCC186335、大肠埃希菌BNCC336902采购自北纳创联生物科技有限公司。
1.1.4 真菌培养基
固体分离培养基(马铃薯葡萄糖琼脂培养基,g/L):马铃薯200.0,葡萄糖20.0,琼脂18.0。液体发酵培养基(真菌2号,g/L):葡萄糖10.0,麦芽糖20.0,谷氨酸钠10.0,甘露糖醇20.0,KH2PO40.5,玉米浆1.0,酵母浸粉3.0,MgSO4·7H2O 0.3,pH6.5。每种培养基添加抑制剂的种类、浓度参照文献方法[9]。
1.2 方法
1.2.1 真菌分离与纯化
用自来水将采集的龙脑樟各部位及树周苔藓样品冲洗干净,置于超净台晾干,用75%酒精浸泡处理1 min后,无菌水冲洗3次,5%次氯酸钠溶液浸泡5 min后,再用无菌水冲洗3次,无菌滤纸吸干样品表面水分。组织样品无菌操作,切成约0.5 cm2的组织块,置于PDA固体培养基表面;树周苔藓样品进行无菌研磨处理,研磨后的液体均匀涂抹在培养基表面,室温培养3~5 d[9-10]。从培养基表面挑取单菌落,针刺法接种至PDA固体平皿,并在室温下继续培养36 h后分离纯化得到不同形态的真菌菌落。通过对比菌落形态、颜色、质地和孢子形态以及色素等培养特征,进行初步地去重复,最终得到纯菌株。
1.2.2 真菌初步鉴定
采用生工生物工程( 上海) 股份有限公司合成的ITS 通用引物:ITS1 (5'-AGAA GTCGTAACAAGGTTTC-3')和ITS4 (5'-TCCTCCGCT TATTGATATGC-3')[11-12]。PCR扩增产物1%的琼脂糖胶电泳检测合格后,送至北京睿博生物科技有限公司测序。通过BLAST分析将鉴定出的序列与GenBank数据库中的数据进行分析,并在ClustalW软件进行进一步比对[13]。利用Godinho提出的标准来分析验证GenBank数据库的BLAST结果:覆盖率和序列同一性≥98%为同一个种;覆盖率和序列同一性在95%~97%之间,可以确定为同一属,而覆盖率和序列同一性≤95%,则可以认为是新菌[14]。
1.2.3 真菌发酵培养与抗菌活性测试
将获得的真菌分别接种至真菌2号液体发酵培养基中,室温静置发酵培养30 d。采用与文献[9]相同的菌株发酵条件及提取方法获得发酵产物提取物。以5种指示菌进行粗提物抗菌活性筛选与评价,阳性对照为氯霉素。采用琼脂纸片扩散法开展抑菌活性测试,纸片直径为10.0 mm,制备含提取物的纸片的方法参照文献[9],将药敏纸片放置在指示菌琼脂表面上,于37℃培养箱中培养24 h。通过测量抑菌圈直径来评价其抗菌活性强弱。抗菌活性评价标准:抑菌圈直径<11.0 mm代表活性较弱;抑菌圈直径11.0~15.0 mm代表中等活性;抑菌圈直径>15.0 mm代表活性较强。
1.2.4 次级代谢产物指纹图谱分析与分离纯化
真菌粗提物代谢物指纹图谱分析采用高效液相(HPLC,美国Waters公司),分析条件:5%~100%甲醇线性梯度洗脱45 min[9]。菌株JDWHS-7-081静置发酵30 d,过滤后,菌体甲醇浸泡,超声破碎;发酵液乙酸乙酯萃取两次,减压蒸馏。两部分合并,获得粗浸膏12.5 g。粗浸膏以硅胶柱层析进行分离,石油醚/丙酮系统(20:1~1:1)洗脱,所得7个组分进行抗菌活性测定。其中组分4表现出较好的抗菌活性,进一步采用甲醇为流动相的葡萄糖凝胶LH-20的色谱柱对组分4进行纯化,收集8个组分,对获得组分3采用ODS-C18半制备柱(YMC-Pack ODS-A,10 mm × 250 mm,5 μm,3 mL/min),流动相比例:甲醇:水=65:35进行制备,获得保留时间为28.6 min的化合物1纯品。
1.2.5 数据分析与处理
为评价龙脑樟来源优势真菌组成情况,分别统计分析真菌的分离率(isolation rate,IR)、定殖率(colonization rate,CR)、相对频率(relative frequency,RF)[10]。分离率(IR)是指从样本组织块中得到的菌株数与全部样本组织块数的比值,IR=(组织块中得到的菌株数/实验供试的总组织块数)×100%。定殖率(CR)指样本中受真菌侵染的组织块数占全部样本组织块数的百分数,CR=(有真菌侵染的组织块数/实验供试的总组织块数)×100%。相对频率(RF)是指样本中分离到的某种真菌的菌株数占分离到总菌株数的百分数,RF=(样本中分到的某种真菌的菌株数/分到的总菌株数)×100%。
2 实验结果与讨论
2.1 龙脑樟来源真菌初步鉴定与分析
通过组织分离法从龙脑樟的各个样品中获得真菌197株,对其归类分析发现涵盖子囊菌类和接合菌类两大真菌类群。基因序列对比结果显示大部分菌株与数据库最接近的种属具有较高的相似度,初步推断该来源真菌隶属于10个目20个科29个属(表2)。

表2 197株真菌的物种分布Tab.2 The genera distribution of 197 fungi
2.2 不同部位的真菌的分离率和定殖率
从龙脑樟的叶片、树皮、种子及树周苔藓样品中分别分离到真菌38、44、31和84株。真菌的分离率和定殖率在不同样品中存在较大的差异,分离率依次为树周苔藓(71.8%)>树皮(63.2%)>叶片(58.8%)>种子(45.5%);定殖率依次为树周苔藓(69.5%)>树皮(60.4%)>叶片(55.7%)>种子(40.6%)。结果显示不同分离部位真菌的分离率和定殖率趋势一致,但具有一定的差异性,其中树周苔藓的分离率和定殖率都最高,种子的分离率和定殖率最低(图1)。
2.3 不同部位真菌组成及不同菌种的相对频率
龙脑樟中优势菌属为青霉属和曲霉属,它们相对频率分别为28.93%和15.22%。尽管总体而言,青霉属和曲霉属为优势菌属,但龙脑樟各部位之间优势属真菌并不完全相同。从树叶样品分离到的38株真菌,分布于9个属,以青霉属(12株)为优势菌属,占总数的31.57%;从树皮样品分离到的44株真菌,分布于11个属,以曲霉属(13株)为优势类群,占总数的29.54%;从种子样品分离到的31株真菌,隶属于7个属,以青霉属(10株)为优势类群,占总数的32.25%;从树周苔藓样品分离到的84株真菌,隶属于19个属,以青霉属为优势菌(24株),占总数的28.57%。以上可见,不同部位的真菌群落组成各不相同,真菌群落的多样性和分布因分离部位而异。
2.4 真菌次级代谢产物抗菌活性
所有分离到的真菌菌株,室温静置发酵30 d,获得197个代谢粗提物,抗菌活性筛选结果发现,82株真菌的代谢产物至少对1种指示菌表现出抑制活性,总阳性率为41.62%,其中50株真菌显示出广谱的生物抑制活性(表3)。其中菌株JDWHS-7-081、JDWHS-7-086、JDWHS-9-27和JDWHS-10-02的次级代谢产物对多种指示菌显示出较好的抑制活性,这为后续实验奠定了基础。
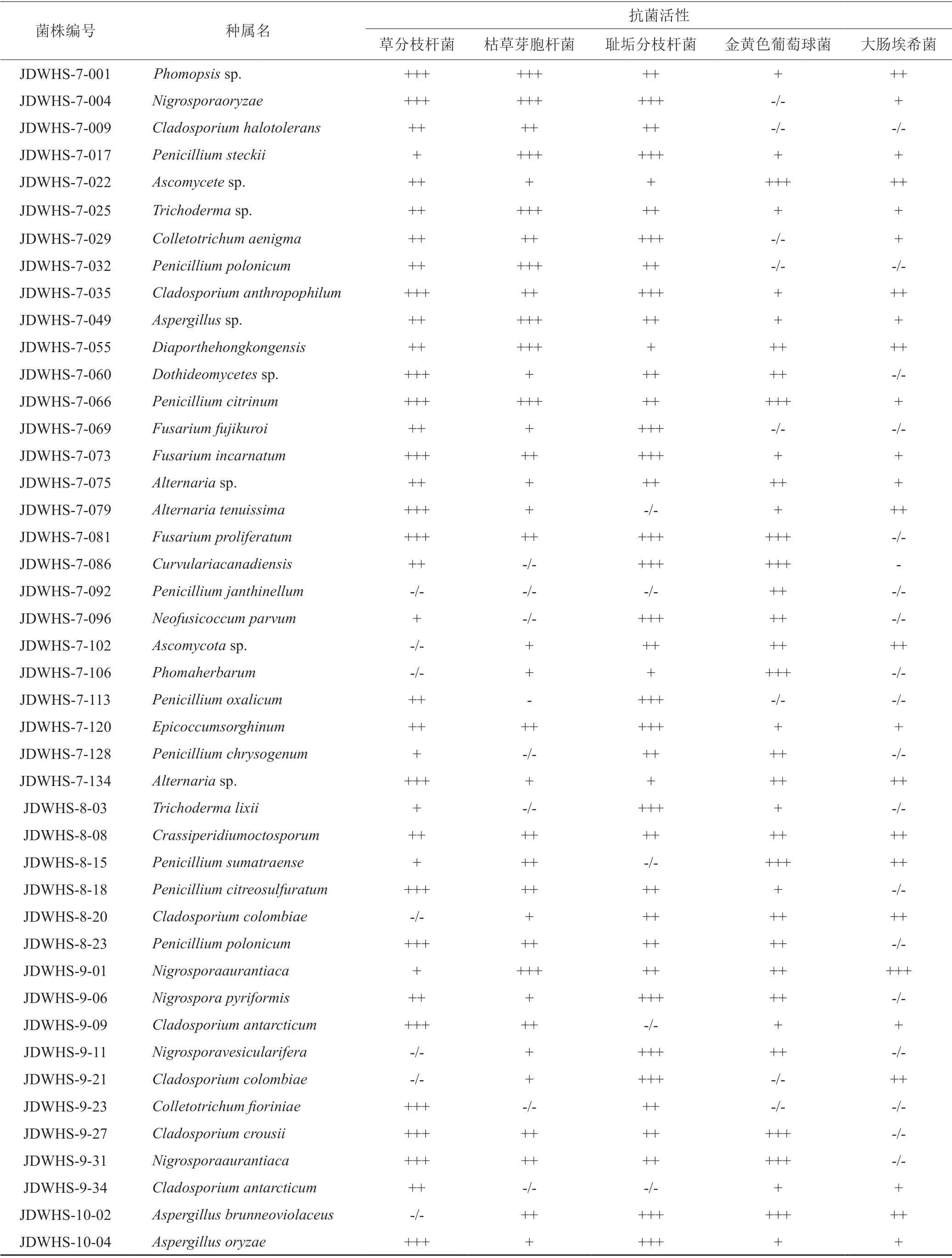
表3 龙脑樟来源真菌次级代谢产物抗菌活性Tab.3 Antibacterial activity of secondary metabolites of fungi from Cinnamomum camphora Chvar.Borneol
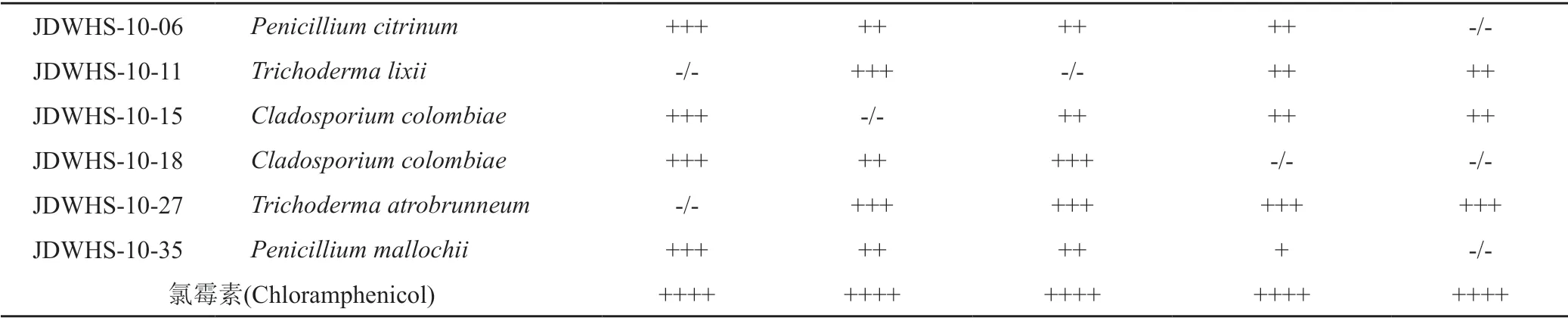
续表3
2.5 菌株JDWHS-7-081的次级代谢产物研究
对菌株JDWHS-7-081的代谢产物进行抗菌活性追踪研究,从中获得了1个代谢主产物化合物1,其NMR数据与文献报道的已知化合物一致[15],可以确定化合物1为混源萜类化合物Austin(图2)。
化合物1白色粉末;ESI-MS:m/z501 [M+H]+(C27H32O9)。1H NMR (500 MHz,DMSO-d6)δH: 6.88(1H,s),6.72 (1H,d,J= 9.5 Hz),6.07 (1H,s,J= 10.0 Hz),5.80 (1H,s),5.75,5.26 (2H,s),4.82 (1H,q,J= 6.0 Hz),3.31 (2H,m),3.28 (2H,m),2.00 (3H,s),1.69 (3H,s),1.54(3H,s),1.46 (3H,s),1.29 (3H,s),1.15 (3H,d,J= 6.0 Hz),1.11 (3H,s)。13C NMR (125 MHz,DMSO-d6)δC: 171.8,169.2,169.2,163.6,148.2,142.0,137.7,133.5,119.6,118.1,85.7,83.4,81.1,79.3,74.9,63.4,46.7,42.4,26.8,26.7,26.2,23.9,22.6,21.0,20.4,15.3,12.3。
3 讨论
3.1 可培养真菌的多样性
樟树在我国南部各省份广泛分布,是南方重要的药用和绿化树种。对该属植物化学成分研究发现,其中多含挥发油、生物碱、瑞诺烷类二萜、芳香化合物、多酚、黄酮和有机酸等,现代药理研究也发现其具有多种生物活性[16-17]。龙脑樟作为井冈山地区樟树的一个重要树种,内部环境复杂且具有特点,栖息其中的真菌可能因生存压力而进化出独特的生物合成代谢途径,针对其研究可能获得结构类型新颖的活性天然产物。本研究以井冈山地区龙脑樟的各个部位样本作为研究对象,获得了197株归属于10个目20个科29个属的可培养真菌,显示出较好的物种多样性。同时,在我们的研究中还发现真菌群落的多样性和丰度在不同样品之间存在差异,不同部位间的真菌类属也具有明显的差异。总体来说,江西龙脑樟不同部位的微环境差异可能会影响其中微生物分布特征。
3.2 可培养真菌的生物活性
近几十年来,植物来源真菌作为特殊生境来源的微生物受到越来越多的关注,已成为生物活性物质重要的资源库[18]。研究发现,植物真菌已经进化出适应植物微环境的遗传和代谢机制,这意味着该来源的真菌具有产生结构类型独特的代谢产物的潜力[19]。本研究以琼脂纸片法研究了197株龙脑樟可培养真菌在实验室条件下次级代谢产物的抗菌生物活性,发现50株具有广谱抗菌活性的菌株,其中JDWHS-7-081和JDWHS-10-27表现出较为突出的抑菌活性。这些未开发的活性菌株有待进一步开展天然产物研究。
通过对活性菌株JDWHS-7-081代谢产物研究获得了混源萜类类化合物1,该类化合物通常从真菌,尤其是曲霉属和青霉属[20-21]真菌培养产物中获得。混源萜类化合物是类异戊二烯来源的天然产物,其中混合聚酮-萜类是一类重要结构类型,并且起始于3,5-二甲基芥子酸(DMOA)的混源萜类化合物是最常见的亚类[22]。迄今为止,已经发现了100多种DMOA衍生的混源萜类化合物,其在抗菌、抗虫和酶抑制活性领域表现出巨大的研究潜力[23-24]。
综上所述,井冈山地区龙脑樟来源可培养真菌的物种多样性较为丰富,获得的抗菌活性菌株为后续深入开展天然产物研发研究奠定了菌株基础。
