基于ITS2的和田玫瑰分子进化分析△
2022-08-18宁慧霞鹿娟娟鲁春芳文洪江努尔波拉提阿依达尔汗海白尔火加艾合买提刘戈宇
宁慧霞,鹿娟娟,2,鲁春芳,文洪江,努尔波拉提·阿依达尔汗,海白尔·火加艾合买提,刘戈宇*
1.中国科学院 新疆理化技术研究所 中国科学院干旱区植物资源化学重点实验室/省部共建新疆特有药用资源利用重点实验室,新疆 乌鲁木齐 830011;
2.中国科学院 新疆分院,新疆 乌鲁木齐 830011;
3.乌鲁木齐市技术创新研发与科技成果转化中心,新疆 乌鲁木齐 830002;
4.中国科学院大学 化学科学学院,北京 100190
和田地区的地理、光、热及水资源等自然环境造就了和田玫瑰独特的品质,和田玫瑰花具有质优、肉厚、味纯浓、含油量高和香味浓等优势,是新疆特色药食同源植物,在新疆地区使用广泛。和田玫瑰新鲜花蕾中多糖、黄酮含量显著高于同地区栽培的紫枝玫瑰、苦水玫瑰和丰花玫瑰,多酚含量仅次于苦水玫瑰[1]。和田玫瑰花瓣总黄酮、总多糖对羟基自由基、超氧阴离子自由基、1,1-二苯基-2-三硝基苯肼(DPPH)自由基均有不同程度的清除作用[2]。和田玫瑰性温,味甘,具有行气解郁、活血止痛等功效,多用来治疗肝胃气痛、食欲不振、月经不调等疾病,是维吾尔族药成方制剂玫瑰花糖膏、养心达瓦依米西克蜜膏、炎消迪娜儿糖浆、玫瑰花口服液和《国家基本药物目录》收载品种寒喘祖帕颗粒等使用的主要药物。玫瑰花在和田栽培历史悠久,近年来,随着脱贫攻坚和乡村振兴工作的深入开展,和田地区玫瑰由房前屋后的庭院种植转向大田规模化种植,目前栽培面积约6 万亩(1 亩≈666.67 m2),主要分布在和田地区于田县、策勒县、墨玉县、洛浦县等[3-4],已成为新疆和田地区的特色经济作物。种植和田玫瑰成为当地农民增收致富的重要途径和极具区域优势的特色产业。
陶弘景[5]的《本草经集注》中记载:“诸药所生,皆有境界”。此处境界指的便是药用植物的生长环境,说明道地药材与其产地有相当密切的关系。根据《中华人民共和国中医药法》(2016 年12 月25 日通过),道地药材是我国传统优质药材的代表,是指经过中医临床长期优选出来的,在特定地域,通过特定生产过程所产的,较其他地区所产的同种药材质量好、品质佳、疗效好,具有较高知名度的药材。过去对中药材道地性的研究主要停留在产地、性状和生态环境等方面,其本质及规律性方面的研究还不够深入。随着分子生物技术的发展,目前许多学者采用分子手段评价道地药材[6-8],道地药材具有道地性的根本原因是其基因型在特定时空表达的产物(即药材基因型在特定环境中表达产生的次生代谢物)不同造成的。韩建萍等[9]应用扩增片段长度多态性(AFLP)技术分析了不同产地栀子的亲缘关系,证明道地性的产生是基因型和环境共同作用的结果。中药材生态变异与生态型的分化和形成是物种对不同环境生态条件的长期适应与自然选择的结果,种内变异是中药材品质优劣和疗效差异的实质。
虽然和田玫瑰的应用与贸易历史悠久,但是对其研究仅始于20 世纪,尤其是分子系统发育方面的研究在国内外鲜见报道。文献报道和田食用玫瑰栽培已有2000 多年的历史[3-4,10],但这种说法的分子进化依据及和田玫瑰的道地性内涵、亲本起源、分子鉴定特征尚不明确。本研究以和田玫瑰为研究对象,通过DNA 条形码方法获得和田玫瑰内转录间隔区2(ITS2)序列,分析其序列特点,与蔷薇属物种及《中华人民共和国药典》(以下简称《中国药典》)2020年版收录的玫瑰花[11]的ITS2序列保守位点、差异位点及分子进化系统发育进行比对,以了解和田玫瑰系统发育特点,探讨和田玫瑰亲本起源、进化分歧时间,以期为和田玫瑰药材道地性分子识别和评价、道地性产区认证、综合开发利用提供分子生物学依据。
1 材料
1.1 样品
样品来源于新疆和田国家农业科技园区、墨玉县农业产业园区、中国科学院新疆理化技术研究所药材种植基地栽培的3年生和田玫瑰,每次采集3个点,每个点采集3个样品,采集2次,合计采集18批样品。样品由石河子大学阎平教授鉴定为和田玫瑰Rosa damascena‘Hetian’Mill.,保存于中国科学院新疆理化技术研究所(凭证号:PS0338MT02)。从美国国家生物技术信息中心(NCBI)GenBank中,以序列长度完整、去除重复的单倍型、序列一致性为88.96%~94.33%检索蔷薇科蔷薇属(Rose)、委陵菜属(Potentilla)、地榆属(Sanguisorba)ITS2序列。统一拉丁名、不同GenBank 号的序列下载不超过3 条。共获得蔷薇属植物ITS2 序列36 条、委陵菜属12条、地榆属4条(数据下载日期为2020年6月15日,表1)。
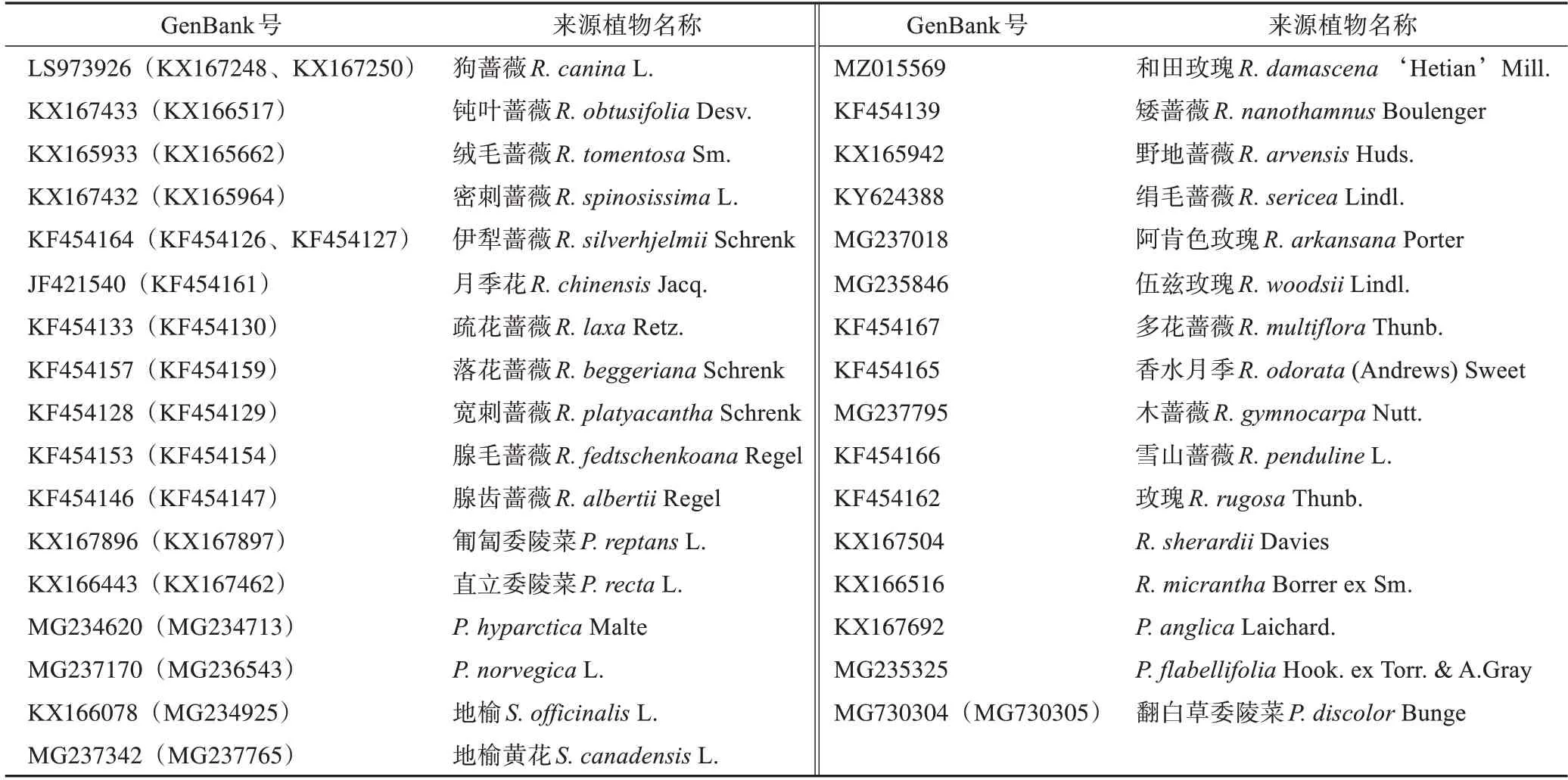
表1 和田玫瑰材料信息
1.2 试剂
DP305 植物基因组DNA 提取试剂盒[天根生化科技(北京)有限公司];2×Taq聚合酶链式反应(PCR)Master Mix(含蓝染料)、PCR 引物[生工生物工程(上海)股份有限公司]。
1.3 仪器
5417R型离心机、Mastercycler nexus X2型梯度PCR 仪(德国Eppendorf 公司);164-5052 型高电流电泳仪、Gel Doc XR+型凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 样品DNA提取和PCR扩增
取硅胶干燥的和田玫瑰幼嫩叶片100~150 mg 于干净的研钵中,加液氮迅速研磨成粉,取约35 mg置于灭菌的2.0 mL 离心管中,根据植物基因组DNA提取试剂盒说明书步骤提取总DNA,取获得的DNA 3 μL,采用0.8%的琼脂糖凝胶电泳检测质量,其余DNA 样品放于1.5 mL 离心管,于-20 ℃保存备用。
引物序列、PCR 反应条件和扩增程序见参考文献[12],ITS2通用引物序列为ITS2F:5′-ATGCGATACTTGGTGTGAAT-3′和ITS3R:5′-GACGCTTCTCCAGACTACAAT-3′。PCR 反应体积50.0 μL,体系包含Mix 25.0 μL、引物各2.0 μL(10 μmol·L-1)、总DNA 2.0 μL(约50 ng)、双蒸水19 μL。PCR 反应程序:94 ℃预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸1.5 min,30 个循环;72 ℃延伸7 min。PCR扩增产物在冰箱中-20 ℃保存。
2.2 电泳检测和测序
由1.5%的琼脂糖凝胶电泳检测扩增产物,选择明显特异条带样品送到生工生物工程(上海)股份有限公司完成测序。测序均采用正反双向,以保证准确性。
2.3 序列分析、二级结构预测
采用CodonCode Aligner V5.5 软件校对拼接序列峰图,去除引物和低质量序列,根据NCBI 数据库BLAST 相似度最高物种的序列边界,截取序列边界。使用软件MEGA X 中的Align by ClustalW 比对分析,查看差异位点、保守位点、信息指数,采用邻接(NJ)系统发育树Kimura 2-parameter模型评估各物种之间的亲缘关系,采用Bootstrap(1000 次重复)检验各分支的可信度和支持率。在ITS2 核糖体的DNA 数据库(http://its2.bioapps.biozentrum.uniwuerzburg.de/)中,ITS2 序列基于隐马尔可夫模型HMMer注释方法,去除两端5.8S和28S区段,获得标准ITS2 序列,同样使用该网站通过最小自由能原理及同源比对预测法预测目标序列的ITS2 二级结构[13]。
2.4 分化时间推断
用MEGA X 的CLOCKS RelTime 方法推断进化时间,展示界面需要导入的文件有序列信息和树文件,选择外类群(outgroup)和校准点。
在推断前需要准备以下文件:1)序列信息文件。包含外类群及校准点的.FASTA 格式序列分析文件;以与蔷薇属相近的委陵菜属、地榆属作为外类群。2)树文件。由MEGA X 通过Align by ClustalW 建立的MEGA Format 格式比对文件,随后此文件通过MEGA-X PHYLOGENY 建立的.Newick格式的系统发育树文件。
确定校准点:用MEGA X 的TIMETREE,在TimeTree 显示框输入大于属水平的一类物种,推断物种之间分化的时间节点。用TIMETREE Node Time 输入2 个物种,推断之间分化的时间节点,以分化时间最小的定为第1 个校准点、分化时间最大的定为第2 个校准点。打开MEGA X 软件,依次点击CLOCKS、Compute Timetree,选择RelTime-ML,依据提示上传相应文件;点击Set Options,选择默认参数OK;点击Launch Analysis即可建立具有分化时间的系统发育树。
3 结果与分析
3.1 和田玫瑰序列特点
基于ITS2 引物,去除引物区后获得长度为409 bp序列,基于隐马尔可夫模型的HMMer注释方法,去除5′端5.8S 和3′端28S 区段,获得和田玫瑰标准的ITS2 序列204 bp,提交NCBI 获得GenBank号为MZ015569。18 批样品测序结果基本一致,选用其中1 个序列做后续分析。将和田玫瑰409 bp序列在NCBI网站进行BLASTN 比对分析,发现前100个序列是蔷薇属、委陵菜属和地榆属,其序列覆盖度为85%~94%,序列一致性为88.96%~94.33%。而对ITS2 204 bp 序列进行BLASTN 比对分析,发现前100 个序列都是蔷薇属,序列覆盖度为100%,序列一致性为88.21%~91.39%。
获得的409 bp 和田玫瑰序列:1~39 bp 为小亚基核糖体核糖核酸基因和ITS1 部分序列;40~64 bp 为5.8S 核糖体核糖核酸基因全序列;65~268 bp 为ITS2 全序列;269~409 bp 为大亚基核糖体核糖核酸基因部分序列。
3.2 和田玫瑰与蔷薇属物种ITS2 序列差异位点、信息位点分析
对表1 中的序列用MEGA X 选择单倍型后做后续分析。变异位点及信息位点数可反映所分析材料的碱基变异程度。将和田玫瑰ITS2 序列与在GenBank 下载的26 条蔷薇属物种单倍型序列经MEGA X 进行比对分析,总长度422 bp(包括Gaps),保守位点(conserved sites)388 个,变异位点(variable sites)31 个,信息位点(parsim-info sites)7个(图1)。
3.3 分子系统发育分析
将下载的26 条蔷薇属单倍型序列与和田玫瑰的ITS2 标准序列作为内系群(ingroup),6 条委陵菜属和2 条地榆属ITS2 单倍型序列作为外类群(outgroup),经MEGA X 进行分子系统聚类分析,由图2 可知,自展支持率为100%明显聚为3 类:和田玫瑰与26 条蔷薇属序列聚为一类、6 条委陵菜属聚为一类、2 条地榆属聚为一类。在蔷薇类中,英国和意大利产玫瑰聚为一类,属于欧洲(区)系玫瑰;北京、新疆乌鲁木齐、西藏聚产玫瑰为一类,属于亚洲(区)系玫瑰,欧洲(区)系玫瑰和亚洲(区)系玫瑰在北半球,又聚为一大类;加拿大产玫瑰聚为一类,属于北美洲(区)系玫瑰。和田玫瑰与欧洲(区)产玫瑰Rosa sherardii距离最近,亲缘关系也最近。

图2 和田玫瑰系统发育树
用MEGA-X 的TIMETREE TimeTree 推断蔷薇属、委陵菜属、地榆属物种之间分化的大约时间节点(图3),由TIMETREE 现有的数据库可知,蔷薇属早在24.3 MYA(百万年)开始分化,最近分化时间是13 MYA,见图4。用TIMETREE Node Time 推断出蔷薇属最小分化时间大约为13 MYA、最大分化时间约为28 MYA,见图4。由MEGA X 的CLOCKS Rel Time推断和田玫瑰大致分化时间(图5),圆点标记为和田玫瑰花的进化起始时间是大约0.029 MYA前,即29 000年前和田玫瑰开始出现。

图3 蔷薇属、委陵菜属、地榆属物种之间分化时间推断

图4 蔷薇属物种最小、最大分化时间推断

图5 和田玫瑰分化时间推断
3.4 和田玫瑰与《中国药典》2020 年版收载玫瑰ITS2差异分析
《中国药典》2020 年版收载的玫瑰为蔷薇科植物玫瑰R.rugosaThunb.的干燥花蕾,ITS2 序列GenBank 号为KF454162,长度为417 bp(包括Gaps),标准ITS2 序列总长度为211 bp;经与和田玫瑰MEGA X 进行比对分析,保守位点为388,变异位点为21 个(图6),无信息位点。在ITS2 序列数据库网站预测和田玫瑰与玫瑰的ITS2 序列二级结构发现,两者有高度相似的(high quality model,all helices,percentages 100/100/100/80)二级结构模型,但也有一定的差异,主要在Ⅲ螺旋区部位,见图7。

图6 和田玫瑰与玫瑰ITS2序列差异位点

图7 和田玫瑰与玫瑰ITS2序列二级结构
4 讨论
4.1 和田玫瑰亲本起源分析
玫瑰是一种很古老的植物。据古生物学家和地质学家对蔷薇叶片化石鉴定证明,3000 万年前在地球的北半球,玫瑰就曾有过繁荣时期。有资料报道,在抚顺地区发现叶片化石,距今约6000 万年,其化石标本与玫瑰R.rugosa相似[14]。基于形态和染色体数目推测,大马士革玫瑰R.damascene、白玫瑰R.alba和百叶玫瑰R.centifolia都有共同的最初始的亲本,即法国玫瑰R.gallica,而在三者中大马士革玫瑰是比较早的[15]。据《新疆植物志》第2 卷第2 分册记载[16],蔷薇属(RosaL.)包含5 组21 种,其中法国蔷薇组(Sect.Gallicanae DC.ex Ser.)有法国蔷薇R.gallicaL.、突厥蔷薇R.damasceneMill.、百叶蔷薇R.centifoliaL.3 个种,其中突厥蔷薇即大马士革玫瑰。大马士革玫瑰从中东引入西欧,并在16 世纪后期重新引入,广泛用于欧洲蔷薇的改良。微卫星基因分型结果表明,大马士革玫瑰遗传多样性高,保加利亚、伊朗和印度的玫瑰和大马士革玫瑰具有相同的微卫星图谱,表明其有一个共同的起源[17]。王辉[18]从11 个主要油用玫瑰基地收集了栽培种28份,其中有和田基地的和田玫瑰,基于叶绿体matK基因序列比对和聚类分析,和田玫瑰与湖州大马士革、格拉斯R.centifolia_1、平阴大马士革R.damascena_3、渭南大马士革R.damascene、渭南百叶R.centifolia_2、罗岗R.centifolia‘Luogang’、云南百叶R.centifol_3、苏联香水玫瑰2 号R.centifolia_4 聚为一类,说明新疆和田玫瑰与大马士革类玫瑰、百叶类玫瑰渊源上有相同的祖先。
本研究结果显示,在自展支持率为100%时,和田玫瑰ITS2 序列与26 条蔷薇属序列聚为一类,6 条委陵菜属聚为一类,2 条地榆属聚为一类。在蔷薇类中,欧洲(区)系英国和意大利产玫瑰聚为一类,亚洲(区)系北京、新疆乌鲁木齐、西藏产玫瑰聚为一类;北半球欧洲(区)系玫瑰和亚洲(区)系玫瑰又聚为一大类;北美洲(区)系加拿大产玫瑰聚为一类,而和田玫瑰与欧洲(区)系产玫瑰距离最近,亲缘关系最近。说明玫瑰分布具有地理分布特点,即区域性特点,不同产地玫瑰亲缘关系与地理分布具有一定相关性,采用ITS2 序列能将不同产地玫瑰样品区分开。分子系统发育分析表明,和田玫瑰起源于欧洲的玫瑰系,而欧洲的玫瑰系最初亲本是大马士革玫瑰。由此从分子进化系统发育推断出,和田玫瑰追根溯源属于大马士革玫瑰,是大马士革玫瑰自然优化的品种,从分子角度进一步印证了形态学分类的正确性、有效性。
4.2 和田玫瑰进化分歧时间分析
地球上所有生物都从上一代体内继承DNA 遗传基因,且这种遗传基因会随着时间的变化而逐渐改变(即按一定的速率发生碱基突变)。运用分子钟技术,通过直接对比不同物种间基因的碱基排列顺序,便可推测生物进化的起始时间。ITS2 遗传信息在解决系统发育位置和不同物种间的亲缘关系方面做出了重要贡献,同时也广泛用于揭示物种起源和估计各谱系间的分歧时间。在本研究中选择了与蔷薇属内类群在演化关系上最为接近、具有最相近的祖先、进化程度上低于蔷薇属内类群的委陵菜属和地榆属ITS2 序列作为外类群,采用分子钟模型估算和田玫瑰进化分歧时间,推导出和田玫瑰约在29 000 多年前分化出来,至今存在20 000 多年。从而印证了和田玫瑰从西方传到塔克拉玛干,在沙漠边缘扎根,经过20 000 多年的自然驯化与人工选育,培育成了如今的和田玫瑰,成为迁徙玫瑰品种中的上品玫瑰[4]。和田玫瑰于2016 年12 月20 日经新疆林木品种审定委员会审定,正式命名为“和田”玫瑰,良种编号为新S-SV-RD-002-2016。
分子钟系统发育树可以看出,和田玫瑰与分化时间较早的绒毛蔷薇和狗蔷薇聚类较近,玫瑰与分化时间较晚的多花蔷薇聚类较近。
4.3 ITS2序列及其二级结构用于和田玫瑰鉴定分析的可行性
ITS2 序列适合物种鉴定和构建植物类群系统进化关系,已得到国内外学者的肯定[19-23],鉴定方法被纳入《中国药典》2020 年版,成为药用植物鉴定必不可少的分子标记之一。
除核酸序列外,ITS2 的二级结构也被认为可以提供遗传信息。ITS2二级结构是由RNA单链自身回折而形成的配对和未配对碱基交替而成的茎环结构[24],在真核生物中均为“一环四臂”模型[25-27],“一环”指未配对的环区部分,“四臂”指4 条配对碱基组成的螺旋区(Helix),分别记为螺旋Ⅰ、Ⅱ、Ⅲ和Ⅳ[28]。大量数据比对分析发现,在ITS2 的4 条螺旋中,螺旋Ⅱ最短且保守性最高,螺旋Ⅲ最长,螺旋Ⅰ和螺旋Ⅳ都较短且保守性低;螺旋Ⅱ没有分支,常有嘧啶-嘧啶错配形成的凸环;螺旋Ⅲ偶见分支,而且在5′端近顶端部位序列保守性最高,包含UGGU(或UGGGU、UGG、GGU)序列;在螺旋Ⅰ和螺旋Ⅳ之间的环上嘌呤含量较高;ITS2 形状的保守性规律为环区形状比螺旋区保守,中间部位比两边部位保守[29]。而不同的物种其螺旋区的茎环数目、大小、位置及螺旋发出的角度有差异,在不考虑碱基的情况下,其形状信息具有可比性。
二级结构信息的加入使得ITS2 序列在构建系统发育树中末端分支变多、分辨率与支持率有所提高[30],二级结构已用于紫菀族的鉴定和亲缘关系研究[31]。杨美青等[32]提出,在基于ITS2 序列及其二级结构对防己及其混伪品的鉴定中,虽然ITS2 可以作为防己及其混伪品的DNA条形码,但是若包含ITS2二级结构所蕴含的系统发育信息,鉴定结果更加精准。在木通植物的鉴定中,加入ITS2 二级结构信息,系统树的物种分辨率提高了33%,且成功地将木通与其混伪品分开;在茄属药用植物类群中,加入二级结构信息后,很好地解决了茄属几种药用植物的鉴定问题[33]。
和田玫瑰与其他蔷薇属玫瑰相比,有其自身的序列特点、二级结构特征等。在ITS2 序列数据库网站预测和田玫瑰ITS2 序列二级结构符合上述规律,并与《中国药典》2020 年版记载玫瑰的ITS2 序列二级结构对比发现,两者有高度相似的二级结构模型,螺旋Ⅰ、Ⅱ和Ⅳ都一样,只有在Ⅲ螺旋区部位存在差异。综上,和田玫瑰ITS2 序列及二级结构特点可用于和田玫瑰的鉴定。
