高温白化事件可提高涠洲岛澄黄滨珊瑚(Porites lutea)的耐热性
2022-08-17蒙林庆黄雯阳恩广王永刚许莉佳余克服
蒙林庆 ,黄雯 *,阳恩广 ,王永刚 ,许莉佳,余克服
( 1.广西大学 海洋学院,广西 南宁 530004;2.广西大学 广西南海珊瑚礁研究重点实验室,广西 南宁 530004;3.广西大学珊瑚礁研究中心,广西 南宁 530004;4.生态环境部华南环境科学研究所, 广东 广州 510530)
1 引言
珊瑚礁是集生物资源、环境调节、海岸保护及休闲娱乐等多功能于一体的海洋生态系统,对人类社会和海洋生态有着至关重要的作用[1-2]。近年来,全球气候变化及人类活动导致全球的珊瑚礁发生大规模白化,预计到21世纪中叶,珊瑚礁覆盖度将减少70%~90%[3-4]。气候变暖是造成全球珊瑚礁退化的主要原因[3]。海水温度升高会导致珊瑚宿主与虫黄藻之间的共生关系破裂,使虫黄藻排出细胞外或共生藻中光合色素降解,最终造成珊瑚白化[5-6]。珊瑚对热胁迫的适应性研究表明,珊瑚在气候变化下具有一定的适应潜力,例如可以通过提高其白化阈值,增强对未来海洋环境变化的适应[7-8]。如1998年大堡礁发生过大规模高温白化事件的区域,在随后2002年更为严重的热白化事件中,珊瑚白化严重程度比预测要低30%~100%[9]。高频率热浪侵袭的海区,在2005年热白化事件后,珊瑚白化程度也比预想中有所减弱[10]。同样地,经历了2015−2016年全球珊瑚白化事件后的边缘环礁,2017年即使遭遇了更极端的热浪,珊瑚白化现象也减少了[11]。这是经历热胁迫后珊瑚提高了生理耐热性的结果[9,12]。室内模拟实验发现,适度热胁迫后的珊瑚具有更有效的光保护机制,环境适应能力增强[12]。国内虽然也有类似研究,但针对高温白化事件前后石珊瑚的调查及研究寥寥无几,大多集中于室内人工模拟实验,如Yu等[8]、刘旭[13]对造礁石珊瑚的室内热驯化实验发现,早期的热驯化具有提高珊瑚耐热性的潜力。由于高温白化事件的随机性,当前研究大部分都是基于珊瑚白化事件前后珊瑚礁生态指标或通过单一的室内模拟实验对比研究珊瑚热耐受性,而关于野外热白化事件发生前后同种珊瑚对热胁迫的响应特征与机制鲜有报道。因此,展开高温白化事件前后澄黄滨珊瑚(Porites lutea)的耐热性研究,可填补国内研究空白,对珊瑚礁保护和管理起到至关重要的作用。
广西北海涠洲岛(21°00′~21°10′N,109°00′~109°15′E)位于北部湾海域中部,处于南海珊瑚礁分布的北缘[14],近年来也受到了全球气候变暖的影响,如在2020年夏季遭受异常高温事件,导致了大量珊瑚的白化[15]。当然,白化事件中也有幸存的珊瑚,其中以澄黄滨珊瑚占大多数。澄黄滨珊瑚是团块状、雌雄异体产卵型造礁珊瑚,广泛分布于印度−太平洋海域,是珊瑚礁群落演替过程中的优势种之一[16]。同样地,它也是广西北海涠洲岛的现有优势种,占比可达29.45%[14]。因此,澄黄滨珊瑚是研究此区域白化事件前后珊瑚对高温响应与适应性的理想物种。本研究以涠洲岛2020年高温白化事件前后采集到的澄黄滨珊瑚活体样本,进行高温胁迫对比实验,通过比较虫黄藻密度、最大光量子产量(Fv/Fm)等生理指标以及总超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、谷氨酰胺合成酶(Glutamine Synthetase,GS)、还原型谷胱甘肽(Glutathione,GSH)等耐热性相关的蛋白质标记物,探索高温白化事件前后澄黄滨珊瑚的耐热性差异及高温响应模式,为全球气候变暖背景下涠洲岛造礁石珊瑚的适应性提出新的看法,对珊瑚礁生态系统的保护和管理提供理论基础。
2 材料与方法
2.1 研究区域和材料
本实验用的所有澄黄滨珊瑚活体样本均采集于广西北海涠洲岛西南近岸海域(图1a),水深为4~6 m。如图1b,样本采集分为两批次,首次采集于2020年4月下旬(实测水温约25℃),没有经历高温侵袭,采样10株;第二次是在同年9月下旬,采集海区幸存的澄黄滨珊瑚(水温为30℃),此批样本在夏季多次经历32℃的高温海水,也是采样10株。根据2020年夏季白化事件发生时间,将4月底采集的样本设置为未经白化事件组,9月底采集的珊瑚设为经历白化事件组,开展高温胁迫对比实验。
2.2 实验设计
两批次澄黄滨珊瑚均带水运输到广西大学珊瑚礁研究中心的实验室,以循环海水珊瑚养殖缸进行养殖,光照、温度、水质条件都保持在自然海区参数值范围内,均暂养2个月以上,保证珊瑚健康、生长状态良好。实验开始于2020年11月中旬,两批均挑选其中健康的5块澄黄滨珊瑚,用小型切割机将每块珊瑚母体切下3块表面积约为15 cm2的小块后,把其中1个珊瑚小块放于对照缸(用于26℃实验对照和取样),剩余2个珊瑚小块放于实验缸(升温胁迫后分别用于30℃、34℃取样),以此方法依次处理完所有的珊瑚母体,得到30个珊瑚小块,并保证两批次澄黄滨珊瑚均有5个珊瑚小块在对照缸,10个珊瑚小块在实验缸中。最后,将缸中珊瑚暂养1个星期恢复至状态良好。对照缸和实验缸都是循环海水珊瑚养殖缸,缸体水体容量约为200 L,以抽水泵进行水体循环,保证足够的水流和溶氧量,自动控制养殖灯具(光照∶黑暗=12 h∶12 h)模拟自然光照条件,加热棒和水冷机进行温度调控,采用柏林系统维持水质条件。暂养期间温度为26℃、色温为20 000 K、盐度为35±1、碳酸氢根()浓度指数(KH)为 7±0.2、pH 为 8.2±0.1、Ca2+浓度为(360±20) mg/L、Mg2+浓度为(1 350±20) mg/L、浓度小于0.15 mg/L、浓度小于0.1 mg/L、浓度小于0.1 mg/L,即在自然海水参数值范围内。暂养期间两个缸体条件始终保持一致,实验开始后,对照缸和实验缸除温度不同外,光照、营养盐浓度等条件皆保持相同。
澄黄滨珊瑚高温胁迫对比实验共设置3次取样:分别为26℃(适宜温度,对照缸取样)、30℃(夏季正常温度,实验缸取样)、34℃(极端温度,实验缸取样),每次取样温度间隔相同。本次实验中,对照缸保持26℃不变,直至实验结束后取样;实验缸则模拟海区升温幅度从26℃开始,每天早上9:00调节加热棒进行升温,保持1℃/d 的梯度上升,在30℃持续3 d后取样,使珊瑚机体有充分时间来应对环境温度的变化,而后继续升温,同理在34℃持续3 d后取样,如图1c所示。实验过程中,每天下午 16:00−17:00对各个样品进行拍照记录;晚上熄灯30 min后,利用脉冲振幅调制荧光仪(PAM仪)检测各珊瑚样本最大光量子产量(Fv/Fm);全程观察珊瑚表观形态,如触手伸展、颜色变化等。每次珊瑚样本取下后立即测量虫黄藻密度、叶绿素a含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性等生理生化指标。

图1 采样区域和实验方法Fig.1 Sampling locations and experimental method
2.3 生理生化指标测量
2.3.1 生理指标检测
珊瑚样本的表观形态变化(触手、颜色、黏液分泌等)通过日常观察和拍照对比观察。珊瑚最大光量子产量(Fv/Fm)参考Higuchi等[5]的研究方法,在暗处理30 min后采用PAM仪(Walz,德国)进行测量。
用盛装有过滤海水(孔径为 0.45 μm 滤膜过滤)的洗牙器(Water pik,美国)冲洗珊瑚块分离珊瑚组织与骨骼,测量冲洗液总体积后,取50 mL冲洗液以3 000重力加速度(g)于4℃离心10 min,去上清液后加20 mL过滤海水继续离心,以此重复2~3遍,摇匀镜检合格后,弃上清,加4%甲醛固定,用血球计数板法测得共生藻浓度(C,单位:cells/mL),用铝箔技术法测得珊瑚表面积,最后根据以下公式得到共生虫黄藻密度(D,单位:cells/cm2)[13]。

式中,V为冲洗液总体积(单位:mL);M为包裹珊瑚骨骼表面的铝箔纸质量(单位:g);G为铝箔纸单位面积质量(单位:g/cm2)[13]。
参照Jeffrey和Humphrey[17]的方法计算出共生虫黄藻叶绿素a含量,以此进一步换算得到单位面积叶绿素a含量。从总体积冲洗液中取15 mL以4 000 r/min离心5 min,缓慢去除上清液,剩余沉淀物加入10 mL 90%丙酮,然后在4℃条件下萃取24 h。将萃取24 h后的溶液再次离心,然后取其上清液,用分光光度计分别测试波长为750 nm、664 nm、647 nm和630 nm处的吸光度,代入下列公式得到叶绿素a含量(Chla,单位:μg/mL):
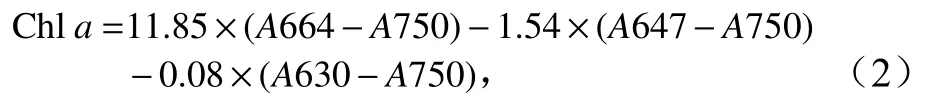
式中,A750、A664、A647、A630分别代表波长为750 nm、664 nm、647 nm和630 nm处的吸光度值。再换算成总体积冲洗液叶绿素a质量(单位:μg),进一步与珊瑚表面积(单位:cm2)相除即得到叶绿素a含量(单位:μg/cm2)。
2.3.2 生化指标测量
同样用冲牙器加过滤海水冲洗珊瑚表面得到高浓度冲洗液(<10 mL),取 2 mL冲洗液在 4℃、6 000 g下离心15 min后取上清液,−80℃保存,用于生化指标测量[18]。首先使用商用试剂盒分别测定上清液中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、还原型谷胱甘肽(GSH)、谷氨酰胺合成酶(GS)总活性,所有试剂盒购自南京建成生物工程研究所,货号分别为A001、A007、A084、A006和A047,具体操作步骤见文献[13]。接着使用BCA蛋白质分析试剂盒(上海生工生物工程股份有限公司)测得上清液蛋白质浓度,以此对上清液各生化指标总活性进行归一标准化,得到各特定生化指标活性和含量[19]。
2.4 实验数据处理
本实验的研究区域地图采用Ocean Data View软件绘制,使用Image-Pro Plus对升温过程中珊瑚照片的图像进行处理。所有实验数据均采用IBM SPSS Statistics 23进行单因素ANOVA分析,选定LSD、图基s-b(K)和沃勒−邓肯(W)进行比较,显著性水平设置为0.05。然后再利用Origin 2019b软件将本次实验结果绘制成图。所有的图像整理、汇总均使用CorelDRAW X7进行排版。
3 实验结果
3.1 澄黄滨珊瑚的生理指标变化
3.1.1 表观形态变化
如图2所示,在表观形态上,两组澄黄滨珊瑚对高温胁迫的反应一致,都是随着水温的升高,颜色变淡、触手消失、分泌黏液并在表层形成光亮黏液膜,而后近乎白化。高温胁迫时,两组滨珊瑚在形态上没有明显的响应差异,但经历白化事件组的澄黄滨珊瑚触手伸展更茂密。

图2 两组澄黄滨珊瑚在高温胁迫过程中的形态变化Fig.2 Morphological changes of the two groups of Porites lutea under high temperature stress
3.1.2 共生藻生理指标变化
如图3所示,整个实验过程中,两组澄黄滨珊瑚的叶绿素a含量、虫黄藻密度和最大光量子产量(Fv/Fm)变化模式一致,都是随温度上升而降低,30℃ 前变化不明显(p>0.05),当温度接近 34℃ 时,虫黄藻密度和Fv/Fm均显著下降(p<0.05)。尽管在每个温度下,两组共生藻生理指标值差异不显著(p>0.05),但经历白化事件组滨珊瑚有较高的虫黄藻密度、Fv/Fm值和叶绿素a含量,受高温影响程度更弱。

图3 两组澄黄滨珊瑚温度胁迫过程中生理指标的变化Fig.3 Changes of physiological indexes of two groups of Porites lutea under temperature stress
3.2 澄黄滨珊瑚的生化指标变化
3.2.1 抗氧化物活性变化
在整个升温实验中,未经白化事件组澄黄滨珊瑚的超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、还原型谷胱甘肽(GSH)含量都是先升高后变低,但变化不显著(p>0.05);而经历白化事件组澄黄滨珊瑚的这3种抗氧化物也有着相同变化趋势,除CAT活 性 变 化 不 显 著 外 (p>0.05),SOD活 性 和 GSH含量都会显著地先升后降(p<0.05),并且在实验中,各抗氧化物活性(含量)都高于未经白化事件组,尤其是 30℃ 第 3 天呈现显著性变化(p<0.05)(图4)。过氧化物酶(POD)活性的变化则有所区别,在26℃时,经历白化事件组澄黄滨珊瑚POD活性要显著高于未经白化事件的澄黄滨珊瑚(p<0.05);随后30℃第3天时,前者的活性会逐渐变小,后者酶活性则略有升高,但两者变化都不显著(p>0.05);在34℃第 3天时,两组澄黄滨珊瑚POD活性都减小。这些结果表明,经历白化事件组澄黄滨珊瑚始终有着高的抗氧化物活性。

图4 两组澄黄滨珊瑚温度胁迫过程中抗氧化物活性(含量)的变化Fig.4 Changes of antioxidant activity (content) of two groups of Porites lutea under temperature stress
3.2.2 铵同化酶变化
谷氨酰胺合成酶(GS)是生物体内重要的铵同化酶。如图5所示,在升温过程中,两组澄黄滨珊瑚的GS活性变化趋势一致,都是先升高后降低。在实验的3个阶段,经历白化事件组澄黄滨珊瑚GS活性都高于未经白化事件组,在26℃和30℃第3天时更是有着显著差异(p<0.05),说明其有更好的铵清除响应能力。

图5 两组澄黄滨珊瑚温度胁迫过程中铵同化酶(GS)活性的变化Fig.5 Changes of ammonium assimilation enzyme (GS) activities of two groups of Porites lutea under temperature stress
4 讨论
4.1 涠洲岛澄黄滨珊瑚对高温的生理响应模式
当温度升高时,两组澄黄滨珊瑚都会逐渐出现触手收缩的现象,进一步表现为释放黏液,并在其表面形成一层黏液膜,表面颜色逐渐变浅(图2),这与之前的其他报道一致[13,20]。珊瑚黏液具有多种功能[20-21],如可作为营养成分进行物质循环和能量传递,也对珊瑚有着多重保护作用。由此可见,高温胁迫时,珊瑚触手收缩和黏液分泌等生理变化与其应激保护密切相关。虫黄藻密度、叶绿素a含量和最大光量子产量等光合作用特征被视为珊瑚重要的自养指数,也是评估珊瑚共生体系健康程度的重要指标[22-23]。本实验中,两组澄黄滨珊瑚的自养指数在26~30℃过程中下降均不显著(p>0.05),但在30~34℃期间显著下降(p<0.05)(图3)。在高温胁迫下,珊瑚−虫黄藻共生体系会发生崩溃,使虫黄藻分离导致密度降低[24],而虫黄藻的丧失可以通过胞吐排出、原位消化或宿主细胞脱离等方式实现[25]。因此,升温过程中,虫黄藻密度降低说明珊瑚正在发生细胞凋亡、虫黄藻死亡或被排出体外的现象,温度越高反应越强烈。高温胁迫会导致虫黄藻光合系统电子转移受阻,最大光量子产量也会随之降低[26],也可能会导致虫黄藻出现光抑制现象,进而光合作用能力降低[27]。由此来看,热应力条件下,虫黄藻密度降低势必会使得光合作用减弱,进而导致最大光量子产量和叶绿素a含量降低,这三者之间是存在联系的。
热胁迫会增加珊瑚共生体中的活性氧(Reactive Oxygen Species,ROS)浓度,从而触发抗氧化机制,缓解细胞水平的毒性,保护细胞免受氧化损伤[28]。如生物体会释放出抗氧化类蛋白质,清除体内产生的活性氧和过剩自由基,进而起到保护作用[13,28]。热胁迫致使珊瑚产生的有害物质包括超氧阴离子自由基()、过氧化氢(H2O2)等,其大量富集会引发细胞损伤和病变,可通过超氧化物歧化酶催化形成H2O2[13,29],而H2O2主要由过氧化氢酶降解[13]。同样地,活性氧也可通过还原型谷胱甘肽[30]和过氧化物酶[31]等抗氧化物实现清除。本研究发现,两组澄黄滨珊瑚在26℃、30℃第3天和34℃第3天时,SOD活性、CAT活性和GSH含量都是先上升后下降(图4)。这说明温度升高时,机体会产生大量ROS等对生物体有危害的物质,而30℃第3天时检测出高活性的抗氧化物,这是生物体进行自我免疫保护的结果。当温度超过30℃时,珊瑚体内的ROS会逐渐增多,其来源可能有两个途径:一个是高强度热胁迫使珊瑚机体产生ROS和其他自由基[13,32],另一个是虫黄藻密度下降,光合作用能力大打折扣导致ROS增多[13,27]。逐渐积累的ROS引起的共生体氧化应激会激活核转录因子(NF-kB),进而使宿主产生一氧化氮,最终导致宿主细胞被破坏[24,33]。这使得抗氧化物分泌体也受到损伤,ROS生成速度远远大于其降解速度,大量富集会对珊瑚生理功能造成损伤,导致珊瑚出现白化[13]。正是如此,在34℃第3天时,SOD、CAT和GSH等抗氧化物活性(含量)会呈现下降趋势。而两组澄黄滨珊瑚的POD活性变化趋势有所差别,也与上述的3类抗氧化物变化趋势不一(图4D)。具体原因需进一步探讨,但可推测在26℃时,由于POD本身具备多功能性,能降解CAT催化底物、H2O2、脂肪酸、含氮物质等,因此开始时会检测到较高的酶活性。随着温度的逐渐升高,SOD等抗氧化物增多就会分担POD的一些“工作任务”,进而使得30℃第3天时POD活性减少。而在34℃第3天时,也是由于活性氧增多而导致POD酶体被破坏,其活性进一步降低。
谷氨酰胺合成酶在生物体内负责铵的同化,以降低毒性[34]。其随温度变化模式与上述SOD等一致(图5),GS分泌增多的原因也相似,旨在增强自我保护能力。34℃第3天时,两组珊瑚GS活性显著降低的原因是持续高温使得GS在转录和蛋白质水平上的催化能力被抑制,表达下调,同样地,高温对珊瑚共生体细胞也会造成创伤,进而阻止铵同化,最后导致GS活性显著下降[34-35]。
抗氧化物和铵同化酶在高温时活性(含量)先升后降,可能是珊瑚抵抗环境胁迫的应激响应之一。大量研究也证实本文的发现,如在热胁迫32℃第3天时,指状蔷薇珊瑚(Montipora digitata)SOD、CAT活性会显著升高,在32℃ 第6天时二者活性会降低[5];急性微塑料胁迫下,鹿角杯形珊瑚(Pocillopora damic-ornis)抗氧化能力明显上升,24 h后响应的解毒酶活性会降低[18];在3种造礁石珊瑚的N、P营养盐胁迫实验中发现,持续胁迫压力下,珊瑚的SOD和CAT活性都会先出现峰值,随后便有所下降[36]。但也有对霜鹿角珊瑚(Acropora pruinosa)热胁迫的研究发现,升温过程中SOD、CAT活性会持续升高,即使在33℃第3天时也是如此[8]。这说明,珊瑚应对高温胁迫时,抗氧化物等活性(含量)会有先升后降的趋势,但出现下降的临界点会因珊瑚种类、胁迫温度和高温持续时间而有所不同。
综上所述,面对高温胁迫时,澄黄滨珊瑚的响应模式如图6所示。

图6 澄黄滨珊瑚对高温的响应模式Fig.6 Response pattern of Porites lutea to high temperature
高温下为减少机体损伤,珊瑚会出现触手收缩、黏液分泌和自养指数下降的情况,且抗氧化物和铵同化酶由于ROS等增多其分泌量会显著提升以实现自我保护。当经历极端高温时,细胞结构和相关酶体受损,使得ROS和铵生成速率远远大于其清除速率,ROS等过量富集,珊瑚共生体系严重崩溃,导致珊瑚出现白化。
4.2 高温白化事件对澄黄滨珊瑚耐热性的驯化
珊瑚触手伸展情况可用来评价珊瑚对环境的应激反应[20],而虫黄藻密度和Fv/Fm等自养指数可用于对珊瑚遭遇环境胁迫的响应分析[13]。受到高温胁迫时,与经白化事件组澄黄滨珊瑚相比,未经白化事件组澄黄滨珊瑚触手伸展状态更差,虫黄藻的损失程度更严重,其光合能力的指标(Fv/Fm和叶绿素a含量)值也更低,下降幅度更为显著(图2,图3),整体上生理表现较差。由此可见,经历白化事件组澄黄滨珊瑚在生理指标上有更好的热适应能力。有研究认为,造礁石珊瑚的自养指数可能存在季节变化,如澄黄滨珊瑚的虫黄藻密度冬季最低,叶绿素a含量和有效量子产量(ΦPSII)则是秋冬偏高、春夏偏低[23]。造成此现象的内在驱动因素很多,温度可能是主要原因,自养指数的大小可能与采样海域近期的水温和太阳辐射度相关联。本实验的两组澄黄滨珊瑚样分别采自不同的月份(图1b),但两批样品均带水运输回室内养殖室以循环海水珊瑚养殖缸26℃恒温暂养2个月以上,与实验前温度相差微乎其微,因此,季节的差异性对本研究而言影响不大,两组澄黄滨珊瑚的自养指数对比是可行的。
在同一条件下,耐热性蛋白质标记物的活性大小是珊瑚机体抵御外界能力强弱的一个评判标准[25]。本研究中,经历白化事件组滨珊瑚的SOD、CAT、POD、GSH和GS活性(含量)在各个阶段都更高,变化幅度更大(图4,图5)。实验中的两组澄黄滨珊瑚始终在同一水体环境中,承受相同的环境压力,而经历白化事件组澄黄滨珊瑚始终有着更高的生化指标值,这可能是其应对高温胁迫的一种响应机制,即通过分泌更多抗氧化物和铵同化酶来增强耐热性以保护机体。由于本实验无法使用同一个珊瑚个体,可能个体之间存在差异,导致了部分数据出现较大的标准误差,进而影响了两组数据的差异显著性,但这并不影响总体趋势,经历白化事件组滨珊瑚有着更好的抗氧化性和自我保护能力。对珊瑚的环境胁迫研究也有类似发现,如在三亚蜈支洲岛北侧,反复遭受富营养盐和不利水质环境下的两种造礁石珊瑚(丛生盔形珊瑚Galaxea fascicularis、疣状杯形珊瑚Pocillopora verrucosa),SOD 活性都显著地升高[37-38]。Flores-Ramírez和Liñán-Cabello[39]发现,先前暴露于高温环境压力下的Pocillopora capitata会表现出高水平的SOD活性,以增加抗氧化能力。Keshavmurthy等[40]研究也发现,经历更高温波动的边缘环境的Oulastrea crispata在33℃第3天时会有更好的生理可塑性,是耐热性提高的表现。这说明,经历过胁迫环境或极端高温历史的造礁珊瑚会提高其体内抗氧化物等活性来应对不良环境。
多项研究表明,高温白化事件在一定程度上提高了珊瑚白化阈值,增强了其热耐受性[9-11,41]。由室内的人工驯化结果可知,热驯化会提高珊瑚的耐受性[8,13]。而本实验结果也显示,白化事件对澄黄滨珊瑚的热耐受性确实起到了驯化的效果,使珊瑚再次面对高温时有着更好的抵抗适应性。驱动珊瑚热耐受性提升的因素有多种,如共生藻系群[42]、微生物组成[15]、夏季环境温度和持续时间[43]等。本研究认为涠洲岛海水具有季节性温度波动[15],可能导致了珊瑚代谢活性的弹性变化,这奠定了其生理可塑性的基础,因此经历过高温事件的澄黄滨珊瑚会提高抗氧化物、铵同化酶等活性(含量),增强高温抵抗力,这可能是定向选择与长期进化的结果,是涠洲岛澄黄滨珊瑚适应环境的策略之一。具体可解释为极端高温或反复的热驯化,会使珊瑚共生体频繁分泌抗氧化物等进行抵御,久而久之机体细胞会形成应激记忆,各酶体通路和抵御通道也能更高效地打开,实现珊瑚对高温的抵抗。但其具体的驱动耐热性提高的机制和内在机理有待进一步探索。总体而言,从此研究中可以得出,白化事件在一定程度上可以提升涠洲岛澄黄滨珊瑚的耐热性。
在未来,应结合共生体微生物和分子生物学工具,进行多层次、全方位的分析,进一步探索高温白化事件提升珊瑚热耐受性的机制以及热驯化的持续时间和效果,以加深涠洲岛造礁石珊瑚对热驯化响应的理解。然而,区域高温白化事件使部分珊瑚种类耐热性提高可能会导致其他非耐热性珊瑚物种的消失,因此,我们呼吁从人类能干预的角度尽最大可能做好珊瑚礁保护工作,做好碳减排工作,减缓气候变暖的步伐,给予造礁石珊瑚更多的适应与驯化时间。
5 结论
本研究显示,面对高温压力,白化事件前后的澄黄滨珊瑚均出现表观形态变差、自养指数下降、抗氧化物等耐热性蛋白质标记物活性(含量)显著地先升后降,两组珊瑚具有相同的响应机制。但经历白化事件组澄黄滨珊瑚表观状态更优,自养指数更高,抗氧化物(SOD、CAT、GSH、POD)和铵同化酶(GS)活性(含量)在各个阶段均高于未经白化事件组澄黄滨珊瑚,且响应更高效,表明大规模的高温白化事件在一定程度上可以提升涠洲岛澄黄滨珊瑚的耐热性。研究结果为该地区造礁石珊瑚的高温响应与适应机制以及珊瑚礁保护管理提供了基础数据和科学参考。
