短链脂肪酸肠道转运吸收研究进展
2022-08-17杨立娜王胜男朱力杰蔚彦平何余堂
杨立娜,李 丽,王胜男,朱力杰,蔚彦平,宋 虹,何余堂,刘 贺*
(1 渤海大学食品科学与工程学院 辽宁锦州 121013 2 辽宁省粮谷类食品生物高效转化工程研究中心 辽宁锦州 121013 3 阜新和润生物技术有限公司 辽宁阜新 123000)
肠道是人体重要的消化器官,更是微生物聚集数量、种类最多的区域[1],拥有超过100 万亿个细胞和500 万个编码酶的独特基因,从先天免疫到食欲、能量代谢,对人体健康的许多方面都有重要影响[2]。近年来,越来越多的研究证明肠道菌群与人体健康有着密切的联系,如果两者之间的平衡被打破,就可能导致肠道炎症、代谢紊乱和癌症的发生[1-2]。
短链脂肪酸(Short-chain fatty acids,SCFAs)是由未消化的碳水化合物在肠道内通过肠道菌群发酵而产生的主要代谢产物[3]。它能够有效改善肠道功能,缓解体内炎症,调节细胞增殖分化,同时为结肠细胞提供优先能量来源[2,4]。SCFAs 在人体肠道内多以离子的形式存在[4-5],在吸收和转运过程中以转运体为媒介[6],其主要吸收途径为:①穿过细胞间隙直接扩散;②通过SCFA-2HCO3-进行交换;③脂溶性被动吸收:SCFA-和H+结合后经细胞膜直接吸收,Na+-H+在近端结肠交换耦联,K+-H+在远端结肠交换耦联[7]。本文主要总结SCFAs的来源、种类、检测方法及生理功能,阐述SCFAs在肠道转运的分子机制,为今后更好地解决器官、组织和细胞在平衡吸收SCFAs 与维持体内稳态需求时所面临的问题提供参考。
1 短链脂肪酸的概况
1.1 短链脂肪酸的来源及种类
SCFAs 是碳原子数小于等于6 的饱和脂肪酸,主要包括乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、己酸和异己酸[8],结构如图1所示。8 种SCFAs主要以相应的盐类形式存在,在维持结肠稳态中起着关键作用[9]。肠道中SCFAs 的来源主要有2个途径,一是外源性物质直接对SCFAs 进行补充,另一个是通过宿主肠道微生物酵解肠道中的碳水化合物产生SCFAs[10-11]。肠道菌群发酵生成的SCFAs 大多是乙酸、丙酸和丁酸,占人体肠道内SCFAs 的86%左右,三者比例相对固定,为3∶1∶1[12],而异丁酸、戊酸、异戊酸、己酸和异己酸含量较低[13]。

图1 SCFAs 化学结构式Fig.1 Chemical structure of SCFAs with the formula
乙酸盐由拟杆菌属、双歧杆菌属、真杆菌属等通过乙酰-CoA 或Wood-Ljungdahl 途径由丙酮酸产生[14],也是蛋白质、氨基酸降解发酵的主要产物[15];同时还参与大脑、心脏、脾脏和肌肉的新陈代谢[13,16](表1)。
丙酸盐是由拟杆菌属、梭菌属发酵的产物。它通过琥珀酸途径或丙二醇途径以乳酸为前体从琥珀酸转化为甲基丙二酰-CoA[17],与肠道脂肪酸受体作用可抑制胆固醇合成,调节糖质新生和饱足信号[18],通过结肠吸收后主要由肝脏代谢能量(表1)。
丁酸盐是拟杆菌属、真杆菌属、厚壁菌门等发酵产生的重要代谢物,由丁酰-CoA 通过磷酸转丁酰酶和丁酸激酶或乙酸-CoA 转移酶途径产生[19],或由乳酸、乙酸盐或蛋白质通过赖氨酸途径合成[19-20]。丁酸盐主要参与糖异生、酮体生成及三酰甘油合成等,对糖类和脂类代谢有一定影响,被结肠上皮细胞吸收利用的同时也为其提供能量[17],还能够维持肠道平衡,抑制肿瘤细胞增殖分化,调节基因表达[13](表1)。

表1 SCFA 的产生、途径、分布Table 1 SCFAs production,pathway,distribution
1.2 短链脂肪酸的检测方法
1.2.1 样品的预处理方法 SCFAs 广泛存在于生物体内,然而由于生物样品含量较少,易挥发,组成成分复杂,因此预处理的方法也不尽相同。常通过粪便、血液、唾液、脑脊液、呼出气、瘤胃液、肠内容物等作为生物样品提取SCFAs。目前可通过离心、蒸馏、萃取和超滤的方式对粪便内的固体多相混合物进行分离预处理;而血液中蛋白含量较高,去蛋白是血液样品预处理过程中重要的一部分;尽管尿液中β-羟丁酸、2-羟异戊酸、乙酰乙酸等短链有机酸含量较高,但SCFAs 含量较低。
1.2.2 SCFAs 的检测方法 分析检测生物样品中SCFAs 有不同的方法,包括气相色谱、高效液相色谱、质谱分析[26]、电化学检测[27]或气相色谱-质谱检测[28],如表2所示。此外,毛细管电泳也被用于SCFAs 的定量检测中[28]。在这些方法中,气相色谱-质谱是生物样品中最常用的测量方法,它具有较高的灵敏度。然而,直接进行气相色谱-质谱分析具有较低的回收率[29],有可能污染气相色谱柱,Zhang 等[30]建立了一种改进的低温衍生化气相色谱-质谱方法分析小鼠粪便和血清样品中的SCFAs,该方法克服了以往衍生化方法的缺点,具有高灵敏度、高回收率、高重复性和低检出限等优点,适用于分析复杂、小批量的生物样品(如小鼠粪便和血清样品)中的SCFAs 和其它挥发性化合物。Wang 等[31]成功建立了一种简单、快速的定量气相色谱法,用于准确、有效地测定大鼠血浆样品中短链脂肪酸的浓度。谭力等[32]建立了一种灵敏度较高,适用于C1-C10 的脂肪酸,用荧光剂9-(2-羟乙基)咔唑进行预处理后,无需再次提取,直接通过乙腈稀释后,直接进入液相色谱进行分离检测的方法。

表2 短链脂肪酸检测方法[5,24,33]Table 2 Short chain fatty acid detection methods[5,24,33]
2 短链脂肪酸在肠道转运的分子机制
2.1 分子机制
SCFAs 具有较小的相对分子质量和较高的水溶性、水解率,相比于其它脂肪酸更容易在肠道消化、吸收。SCFAs 主要通过分布在结肠细胞和小肠细胞上的羧酸转运体和钠偶联羧酸转运体被吸收[34],在人体内的吸收与代谢如图2所示,其中乙酸盐进入门静脉后参与大脑、心脏、脾脏及肌肉的新陈代谢;丙酸盐到达后可被肝脏吸收利用;少部分丁酸盐通过门静脉参与体循环,大部分被结肠上皮细胞吸收[11,15]。
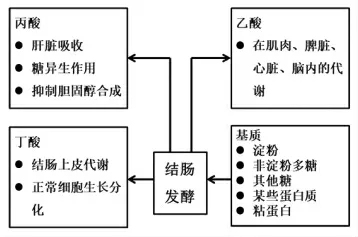
图2 SCFAs 的吸收与代谢[35]Fig.2 Short chain fatty acid absorption and metabolism[35]
结肠肠腔内游离阴离子(SCFA-)大部分通过肠黏膜直接在结肠吸收[36]。在正常的生理条件下,SCFAs 以离子和非离子的形式被吸收,并以非离子的形式扩散通过上皮细胞[37]。
在没有转运蛋白的纯脂双分子层顶端摄取未解离的酸 (Undissociated acid,HSCFA) 内流后,HCO3-和其它缓冲溶液发生质子化迅速解离[38]。在一个没有CO2损失的封闭体系中,缓冲液释放质子并与H2CO3相互转化提供基底外侧射流所需的质子。流出必须与流入相等,在具有相同渗透性膜的转运模型中,HSCFA 在细胞根尖膜上扩散的浓度梯度必须与在基底外侧膜上扩散的浓度梯度相同[38-39]。因此,为了维持细胞内渗透性,基底外侧膜对SCFAs 的渗透性必须比根尖膜强得多[40]。就酸碱平衡而言,HSCFA 的扩散流出(图3a①)、SCFA-交换HCO3-(图3b②)和SCFA-与H+的共输运(图3b③) 都导致了相同的pH 值变化和HCO3-的减少,因此细胞质酸碱稳态是相同的。只有渠道介导的流出(图3b④)是根本不同的[41]。在封闭和开放缓冲系统中,只有当HSCFA 的浓度梯度在根尖和基底外侧膜上相等时,才能达到流入等于流出的平衡条件。这导致细胞质中SCFAs 的大量积累,这与细胞生存不相容。SCFAs 的基底外侧外排必须通过转运蛋白来促进[38-41]。

图3 SCFAs 转运吸收模型(无转运蛋白纯脂双分子层)[38-41]Fig.3 SCFAs transport uptake model (transporter free pure lipid bilayer)[38-41]
在结肠和盲肠中,主要的阴离子是SCFA-而不是Cl-。SCFA 的根尖可能以未解离酸HSCFA(图4③)的形式;通过顶端阴离子交换剂DRA(图4①)或单羧酸转运体MCT1(图4④)吸收转运[42-43],这3 种途径均会导致细胞质的酸化。当丁酸被广泛代谢时,有效的外排机制,如基底外侧表达的主要阴离子交换剂AE1 和AE2 (图4⑨)或MCT4(图4②),需要调解乙酸和丙酸的外排[40]。底侧转运蛋白NHE1(图4⑩)和NBCe1(图4⑦)在结肠细胞的pH 稳态中发挥重要作用[43]。由于这些蛋白质摄取的Na+通过电解质消耗(图4⑧,图4⑤),SCFA-阴离子的流出也必然与电解质有关,可能与基底外侧膜中的VRAC 的表达有关 (图4⑥)[40,43-44]。

图4 介导Cl-运输的转运蛋白在体内吸收SCFAs[16,40,42-44]Fig.4 Transporters mediating Cl- transport take up SCFAs in vivo[16,40,42-44]
大多数SCFAs 被Na+吸收作为反向阳离子,从而促进SCFAs 的运输[40]。根据经典模型,SCFAs被脂膜吸收,脂膜被微绒毛放大[45]。HSCFA 在细胞质内解离后,通过NHE3 顶端挤压质子(图5②),恢复细胞质内的pH 稳态,创造出一个酸性环境,进一步供SCFAs 质子化吸收[46-47]。Na+通过Na+/K+-ATPase(图5⑧)消耗并对K+(图5⑤)进行循环利用。为了保持电荷平衡,SCFA-阴离子也必须在电解质过程中离开。由于膜电位是一种驱动力,且不发生饱和效应,因此通过VRAC 射流是最有效的选择(图5⑥)。由于SCFA-的基底外侧射流是由Na+的电荷耦合驱动的[37],因此整个过程是电中性的,不会产生电流。SCFA-通过DRA (图5①)和MCT1(图5④)刺激NHE3(图5②)。在远端结肠,结肠K+/H+ATPase 可能会介入NHE(图5⑩),屏障形成紧密连接蛋白,如claudin-1 可防止Cl-从细胞旁流入和SCFA-阴离子的流出(图5⑦)[40,45-47]。

图5 Na+与SCFA-的吸收[40,45-47]Fig.5 Na+ uptake with SCFA-[40,45-47]
2.2 体外模型
体外模型可以有效帮助识别肠道微生物和肠道转运机制,尽管哺乳动物结肠SCFAs 的吸收机制仍有争议,如使用顶膜囊泡研究肠道运输可能不足以反映肠道吸收过程,在一定生理条件下,各种驱动力如pH 值、无机离子和膜电位对载体功能的激活作用很难通过体外研究来评估[48]。Caco-2细胞是一种人结直肠腺癌细胞,在适宜的培养条件下,可以分化为肠上皮细胞并形成连续的单层,与小肠细胞吸收的生理功能相似,能够更好的体现研究结果[49],该细胞系在肠道吸收研究中能形成分化良好的上皮细胞,并表现出多种功能特性,如载体介导的转运系统、受体和顶膜酶活性[50]。虽然体外细胞模型不能完全模拟生物体内的转运、吸收和代谢过程,但可以通过控制培养条件在细胞和分子水平上研究营养物质的吸收、转运及代谢机制,为机理研究提供便利和保障。
陈婷婷[51]采用体外建立的Caco-2 上皮肠屏障功能模型,发现抗性淀粉、低聚果糖、高粱和玉米阿拉伯木聚糖4 种不同支链结构的膳食纤维发酵产物对屏障功能的影响与其SCFAs 浓度呈正相关,适当浓度的SCFAs 传递给含有高丁酸盐比例的上皮细胞缓慢发酵可能会改善肠道的屏障功能[52]。Yufeng 等[21]通过Caco-2 细胞模型初步论证了7,8-二羟基黄酮的跨皮转运机制,在不同环境因素,如时间、浓度、pH 值和代谢抑制剂等的双向渗透环境下,均会对7,8-二羟基黄酮运输过程产生影响。Li 等[53]也通过Caco-2 细胞模型研究生物黏附性辅料对总黄酮吸收的影响。
3 短链脂肪酸的生理功能
3.1 维持肠道微生态平衡
SCFAs 是肠道微生物的重要代谢产物,可为肠上皮细胞提供营养及能量,改善肠道功能[54]。据报道,乙酸或丁酸的发酵产物可为肠黏膜上皮细胞提供60%~70%的能量,乙酸是通过血液进入肝脏,并代谢能量给周围组织;丁酸可被上皮细胞吸收和利用,这是人类结肠和盲肠最重要的能源[13]。李可洲等[55]通过观察小肠黏膜形态学变化,发现SCFAs 对肠黏膜有较强的促生长作用。Moen 等[56]通过对服用大麦及燕麦成长期猪仔的肠道微生物及SCFAs 进行分析发现,服用经过处理过的大麦谷物可显著降低粪便中肠道菌群的种类及数量,而丁酸盐可以显著提高乳酸杆菌及双歧杆菌的数量。
3.2 缓解机体内炎症
SCFAs 对机体内炎症反应也有一定的调控作用,包括预防肠道炎症,降低结肠癌风险[57]。Tedelind 等[58]研究发现,丙酸和丁酸可通过IL-6蛋白调节肠道微生物治疗肠道炎症,也可以抑制TNF-α 因子释放,因此SCFAs 能够调控机体内的肠道炎症[57-58]。Chander 等[59]采用SCFAs 诱导巨噬T 细胞及病原菌,研究发现,SCFAs 可显著降低巨噬细胞及病原菌的数目,诱导机体内巨噬细胞发生凋亡,破坏病原菌,抑制伤寒的发生。Zuriguel等[60]也发现SCFAs 能够有效改善溃疡性结肠炎症状。
3.3 调节细胞增殖、分化及衰亡
肠道肿瘤可以通过SCFAs 抑制肿瘤细胞的增殖,诱导其凋亡分化,其中丁酸是最主要的抗肿瘤物质[61];SCFAs 不仅能够保护肠黏膜,还对结肠上皮细胞增殖和黏膜生长有促进作用[52]。陈宗元等[62]研究发现,SCFAs 类药物可以抑制肿瘤细胞周期,诱导细胞凋亡并减少肿瘤细胞增殖。丁酸盐也可以减少IL-6 和TNF-α 分泌刺激原代小鼠胶质细胞[63];SCFAs 通过LPS 刺激原代单核细胞,减少单核细胞趋化蛋白(MCP)-1 的分泌[64]。Tong等[38]发现丙酸和丁酸等可通过增加AMP 活化蛋白激酶的活性,来增加肠上皮细胞中紧密连接蛋白ZO-1,或增强肠黏膜机械屏障功能从而抑制肠道通透性[65]。由于SCFAs 特有的多种生理功能,近年来SCFAs 的开发利用已成为研究热点,以期将SCFAs 用于临床。
SCFAs 在调节能量代谢以及胰岛素敏感性中起着重要作用[66]。膳食中的SCFAs 似乎是“间接营养素”,可以调节脂肪代谢和免疫。徐俊科[67]采用Caco-2 细胞培养体系,研究了不同膳食长链脂肪酸对肠道上皮细胞脂肪酸转运相关基因的影响,发现随着长链脂肪酸浓度升高,脂肪酸转运相关基因 (PPARα,L-FABP,DGAT,MTP)mRNA 的表达量显著上调。
4 展望
人们逐渐认识到SCFAs 在人体健康和疾病预防中的重要作用,发现饮食与肠道微生物群的多样性和功能之间的关系,及其对人类健康的重要性是目前的研究重点。SCFAs 作为肠道菌群的代谢产物,具有许多重要的功能,如维持肠道平衡和宿主健康,预防多种疾病等。许多科学报告都证实了SCFAs 与炎症性肠病、肠易激综合征、2 型糖尿病、肥胖、自身免疫性疾病或癌症等疾病有一定联系,而使用益生菌来预防和缓解肠道生态失调,使得结肠中SCFAs 的增加,似乎是进一步研究的重要方向。因此,研究SCFAs 在肠道中的转运吸收机制,并提出新的治疗思路及方法,对相关食品的开发及临床研究具有借鉴意义。
