酿酒酵母表面展示金属硫蛋白吸附葡萄酒中的铜离子
2022-08-17吕林灿刘延琳宋育阳
黄 蓉,吕林灿,李 莹,张 阳,刘延琳,宋育阳*
(1 西北农林科技大学葡萄酒学院 陕西杨凌 712100 2 茅台学院 贵州仁怀 564500)
铜是葡萄酒产业中最受关注的一类重金属,对葡萄酒的品质影响很大。欧盟和南非规定葡萄中的铜含量不得超过20 mg/L,葡萄酒中不得超过1 mg/L[1-2]。然而,13%的葡萄和18%的葡萄酒都存在铜残留量超标的现象。铜元素在低浓度范围,对葡萄酒发酵有积极的影响[3],而过量的铜会抑制细胞的代谢活动,甚至可能产生毒性[4]。研究发现高浓度铜会导致发酵延迟,并降低酒精产量[5-6]。除此之外,铜还影响酒精发酵的副产物。适量的铜离子使葡萄酒中的硫化氢生成量减少,过量则会促进硫化氢的生成[7],增加发酵中糖和挥发酸的残留量[6],并加速葡萄酒中多酚类物质的氧化速率,最终导致葡萄酒质量下降[8]。总之,铜影响酿酒酵母的活性,继而影响葡萄酒的整个发酵过程。在人体内,铜主要由胃肠道吸收,并随部分粪便排出体外,其余的被转运至肝脏中[9]。若铜摄入过多,就会影响动物肝脏、肾脏的正常形态与功能,扰乱其氧化-还原平衡,还会导致人体脑组织抗氧化功能受损[10]。
随着葡萄酒工艺的改良,现阶段针对葡萄酒铜破败的主要解决办法是通过添加 “下胶剂”下胶、过滤去除。而下胶过程比较复杂,下胶剂的用量不易精准判断,存在“下胶不完全”或“下胶过量”的现象,其残留物也会危害到人体健康,污染环境,影响葡萄酒的感官品质和香气质量[11-12]。近几年,研究人员发现酿酒酵母对重金属有很好的吸附作用。采用酿酒酵母吸附重金属,具有廉价、安全、高效、来源稳定等特点,在重金属生物吸附方面,具有较大潜力。葡萄酒酿制过程中,酿酒酵母进行酒精发酵的同时,去除多余的铜离子,不仅能确保葡萄酒的安全性和质量,也有助于保留葡萄酒原本的颜色和风味[12],并对环境没有恶劣影响。
金属硫蛋白(通常简称MT)是生物体内普遍存在的一种重要的生命物质,其定义为一类低分子质量,高巯基,能结合金属离子,性能独特的蛋白质[13]。到目前为止,人们已从哺乳动物、植物和微生物等多种生物体内分离、提纯得到金属硫蛋白[14-15],并发现它能吸附镉,还有锌、铜、汞等离子。金属硫蛋白的生物学意义涉及生物机体微量元素贮存、运输和代谢、重金属解毒、自由基清除以及机体生长发育、生殖衰老、免疫抵抗等各个方面,关于它的研究也涉及农业、医药保健、生物工程、环境保护、化妆品研发等各个领域[16]。
本研究以酿酒酵母(Saccharomyces cerevisiae)288c 为金属硫蛋白CUP1 的供体,利用酵母细胞表面展示技术表达并附着在酿酒酵母二倍体82-9-35 的细胞表面,以期在酿酒酵母发酵过程中,吸附葡萄酒中的铜离子,并最终随酵母菌体一起被过滤掉,从而达到去除葡萄酒中铜离子的目的。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与引物 以酿酒酵母(S.cerevisiae)288C(MATα;SUC2;gal2;mal;mel;Flo1;flo8-1;hap1;ho;bio1;bio6)基因组为模板,宿主菌株为酿酒酵母二倍体 (S.cerevisiae 82-9-35)菌株(实验室前期分离得到,his3Δ1,为SD-Ura 缺陷性酵母),这2 株菌均为实验室保存。试验中对酿酒酵母S.cerevisiae 82-9-35 进行改造,获得重组菌株菌二倍体酿酒酵母(S.cerevisiae 82-9-35-CUP1)。大肠杆菌(E.coli)DH5α,南京诺唯赞生物科技有限公司。出发质粒GAP-α-factor-EGII-Sed1 为实验室前期构建的质粒,包含启动子GAP,信号肽α-factor,锚定蛋白Sed1 和目的蛋白EGII;因为金属硫蛋白CUP1 的催化活性位点在C末端,所以需将原质粒的锚定蛋白替换为C 末端结合的锚定蛋白Flo1p,目标蛋白替换为CUP1,即构建出酵母表面展示金属硫蛋白的重组质粒GAP-α-factor-Flo1p-CUP1。

表1 引物序列Table 1 Primer sequences
1.1.2 工具酶与主要试剂 0.4 mol/L 碳酸钠溶液、乳酸缓冲液 (pH 3.0)、0.4 mol/L 的三氯乙酸、0.5 mol/L 的氢氧化钠、10.00 mg/mL 酪素溶液、100 μg/mL 酪氨酸标准溶液、1 mol/L Tris-HCl(pH 8.0)、0.5 mol/L 乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA,pH 8.0)、TE 缓冲液 (Tris-EDTA buffer solution)、氨卡青霉素(Amp)、1 mol/L 山梨醇、酵母感受态制备处理液、酵母全营养培养基(YPD)、尿嘧啶缺陷型合成葡萄糖基础培养基(SD-URA)、Luria-Bertain(LB)培养基和LB-Amp 培养基的配制方法参照Zhang 等[17]的方法。In-Fusion HD Cloning kits、DNA 凝胶纯化试剂盒、SD-Ura DO Supplement、Premix TaqTM(Ex TaqTMVersion 2.0 plus dye)、DNA Markers 和DNA 限制性内切酶(Cla I、Xba1、Sma I),宝生物(大连) 有限公司;PhantaRSuper-Fidelity DNA Polymerase,南京诺唯赞生物科技有限公司;DNA 提取液 (酚∶氯仿∶异戊醇=25∶24∶1)、1 mol/L 二硫苏糖醇 (DL-dithiothreitol,DTT)、DNA 纯化试剂盒和酵母基础氮源(YNB),北京索莱宝科技有限公司;引物的合成和DNA 测序交由上海生物工程有限公司完成。
1.2 方法
1.2.1 CUP1 目的蛋白和锚定蛋白基因的克隆 目标基因CUP1 和Flo1 均以酿酒酵母288C 的基因组为模板,高保真酶PCR 体系参照PhantaRMax Super-Fidelity DNA Polymerase 说明书。对扩增后的PCR 片段进行试剂盒纯化回收,得到目的蛋白基因CUP1 片段和锚定蛋白基因Flo1 片段,用于后续试验。
1.2.2 酿酒酵母表面展示金属硫蛋白载体的构建 通过双酶切和In-fusion 技术将锚定蛋白Flo1p和金属硫蛋白CUP1 先后替换掉实验室前期构建好的质粒GAP-α-factor-EGII-Sed1 中的EGII 和Sed1 蛋白,构建出金属硫蛋白的表面展示载体GAP-α-factor-Flo1p-CUP1,展示系统构建流程如图1所示。
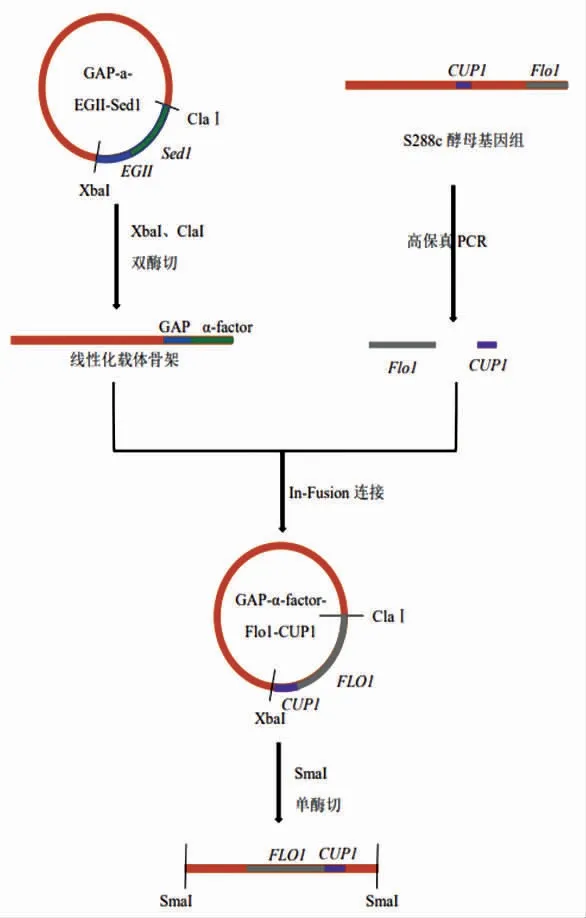
图1 酵母表面展示系统构建流程图Fig.1 Flow chart of construction of yeast surface display system
1.2.3 大肠杆菌转化 一步克隆连接的表达载体转化入E.coli DH5α,涂布在LB-Amp 固体平板上,37 ℃培养12~14 h,挑取单菌落用Taq 酶体系(参考宝生物(大连)有限公司)进行菌落PCR 验证,引物为CUP1-f 和CUP1-r。将验证成功的大肠杆菌单菌落接种在LB-Amp 液体培养基中,37℃,180 r/min 振荡培养12 h。
1.2.4 目标酶基因插入酵母基因组 用OMEGA质粒提取试剂盒提取大肠杆菌中含有CUP1 的重组质粒,用DNA 限制性快切酶Sma Ⅰ单酶切后,进行试剂盒纯化回收。将回收后的DNA 片段,转化至SD-Ura 缺陷性酿酒酵母二倍体82-9-35(目标片段依靠His3 组氨酸同源臂与酵母基因组发生同源重组),后涂布在SD-Ura 平板上,30 ℃恒温培养48 h,挑取酵母单菌落进行酵母菌落PCR验证重组酵母。Taq 酶体系PCR 验证引物为CUP1-f 和CUP1-r。
1.2.5 铜离子测定方法 采用分光光度法测定溶液中的铜离子浓度。在紫外分光光度计上设定波长734.0 nm[18]。(1)用空白溶液,即10 mmol/L EDTA 稀释铜离子溶液,制备浓度梯度为0,2,4,6,8,10 mg/L 的标准溶液进样标定。(2)取菌液以8 000 r/min 离心3 min,收集上清液作为样品,测量吸光度,每次测量做3 次平行,最终结果取其平均值。数据处理和图片绘制由office Excel 2016和Rstudio(64 位)完成。
1.2.6 铜离子耐受性研究 分别将重组菌(S.cerevisiae 82-9-35-CUP1)和原菌株(S.cerevisiae 82-9-35)接种在YPD 液体培养基中,30 ℃,200 r/min 条件下培养16~18 h。血球计数板计数,以1×106CFU/mL 的接种量再分别接种在含铜离子的YPD 液体培养基(铜离子质量浓度分别为10,15,20,25,30 mg/L) 中,30 ℃,200 r/min 条件下培养。观察培养基状况,待低质量浓度铜离子的培养基混浊后,再通过血球计数板计数。对比不同质量浓度的铜离子,重组酵母在培养前、后的菌株数量变化,进行数据分析。
1.2.7 细胞表面金属离子解析 金属硫蛋白的重金属吸附平衡是一个动态平衡,它的吸附过程包括胞内吸附和胞外吸附2 个过程。为研究金属硫蛋白在细胞表面表达后对酵母解析重金属能力的影响,将吸附平衡后的酵母菌用解析液,如EDTA或H2SO4解析处理[19]。Cu2+吸附平衡后,收集菌体,ddH2O 洗3 次;10 mmol/L EDTA 在30 ℃,150 r/min 条件下解析1 h;8 000 r/min 离心3 min,取上清液。测量上清液中Cu2+浓度,计算好上述试验中的稀释倍数,计算即得酵母表面金属离子解析浓度。结合1.2.6 节的试验结果计算出单位菌体表面吸附铜离子的量,做解析后铜离子浓度的对比图和单位菌体表面吸附铜离子浓度对比图。
2 结果与分析
2.1 重组质粒的构建
以酿酒酵母288C 基因组为模板,PCR 扩增锚定蛋白基因Flo1、金属硫蛋白基因CUP1 经试剂盒纯化回收后,通过琼脂糖凝胶电泳验证,Flo1 基因片段长度为3 264 bp,CUP1 基因片段长度为291 bp,如图2和图3所示,所有片段长度均符合预期。在实验室前期已构建好的载体GAP-α-EGII-Sed1 中,先、后插入锚定蛋白基因Flo1、金属硫蛋白基因CUP1 的金属硫蛋白表面展示载体。XbaⅠ、ClaⅠ双酶切电泳结果如图4所示,有2 个条带说明原质粒GAP-α-factor-EGII-Sed1 线性化成功。重组质粒载体上有EcoRⅠ位点,SphⅠ位点和XbaⅠ位
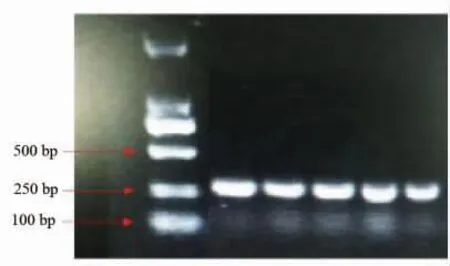
图2 CUP1 琼脂糖凝胶电泳验证Fig.2 CUP1 agarose gel electrophoresis verification

图3 Flo1 琼脂糖凝胶电泳验证Fig.3 Flo1 agarose gel electrophoresis verification

图4 XbaⅠ、ClaⅠ双酶切验证Fig.4 XbaⅠand ClaⅠdouble enzymedigestion verification
点存在于目的基因和锚定蛋白基因上,凝胶电泳结果图5显示3 个酶切位点均已切开,说明目的基因、锚定蛋白基因与原质粒载体三者成功相连,重组质粒GAP-α-factor-Flo1p-CUP1 构建成功。

图5 重组质粒双酶切验证Fig.5 Recombinant plasmid double restrictiondigestion verification
2.2 电激转化酿酒酵母
图6凝胶中7 000 bp 和4 000 bp 处有2 条条带,与重组质粒含有2 个SmaⅠ位点的预期相同,重组质粒已被线性化。参考文献[20]的方法制备酵母感受态并进行酵母电转化。将转化子划线在YPD 和SD-Ura 平板上,恒温30 ℃,培养48 h 后,进行菌落PCR 验证,验证引物为CUP1-f 和CUP1-r。

图6 SmaⅠ单酶切验证Fig.6 SmaⅠsingle restriction digestion verification
2.3 铜离子吸附验证
设置紫外分光光度计在734.0 nm 波长处测量铜离子标准溶液进行标定,处理结果得出一元线性回归公式为:y=0.0025x+0.0635,R2=0.9809,并绘制一元线性回归曲线。

表2 铜离子标准曲线Table 2 Copper ion standard curve
2.3.1 铜离子耐受性研究 最后一次接种后,试验组和对照组酵母培养约36 h,从图中可明显看出,整体上酿酒酵母的生长随浓度呈上升趋势,说明一定浓度下的铜离子对酵母生长有促进作用。且重组菌(S.cerevisiae 82-9-35-CUP1)的生长状况明显优于原菌株(S.cerevisiae 82-9-35),与试验前预测:金属硫蛋白的表面展示可提高酵母菌的重金属耐受性相符合。
2.3.2 细胞表面金属离子解析 根据图7的回归曲线和稀释倍数(2 倍),由吸光度A 计算解析后的铜离子浓度,结果与图8中试验结果相除得到单位菌体表面吸附的铜离子量。从图9、图10和表3可知,重组菌株表面的解析浓度要明显高于对照组,说明金属硫蛋白的表面展示显著提高了酵母的胞外吸附能力,且单位菌体的吸附量也随铜离子浓度的增加而增加,可能由于酵母菌细胞内吸附铜离子速度远慢于细胞外吸附,而导致更高浓度的铜离子环境下酵母表面更容易堆积铜离子所致。

图7 铜离子标定回归曲线Fig.7 Regression curve of copper ion calibration

图8 铜离子耐受性曲线Fig.8 Copper ion tolerance curve
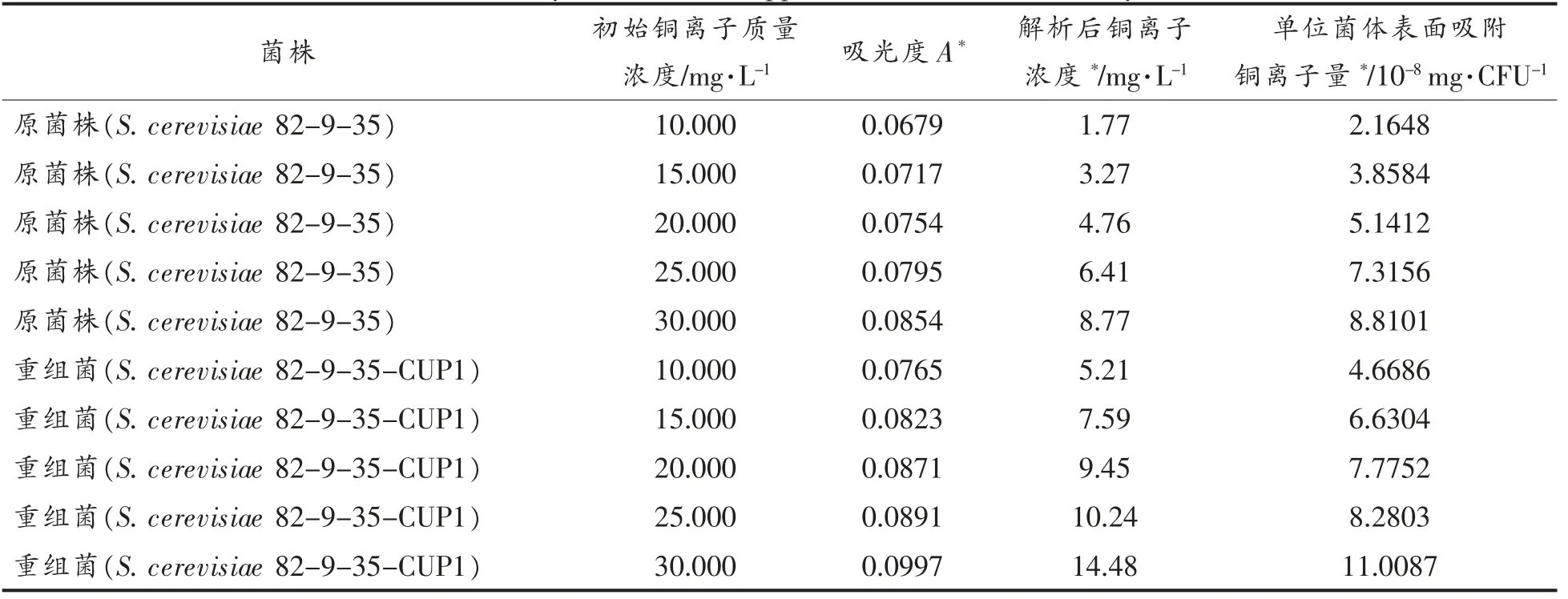
表3 酵母表面铜离子解析试验结果Table 3 Analysis results of copper ions on the surface of yeast

图9 解析后铜离子浓度的统计图Fig.9 Statistical graph of copper ion concentration after analysis

图10 单位菌体表面吸附铜离子统计图Fig.10 Statistical graph of adsorption of copper ions on the surface of a unit cell
3 讨论
酵母表面展示技术 (Yeast surface display,YSD) 是一种将蛋白质自动固定在酵母细胞表面的技术,研究已成功地将不同的酶,如纤维素酶、脂肪酶和金属结合肽蛋白等固定在细胞表面,通过生物自身的代谢,最大限度地提高各种蛋白质的产量和活性[21-23]。酵母菌株全细胞在生物催化过程中具有多种优势:所需的反应条件温和,具有立体选择转化的能力,而无需添加昂贵的外部辅因子,生物催化剂易于回收,产生的废弃污染物少,而且具有在难以穿透细胞或蛋白质固定化的底物上催化反应的可能性[22,24-25]。因此,它提供了在不利的介质中进行反应的机会,并增加了异源蛋白对pH 值、温度、有机溶剂或蛋白酶的稳定性,可以最大程度地减少或完全避免酶对产品的污染,甚至可以改善其动力学性能[26]。除此之外,pH 值对金属硫蛋白的金属吸附也有很大的影响[27]。金属硫蛋白在低pH 值条件下很稳定,然而当pH 值调至中性时,金属硫蛋白分子间发生二硫交联,形成大分子聚合物,对金属吸附能力产生影响[28],温度等则会对其吸附金属时的化学反应效率产生影响[29]。Kao 等[30]通过将金属硫蛋白分别表达在大肠杆菌细胞质和细胞周质中,发现表达位置对细胞金属吸附能力的提高有一定影响,细胞周质提高细胞吸附性的幅度更大。酵母细胞表面展示金属硫蛋白可以提高酵母的重金属吸附能力,金属硫蛋白在表面快速的吸附重金属离子后,便依赖于宿主细胞的代谢,进行缓慢的胞内累积过程[31],故而相较于在细胞内过表达金属硫蛋白,以提高细胞对金属离子的吸附能力,细胞表面展示具有更大的优势,不仅它本身可以吸附金属,还能提高重组菌吸附金属的能力和金属耐受性。
在酵母表面展示蛋白质,展示效率可能在很大程度上取决于目标肽/蛋白质的大小和性质[32]、锚长度和间隔、连接区的位置[33]、锚定蛋白本身的性质和启动子的影响[34]。启动子作为转录调控的重要元件,可显著影响目标基因所转录的mRNA的丰度以及mRNA 的降解速率等,进而影响目标蛋白在宿主中的表达[35]。为了提高细胞表面展示效率,不仅需要根据目标蛋白选择合适的锚固系统,还需要增加表面展示基因表达盒的拷贝数,并且实现宿主二倍体化[36]。如Yamada 等[37]报道,当表面展示纤维素酶的工程酵母菌株通过交配进行二倍化并评估其乙醇发酵性能时,观察到乙醇产率增加约2.5 倍。在本试验中为了提高展示效率,构建了高拷贝质粒GAP-α-factor-Flo1p-CUP1,选择了强启动子GAP 和二倍体酿酒酵母宿主,这是由于与单倍体菌株相比,二倍体菌株具有更高的细胞生长速率,细胞产量和对各种胁迫的耐受性。同时为了简化工艺,降低成本,试验选择具有絮凝功能的Flo1p 蛋白作为锚定蛋白,在发酵结束后,酵母细胞间相互黏连形成絮凝颗粒沉积到罐底,有利于实现发酵液和沉积物的分离。
截至目前,酿酒酵母表达异源蛋白使用最多的信号肽是依然是α-factor 信号肽[38]。α-factor 信号肽不仅含有1 个靶向内质网信号肽(19 aa),还包含有1 个前导区(66 aa)。在内质网腔中,靶向内质网信号肽被切除,形成囊泡转运至高尔基体,在高尔基体中,再由Kex2 内肽酶剪切羧基端肽键释放前导区,形成具有功能的蛋白质,最终在囊泡包裹下抵达细胞外并发挥蛋白功能[39]。α-factor 信号肽帮助蛋白质穿膜引导外源蛋白在酵母中的分泌表达,其有利于重组菌的筛选和表达[34]。基于以上因素,为了确保从表达盒产生的包含金属硫蛋白的融合蛋白能够通过细胞机制正确地定向到细胞表面,本研究引入了α-factor 信号肽。
4 结论
本试验以金属硫蛋白基因CUP1 为目的基因,Flo1 为锚定蛋白基因,通过酵母表面展示技术搭建了酿酒酵母表面展示系统,并成功在细胞表面表达。使酵母菌作为铜离子吸附剂的效率更高,同时监测重组酵母的生长发现,表面展示CUP1并没有对宿主菌株造成代谢压力而对其生长造成不利影响。探索了重组酵母关于铜离子的耐受性以及对铜离子的吸附力,最终结果表明,金属硫蛋白的表面展示对提高酵母菌铜离子耐受性和胞外铜离子吸附能力有显著效果。
