植物乳杆菌LNL2-4-2对互隔交链孢霉的抑制作用
2022-08-17吕欣然高永悦葛永红励建荣白凤翎
吕欣然,高永悦,杜 宏,葛永红,励建荣,白凤翎
(渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁省食品安全重点实验室 辽宁锦州 121013)
互隔交链孢霉(Alternaria alternata)隶属于半知菌亚门、暗色孢科、交链孢属,是一种广泛存在于自然环境中的真菌。互隔交链孢霉可以产生互隔交链孢酚、细交链孢菌酮酸和互隔交链孢酚单甲醚等致病因子,引起采后苹果、梨、西兰花、胡萝卜等果蔬的黑斑病和枯萎病,造成一定的经济损失[1-2]。通常用化学杀菌剂控制互隔交链孢霉的危害,然而,其存在药物残留,产生抗药性和污染环境等问题。目前急需研发一种无残留、无毒副作用和环境友好型的天然杀菌剂。Pane 等[3]研究发现野生辣椒提取物对互隔交链孢霉具有拮抗活性,以剂量依赖的方式影响菌丝体生长,抑制分生孢子萌发,菌丝体抑制率为43%~82%,孢子萌发抑制率为40%~53%,同时,可显著减少人工感染的成熟番茄软腐病发生。张伟等[4]发现鹿蹄草素对链格孢菌的抑制作用随质量浓度升高而增强,当质量浓度为2.50,5.00 g/L 时,抑菌率均达100%。植物源活性物质对互隔交链孢霉的抑制作用研究较多,而微生物制剂对互隔交链孢霉的抑制作用研究较少。
乳酸菌(Lactic acid bacteria,LAB)作为一种生物制剂,其能够分解碳水化合物产生乳酸、脂肪酸、过氧化氢、罗伊氏菌素和细菌素,来抑制细菌和真菌的生长[5]。李院等[6]从酱菜中分离3 株对青霉及曲霉有较强拮抗作用的乳酸菌L511、L520、L544,它们的抑菌圈直径均大于18 mm。石金鑫[7]从发酵食品中分离筛选出2 株对扩展青霉和黑曲霉有较强拮抗活性的乳酸菌SC3 和PC3,对扩展青霉的抑制率分别为61.92%和62.62%,对黑曲霉抑制率分别为65.96%和76.03%。Lv 等[8]筛选获得1 株植物乳杆菌C10,对粉红单端孢有显著抑制作用,抑制率达93.93%;在甜瓜感染粉红单端孢的体外应用研究中,经植物乳杆菌C10 处理,感染区面积减少了19.58%。然而,目前乳酸菌对互隔交链孢霉的抑制作用鲜有研究报道。
本文以来自典型苹果黑斑病果实的互隔交链孢霉为研究对象,采用菌饼法从发酵蔬菜中分离筛选对互隔交链孢霉有较强抑制作用的乳酸菌。研究不同浓度乳酸菌处理对互隔交链孢菌丝生长及孢子萌发、孢子膜完整性、丙二醛、可溶性蛋白质、可溶性糖含量以及超微结构的影响,阐明乳酸菌对互隔交链孢霉的拮抗机制;并进一步探究乳酸菌对苹果黑斑病的控制作用。本研究以期为研发乳酸菌生物制剂控制果蔬采后病害提供理论依据。
1 材料与方法
1.1 材料与试剂
互隔交链孢霉(Alternaria alternata)菌株Bd-12:分离自典型苹果黑斑病果实。
乳酸菌菌株:LNL1-4、LNL1-5、LNL2-4-1、LNL2-4-2、LNL2-5 分离自辽宁锦州百合食品有限公司腌渍萝卜。
以上菌种均保藏于本院微生物学与分子生物学实验室。
富士苹果,辽宁省锦州市科技路市场。
马铃薯葡萄糖琼脂培养基(PDA)、MRS 液体培养基、马铃薯葡萄糖肉汤(PDB),北京奥博星生物技术有限责任公司;Taq PCR Master mix、细菌基因组DNA 快速抽提试剂盒、DNA marker-D,生工生物工程(上海)股份有限公司;乳酸菌生化鉴定管,杭州天合微生物试剂有限公司。
1.2 仪器与设备
SPX-250 生化培养箱,宁波海曙赛福实验仪器厂;5804R 高速冷冻离心机,德国Eppendorf 公司;GI54DS 高压灭菌锅,至微仪器有限公司;DLCJ-2N 超级洁净工作台,北京市东联哈尔仪器制造有限公司;THZ-D 台式恒温振荡器,太仓市试验设备厂;尼康Ti-s 双端口倒置显微镜,上海衡浩仪器有限公司;UV2550 紫外分光光度计,日本岛津;DDSJ-308A 电导率仪,上海精密仪器仪表有限公司;S-4800 扫描电镜,日本日立公司。
1.3 方法
1.3.1 乳酸菌的分离 参照文献[9]将准备好的锦州发酵萝卜切成2 cm×2 cm 的块状,放入无菌生理盐水中浸泡15 min,取样品浸泡液1.0 mL 倒入生理盐水制成10 倍稀释液。在无菌条件下,吸取0.1 mL 稀释液涂布在1.0%碳酸钙的MRS 培养基表面,37 ℃培养24 h。挑取具有溶钙圈的白色单菌落在MRS 培养基上分区划线纯化,重复上述操作3 次,并进行革兰氏染色和过氧化氢试验。将纯化后菌株接种于MRS 斜面,置于-20 ℃条件下保藏备用。
1.3.2 对互隔交链孢霉具有抑制活性乳酸菌的筛选 取保藏乳酸菌菌株以2.0%接种量在MRS 肉汤中活化,37 ℃静置培养24 h,活化至3 代。体外菌丝体生长的测量按照Tatsadjieu 等[10]的方法并稍作修改,将活化好的乳酸菌菌悬液以1.0%接种量分别添加在PDA 培养基平板表面,并用涂布器涂均匀,然后接种互隔交链孢霉菌饼。以MRS 液体培养基作对照,26 ℃避光培养7 d,观察菌丝生长,测定其菌落直径。当对照组平板中菌丝长满平板表面时,用游标卡尺交叉测量菌落生长直径(mm),并按式(1)计算乳酸菌对互隔交链孢霉的抑菌率。分析比较不同乳酸菌对互隔交链孢霉的抑菌效果,筛选1 株对互隔交链孢霉生长有较强拮抗作用的菌株,进行后续试验。
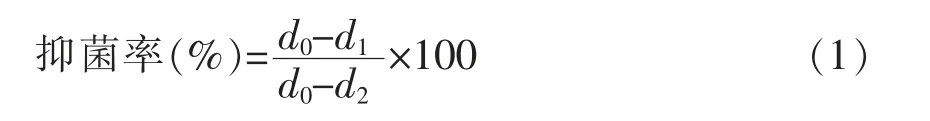
式中,d0——对照组互隔交链孢霉菌落直径(mm);d1——试验组互隔交链孢霉菌落直径(mm);d2——原菌饼直径(mm)。
1.3.3 乳酸菌菌株鉴定 生理生化反应:参照《常见细菌系统鉴定手册》和《乳酸细菌分类鉴定及实验方法》对乳酸菌菌株进行生理生化鉴定[11-12]。
16S rDNA 序列鉴定:参照文献[13],PCR 应用25 μL 扩增反应体系:扩增引物为27f:5′-AGAGTTTGATCCTGGCTCAG -3′,1492r:5′ -TACGGYTACCTTTGTTACGACTT -3′ 各 1.0 μL,DNA 模板1.0 μL,Taq PCR Master mix 12.5 μL,超纯水9.5 μL。PCR 扩增反应程序:94 ℃2 min,94 ℃1 min,60 ℃1 min,72 ℃90 s,循环30 次,4℃保温。PCR 产物进行凝胶电泳并照相,将扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果与NCBI 数据库进行BLAST 同源性比对,MEGA5.0 构建系统发育进化树。
1.3.4 乳酸菌对互隔交链孢霉菌丝体的拮抗活性研究 将不同浓度(101,102,103,104,105,106,107,108,109CFU/mL) 的乳酸菌菌悬液按1.3.2 节的方法进行试验,分析不同浓度乳酸菌对互隔交链孢霉菌丝体的拮抗作用。
1.3.5 乳酸菌对互隔交链孢霉孢子萌发的抑制作用 参照Kıvanc 等[14]方法并稍作修改,向培养7 d长满互隔交链孢霉的PDA 培养基中添加10.0 mL无菌水,刮下孢子后使用400 目无菌纱布过滤。用无菌水制成1.0×106spores/mL 的孢子悬浮液,备用。将孢子悬浮液与不同浓度乳酸菌菌悬液按照1∶1 混合均匀,取200 μL 混合液加入PDA 培养基,涂布器涂布均匀。封口膜密封,26 ℃恒温培养。接种后每隔2 h 将不同浓度乳酸菌处理的菌种制片,在倒置显微镜下观察其孢子萌发形态,并用计数器计数,每个浓度3 组数据,每组计1.0×102孢子。
1.3.6 乳酸菌对互隔交链孢霉抑菌机制研究
1.3.6.1 对互隔交链孢霉细胞膜完整性的影响参照夏晓明等[15]方法并稍作修改。将1.0×106spores/mL 的孢子悬浮液加入100 mL 的PDB 液体培养基中,摇床120 r/min 培养3 d 后,加入一定量的乳酸菌,以不加乳酸菌为阳性对照,只加乳酸菌为阴性对照。立即取出5.0 mL,用DDSJ-308A 电导率仪测定电导率,继续培养2,4,6,8 h,5 000 r/min,4 ℃离心10 min,将沉淀重悬于无菌水中测电导率,95 ℃水浴30 min 后冷却至室温测定最终电导率。相对电导率由式(2)计算:
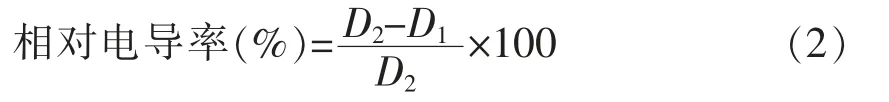
式中,D1——初始电导率(μS/cm);D2——最终电导率(μS/cm)。
1.3.6.2 对互隔交链孢霉胞外泄漏物的影响将1.0×106spores/mL 孢子悬浮液加入到100 mL PDB 中,26 ℃200 r/min 振荡培养3 d 后加入乳酸菌,以不加乳酸菌为阴性对照组,只加乳酸菌为阳性对照组。继续振荡培养,每隔2 h 取培养液,于12 000 r/min,4 ℃离心20 min,取上清液用于丙二醛含量、可溶性蛋白以及可溶性糖含量的检测。
丙二醛含量测定:参考文献[16]测量丙二醛含量,取上述所得上清液2 mL,加入2 mL 0.5%的硫代巴比妥酸(溶于15%的三氯乙酸),混匀后沸水中放置20 min,冷却后4 ℃,12 000 r/min 离心20 min。上清液分别在450,532,600 nm 波长处测定其吸光值。按公式(3)计算丙二醛含量:

可溶性蛋白含量测定:参考Bradford[17]的方法,取1 mL 上述上清液,加入5.0 mL 考马斯亮蓝G250 溶液,静置2 min 测定OD595nm值。
可溶性糖含量测定:参照Morris[18]的方法,采用蒽酮比色法对胞外可溶性糖进行定量分析。取0.2 mL 上清液加入0.6 mL 蒸馏水与0.2 mL 蒽酮试剂混合,再加入2.0 mL 浓硫酸,沸水中放置1 min,冷却后测定OD630nm值。
1.3.6.3 乳酸菌对互隔交链孢霉孢子超微结构的影响 扫描电镜样品的制作:参考文献[19]并稍作修改,将1.0 mL 孢子悬浮液(1.0×106spores/mL)与1.0 mL 乳酸菌菌悬液(1.0×109CFU/mL)混合,以不加乳酸菌菌悬液为对照组,在26 ℃200 r/min 摇床培养24 h。4 ℃ 12 000 r/min 离心20 min,去上清。将沉淀用PBS(pH 6.8)洗涤3 次后,在4 ℃条件用体积分数为2.5%的戊二醛固定12 h 后,PBS 溶液洗3 次,每次10 min;再用体积分数为1%的锇酸溶液4 ℃下固定2 h 左右,用PBS 溶液洗3 次;将样品用体积分数为30%,50%,70%,95%,100%的乙醇各脱水15 min。胶头滴管吸取1滴于洁净盖玻片上,空气干燥,真空喷金镜检。
1.3.7 乳酸菌对接种互隔交链孢霉的苹果果实病变的影响 参照葛永红等[20]方法并稍作修改。选择大小、色泽和成熟度相似且无损伤的苹果果实,用70%酒精对苹果表面进行消毒,然后用无菌注射器在苹果表面制备3 个小孔 (每个小孔深2 mm×宽2 mm),无菌风风干后,将0,101,103,105,107,109CFU/mL 的乳酸菌菌悬液20 μL 注射到每个小孔中。无菌风再次风干,在每个小孔中接种
20 μL 互隔交链孢霉孢子悬浮液 (1.0×106spores/mL)。处理后的苹果用自封袋封起,并在自封袋留下呼吸孔,置于28 ℃培养箱培养6 d,相对湿度为70%~80%。记录接种后2,4,6 d 的苹果病变直径。
1.4 数据处理与统计分析
试验重复3 次,数据采用“平均值±标准差”表示。SPSS 19.0 进行数据分析,采用Origin 8.0 绘图。
2 结果与分析
2.1 乳酸菌的分离纯化
通过对锦州发酵萝卜进行切块、浸泡、培养、分离纯化等操作,共分离得到有溶钙圈、革兰氏染色阳性、过氧化氢酶阴性的40 株乳酸菌菌株,图1 是菌株LNL2-4-2 的菌落形态和革兰氏染色结果,由图1a 可知,菌落呈乳酸菌典型生长特征:乳白色,表面光滑整齐,中央凸起,由图1b 可知菌株LNL2-4-2 为革兰氏阳性菌,直杆状排列,无鞭毛,无芽孢。

图1 菌株LNL2-4-2 的菌落形态图(a)和革兰氏染色图(b,1 000×)Fig.1 Colony morphology (a) and Gram stain(b,1 000×) of strain LNL2-4-2
2.2 筛选对互隔交链孢霉具有拮抗活性的乳酸菌
表1是从40 株乳酸菌中筛选出对互隔交链孢霉有抑制作用的菌株及其抑菌率结果。从表1可以看出:菌株LNL2-4-2 的抑菌率达80.86%,效果最好;LNL1-5、LNL2-4-1 和LNL1-4 效果次之,分别为75.45%,72.16%,70.58%;LNL2-5 效果较差,抑菌率为60.29%。综上所述,选择菌株LNL2-4-2 进行后续试验。

表1 乳酸菌对互隔交链孢霉的抑制作用Table 1 Inhibition rate of lactic acid bacteria against Alternaria alternata
2.3 乳酸菌菌株鉴定
2.3.1 生理生化鉴定 菌株LNL2-4-2 生理生化鉴定结果如表2所示,依据《常见细菌系统鉴定手册》和《乳酸细菌分类鉴定及实验方法》可初步判断菌株LNL2-4-2 为乳杆菌属。

表2 菌株LNL2-4-2 生理生化鉴定结果Table 2 Physiological and biochemical test results of strain LNL2-4-2
2.3.2 16 S rDNA 鉴定 菌株LNL2-4-2 16S rDNA 基因扩增电泳图如图2所示。将PCR 产物进行凝胶电泳检测,结果发现在1 500 bp 左右出现特异性亮带,表明目标片段被成功扩增。菌株LNL2-4-2 16S rDNA 系统发育树见图3,由图可知,菌株LNL2-4-2 和植物乳杆菌(Lactobacillus plantarum) MF369877.1 的16S rDNA 最为相似,支持率为99%。可确证菌株LNL2-4-2 为植物乳杆菌。

图2 菌株LNL2-4-2 的16S rDNA 基因扩增电泳图Fig.2 PCR amplification of 16S rDNA gene of strain LNL2-4-2

图3 菌株LNL2-4-2 的16S rDNA 系统发育树Fig.3 The phylogenetic tree for sequences of strain LNL2-4-2
2.4 乳酸菌对互隔交链孢霉菌丝体的抑制作用
图4是不同浓度植物乳杆菌LNL2-4-2 对互隔交链孢霉菌丝体生长的抑制结果,从图中可以看出,不同浓度的乳酸菌对互隔交链孢霉菌丝的生长均有抑制作用,且浓度越高,抑制作用越好。当植物乳杆菌LNL2-4-2 浓度为109CFU/mL 时,对互隔交链孢霉的菌丝体抑制作用最强(图4A),抑制率为80.86%±0.32%(图4B),可以显著抑制菌丝体的生长(P<0.05)。

图4 不同浓度植物乳杆菌LNL2-4-2 对互隔交链孢霉菌丝体抑制效果Fig.4 Inhibitory effect of different concentrations of Lactobacillus plantarum LNL2-4-2 on the mycelium of A.alternata
2.5 乳酸菌对互隔交链孢霉孢子的抑制作用
图5为不同浓度植物乳杆菌LNL2-4-2 对孢子萌发的抑制作用。由图5可知随着乳酸菌浓度升高,对孢子的抑制作用增强。培养10 h 后,对照组萌发率为91.67%,菌株LNL2-4-2 浓度为109CFU/mL 的处理组抑制率为48.00%,显著抑制孢子萌发(P<0.05)。本文的研究结果与现有文献报道一致,杨晓蕾等[21]将枯草芽孢杆菌JR-C 处理梨黑斑病菌孢子悬浮液时发现,拮抗菌JR-C 代谢产物可显著抑制孢子萌发,且随着浓度的增加抑制效果越好。综上所述,浓度为109CFU/mL 的植物乳杆菌LNL2-4-2 对互隔交链孢霉菌丝体生长和孢子萌发的抑制效果显著,选用浓度109CFU/mL 的菌株LNL2-4-2 探究抑菌机理。

图5 不同浓度植物乳杆菌LNL2-4-2 对互隔交链孢霉孢子萌发的影响Fig.5 Effect of different concentrations of Lactobacillus plantarum LNL2-4-2 on the germination of A.alternata spores
2.6 乳酸菌对互隔交链孢霉抑菌机理研究
2.6.1 对互隔交链孢霉细胞膜完整性的影响细胞膜的完整性是维持胞内环境稳定代谢的重要基础,当其被破坏时,会导致细胞内电解质外流,因此,通常选用检测电导率来检测细胞膜完整性[22]。图6表示菌株植物乳杆菌LNL2-4-2 处理对互隔交链孢霉电导率的影响。由图可知,随着作用时间的延长,未处理的互隔交链孢霉组、乳酸菌组以及乳酸菌处理的互隔交链孢霉相对电导率逐渐下降,然而乳酸菌处理互隔交链孢霉组的下降速率显著高于未处理的互隔交链孢霉组和乳酸菌组(P<0.05),表明菌株LNL2-4-2 处理互隔交链孢霉后,其胞内电解质泄漏值显著高于未处理的互隔交链孢霉和乳酸菌组。有研究发现,1.0 mmol/L 硝普钠处理粉红单端孢(Trichothecium roseum)1.5 h 后,胞内电导率下降速率显著高于对照组[23],该结果与本研究结果相似。

图6 植物乳杆菌LNL2-4-2 对互隔交链孢霉电导率的影响Fig.6 Effect of Lactobacillus plantarum LNL2-4-2 on the integrity of A.alternata cell membrane
2.6.2 对互隔交链孢霉胞外泄漏物的影响 丙二醛(MDA)是衡量脂质过氧化程度的主要标志物,MDA 含量显著增加,表明病原体脂质过氧化程度严重,进而导致其细胞膜的重度氧化损伤[24],这加剧了对膜完整性的损害,并导致细胞内蛋白质和糖类析出,从而使胞外蛋白含量和可溶性糖含量增加。植物乳杆菌LNL2-4-2 处理对互隔交链孢霉的丙二醛、胞外蛋白、可溶性糖含量的影响如图7所示。
由图7a 可知,未处理的互隔交链孢霉组丙二醛含量基本保持不变,乳酸菌组以及乳酸菌处理的互隔交链孢霉组在0~4 h 随时间的延长丙二醛含量增加,4~8 h 随时间的延长丙二醛含量呈下降趋势,然而乳酸菌处理的互隔交链孢霉组丙二醛含量始终显著高于未处理的互隔交链孢霉组(P<0.05),表明植物乳杆菌LNL2-4-2 处理刺激了互隔交链孢霉细胞膜脂质过氧化。这一结果与Li 等[25]用对香豆酸乙酯(EpCA)作用于互隔交链孢霉的研究结果相一致。与对照组相比,分别用100,800 μg/mL EpCA 处理互隔交链孢霉,MDA 含量分别增加了1.06 倍和1.59 倍。

图7 植物乳杆菌LNL2-4-2 对A.alternata 丙二醛(a)、胞外蛋白(b)、可溶性糖(c)含量的影响Fig.7 Effects of Lactobacillus plantarum LNL2-4-2 on the contents of A.alternata malondialdehyde (a),extracellular protein (b) and soluble sugar (c)
图7b 中,未处理的互隔交链孢霉组、乳酸菌组以及乳酸菌处理的互隔交链孢霉组的胞外蛋白含量均随着培养时间的延长而不断上升,而植物乳杆菌LNL2-4-2 处理后的蛋白含量显著高于另外2 组(P<0.05)。Rocha 等[26]使用2.5 mmol/L 水杨酸(SA)处理扩展青霉30 min 后导致可溶性蛋白质泄漏达3.2 μg/g,而对照组为1.8 μg/g,该结果与本研究结果相似。
糖类是细胞在生长过程中必不可少的营养物质,图7c 中,未处理的互隔交链孢霉组与乳酸菌组可溶性糖含量均随时间的延长而逐渐上升,乳酸菌处理的互隔交链孢霉组在0~6 h 的可溶性糖含量逐渐升高,而6~8 h 开始呈下降趋势,处理组可溶性糖含量均显著高于其它2 组的含量(P<0.05)。Li 等[27]用800 mg/L 对羟基苯甲酸甲酯(MpCA)处理互隔交链孢霉,可溶性糖含量在培养5 h 后比对照组高8.9 倍。该结果与本研究结果类似。由此可知,植物乳杆菌LNL2-4-2 处理互隔交链孢霉后对其细胞膜完整性有一定的破坏作用。
2.7 乳酸菌对互隔交链孢霉孢子超微结构的影响
图8为植物乳杆菌LNL2-4-2 处理互隔交链孢霉孢子后扫描电镜观察结果。从图中可以看出,对照组孢子形态为倒梨形,结构完整,表面较光滑。经植物乳杆菌LNL2-4-2 处理后,有大量乳酸菌附着在孢子表面,使其表面出现褶皱,边缘模糊,顶端破裂,有内容物泄漏,结构完整性被破坏。表明菌株LNL2-4-2 对互隔交链孢霉孢子细胞膜有一定的损伤作用,从而破坏其细胞膜的完整性,使其胞内物质泄漏,该结果与2.6 节的测定结果相一致。

图8 植物乳杆菌LNL2-4-2 对A.alternata孢子超微结构的影响Fig.8 Effect of Lactobacillus plantarum LNL2-4-2 on the ultrastructure of A.alternata spores
2.8 乳酸菌对接种互隔交链孢霉的苹果果实病变的影响
如图9所示,病变直径随贮存时间延长而增加,不同浓度的植物乳杆菌LNL2-4-2 会抑制接种互隔交链孢霉的苹果果实病变直径的增长。在第2 天,与对照相比,除了109CFU/mL 处理组显著促进病变直径的增加,浓度为101CFU/mL 和107CFU/mL 处理组与对照无明显差异,103CFU/mL 和105CFU/mL 处理组对互隔交链孢霉抑制作用显著。在第4 天和第6 天,各浓度处理组均可显著抑制苹果果实的损伤直径,其中103CFU/mL 的植物乳杆菌LNL2-4-2 抑制效果最好,105,107,109CFU/mL 处理组抑制作用无显著性差异(P>0.05)。在第2,4,6 天中103CFU/mL 的植物乳杆菌LNL2-4-2 对苹果损伤直径的抑制率分别为26.97%,27.48%,47.24%。李灿婴等[28]研究了不同浓度的植物乳杆菌XCT1-10 对接种灰葡萄孢菌的苹果损伤直径的影响,结果表明,较低浓度106CFU/mL 的植物乳杆菌XCT1-10 可显著降低苹果果实损伤直径,高浓度的植物乳杆菌XCT1-10 会增加苹果果实损伤直径,可推测高浓度的植物乳杆菌LNL2-4-2 会增加互隔交链孢霉的侵染程度,原因可能是植物乳杆菌LNL2-4-2 可能会分泌某些促进互隔交链孢霉生长的代谢物质。上述研究与本研究结果类似,说明植物乳杆菌LNL2-4-2 可作为水果保鲜的生物防治剂。

图9 不同浓度植物乳杆菌LNL2-4-2 对接种互隔交链孢霉的苹果损伤直径的影响Fig.9 Effects of different concentrations of Lactobacillus plantarum LNL2-4-2 on the damage diameter of apples inoculated with Alternaria alternata
3 结论
本文从发酵蔬菜分离的乳酸菌中筛选出对互隔交链孢霉有显著抑制作用的植物乳杆菌LNL2-4-2,抑制率为80.86%。此外,菌株LNL2-4-2 可抑制互隔交链孢霉离体菌丝生长和孢子萌发,且随着浓度升高,抑制作用增强。浓度为109CFU/mL的乳酸菌处理互隔交链孢霉孢子后,使其细胞膜完整性降低,孢外丙二醛、可溶性蛋白质、可溶性糖含量增加。超微结构图像显示菌株LAL2-4-2破坏了霉菌孢子的细胞膜,导致孢子表面皱缩,顶端破裂使其内容物泄漏。植物乳杆菌LNL2-4-2对互隔交链孢霉的作用位点是其孢子的细胞膜,通过膜损伤来发挥拮抗作用。植物乳杆菌LNL2-4-2 在体外对感染互隔交链孢霉的苹果具有保鲜防腐作用,因此植物乳杆菌LNL2-4-2 可作为抑制互隔交链孢霉的出发菌株,为研发控制果蔬采后腐败变质的生物制剂提供理论基础。
