呼吸道合胞病毒滴度间接免疫荧光检测方法的建立及验证
2022-08-17宋月爽陈晓旭潘东卢井才张立娜刘禹壮原秀娟段盛博袁若森赵慧
宋月爽,陈晓旭,潘东,卢井才,张立娜,刘禹壮,原秀娟,段盛博,袁若森,赵慧
1.长春百克生物科技股份公司,吉林 长春 130012;2.吉林大学生命科学院,吉林 长春 130012;3.中国食品药品检定研究院呼吸道病毒疫苗室卫生部生物技术产品检定方法及其标准化重点实验室,北京 102629
呼吸道合胞病毒(respiratory syncytial virus,RSV)是全球范围内引起5岁以下儿童急性下呼吸道感染(acute lower respiratory tract infection,ALRTI)最重要的病毒性病原[1]。目前,尚无用于预防RSV 感染的市售疫苗及有效的抗病毒药物用于RSV 治疗[2],唯一可用于RSV 预防的人源化特异性抗体帕利珠单抗(Palivizumab)尚未引进国内临床应用[3-4]。RSV 疫苗和RSV 单抗一直是研究的热点,其中长半衰期的预防性RSV 单抗正处于临床试验阶段[5],2021年在Ⅲ期临床试验中已达到试验的主要终点。
目前,已有约20 种RSV 候选疫苗处于临床阶段[6],RSV 滴度是疫苗相关研究的基础之一,RSV滴度定量检测方法有空斑法、半数定量(TCID50)法、免疫荧光法及RT-PCR 法等。其中空斑法和TCID50法需经细胞培养RSV 后定量检测病毒滴度,耗时均较长[7],如空斑法是将病毒培养 5 ~ 9 d,产生裸视可见足够大的蚀斑后,经固定染色进行病毒滴度判定[8-10]。有研究对空斑法进行改良,将板内细胞和病毒培养时间缩短为2 d,并参照间接ELISA 法,加入单抗后再结合HRP 标记的二抗,显色后进行肉眼观察,检测过程仅需 3 d[11]。RT-PCR 法灵敏度高,特异性强[12],检测周期短,但用于RSV 滴度检测,需预先提取样品RNA,过程较繁琐,且对操作者的技术要求较高。间接免疫荧光法是采用特异性抗体与样品中相应抗原反应,用荧光标记的二抗与特异性抗体结合,荧光显微镜下观察特异性荧光,以检测未知抗原,该方法灵敏度和特异性较高,与临床症状相关性好[3]。本实验旨在建立用于RSV 滴度检测的间接免疫荧光法,并对方法进行验证,以期用于RSV临床快速检测。
1 材料与方法
1.1 病毒及细胞 RSV A2 株(VR-1540)、RSV Long株(VR-26)、RSV 18537 株(VR-1580)、狂犬病病毒、风疹病毒、流感病毒和HEp-2 细胞均由长春百克生物科技股份公司保存并提供。
1.2 主要试剂 DMEM-Ham′s F12 培养基购自中科迈晨(北京)科技有限公司;胎牛血清购自美国Gibco公司;Penicillin-Streptomycin Solution(100 ×)购自武汉普赛诺生命科技有限公司;Synagis(Palivizumab)购自美国Medimmune 公司;荧光标记羊抗人IgG 购自美国Southern Biotech 公司。
1.3 方法的建立 将待检RSV 进行5 倍系列稀释(5-1~ 5-11),加入 96 孔板,50 μL / 孔,每个稀释度设2个复孔;将HEp-2 细胞用含胎牛血清的DMEMHam′s F12 培养基,于 37 ℃培养至单层,用 0.25%胰蛋白酶-EDTA 消化后,调整细胞密度,采用病毒和细胞同时接种的方法将细胞加入 96 孔板[12],50 μL /孔;同时设阴性对照(仅加入培养液和细胞悬液)和阳性对照(原倍病毒液)。于37 ℃,5% CO2培养箱培养,PBS 洗涤1 次,加入-20 ℃预冷的 80%丙酮,50 μL /孔,4 ℃固定30 min;PBS 洗涤1 次,加入Synagis(Palivizumab),50 μL / 孔,于 37 ℃孵育 1 h;PBS 洗涤 3 次,加入荧光标记羊抗人IgG,50 μL/孔,于37 ℃孵育1 h;PBS 洗涤 3 次,加入 80%甘油,50 μL / 孔,荧光显微镜下进行荧光灶(focus-forming unit,FFU)计数,并按下式计算病毒滴度[13]。
病毒滴度(FFU / mL)=(最高稀释倍数孔FFU 平均值 ×样品稀释倍数 + 相邻孔稀释倍数较低的FFU 平均值)/ 2 ×稀释倍数较低孔病毒稀释倍数× 20
1.4 方法的优化
1.4.1 细胞接种密度及血清浓度的确定 将培养HEp-2 细胞的培养液中的胎牛血清终浓度设为2.5%、5%、10%、20%,细胞接种密度分别为 3 × 104、4 × 104、5 × 104、6 × 104、7 × 104、8 × 104个 / 孔[11],于37 ℃,5%CO2培养箱培养24 h,显微镜下观察细胞形态及密度。
1.4.2 培养时间的确定 以1.4.1 项确定的胎牛血清浓度及细胞接种密度培养HEp-2 细胞,病毒接种后分别培养 20、24、26、30、38、48 h,一抗稀释倍数为 1 ∶1 000,二抗稀释倍数为 1 ∶400,其他检测步骤同1.3 项。对检测数据相近的时间点再进行5 次检测。选择荧光灶轮廓清晰且病毒滴度最高的时间为最佳培养时间。
1.4.3 抗体稀释度的确定 以1.4.1 项确定的胎牛血清浓度及细胞接种密度培养HEp-2 细胞,病毒接种后培养24 h;加入一抗,用PBS 分别稀释为1 ∶(1 000 /3)、1 ∶1 000、1 ∶3 000、1 ∶9 000;孵育后加入二抗,用 PBS 分别稀释为 1 ∶(400 /3)、1 ∶400、1 ∶1 200;其他步骤同1.3 项。荧光显微镜下观察荧光灶强度高,背景强度弱,轮廓清晰,病毒滴度最高的稀释度为一抗和二抗的最佳稀释度。
1.5 方法的验证
1.5.1 特异性 取 RSV A2 株(VR-1540)、狂犬病病毒、流感病毒、风疹病毒,采用建立的方法进行检测,荧光显微镜下观察特异性荧光的强度,验证方法特异性。
1.5.2 线性范围 以RSV A2 株(VR-1540)作为已知滴度的标准品,其滴度平均值作为理论滴度[8.48×107FFU / mL,滴度对数值(lgFFU / mL)为 7.93],用DMEM-Ham′s F12 培养基稀释为 1.70 × 107,3.39 ×106,6.79 × 105,1.36 × 105,2.71 × 104,5.43 ×103FFU/mL 6个稀释度,采用建立的方法进行检测,每个浓度重复3 次,计算均值及RSD,以各理论滴度为横坐标,检测滴度均值为纵坐标建立线性回归曲线,获得回归方程。
1.5.3 准确性 以RSV A2 株(VR-1540)作为已知滴度的标准品,其滴度平均值作为理论滴度(8.48 ×107FFU / mL,lgFFU / mL 为 7.93),用 DMEM-Ham′s F12 培养基稀释为 8.48 × 107、3.39 × 106、2.71 ×104FFU /mL;将 RSV Long 株(VR-26)用 DMEM-Ham′s F12 培养基分别稀释 52、54、57倍作为高、中、低滴度未加标样品;将RSV A2 株(VR-1540)按浓度由高至低依次等体积加入高、中、低滴度的RSV Long 株(VR-26)病毒液中,即为加标样品。采用建立的方法检测加标和未加标样品的病毒滴度,并按下式计算回收率。
回收率(%)=(加标样品检测值- 未加标样品检测值)/加入标准品理论值× 100%
1.5.4 重复性 同一操作人员采用建立的方法于同一时间点检测 RSV A2 株(VR-1540)、RSV Long 株(VR-26)、RSV 18537 株(VR-1580)的病毒滴度,每个样品重复检测3 次,计算RSD。
1.6 统计学分析 应用Graphpad Prism 8.0 软件进行统计学分析,时间优化中数据相近的时间点再进行5 次检测的结果取均值,并进行配对t 检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 方法的优化
2.1.1 最佳细胞接种密度及血清浓度 细胞密度为 6 × 104个 / 孔及该浓度以上时,培养 24 h 均可达致密单层,4个胎牛血清终浓度下细胞生长形态一致。因此,选择最低加入量2.5%为最佳胎牛血清浓度,6 × 104个 / 孔为最佳细胞接种密度。见图1(仅显示细胞密度为6 × 104个 / 孔于4个胎牛血清浓度培养基条件下的结果)。
图1 HEp-2 细胞在含不同浓度胎牛血清培养液中的细胞形态(× 40)Fig.1 Cell morphology of HEp-2 in media containing various concentrations of FBS(× 40)
2.1.2 最佳培养时间 培养30、38、48 h 时细胞发生不同程度融合,无法清晰计数;培养20、24、26 h 时细胞可清晰计数,病毒滴度分别为2.67×107、6.64 ×107、8.54 × 107FFU / mL,见图 2。培养 20 h 的滴度低于 24 和26 h,培养 24 和26 h 的结果较接近,分别再进行5 次检测,检测结果差异无统计学意义(t = 1.096,P = 0.334 6)。因此,确定最佳培养时间为 24 ~ 26 h。

图2 病毒培养不同时间产生的特异性荧光(× 100)Fig.2 Specific fluorescent foci formed by virus cultured for various hours(× 100)
2.1.3 最佳抗体稀释度 一抗稀释度为1 ∶1 000和 1 ∶3 000,二抗稀释度为 1 ∶(400 / 3)和 1 ∶400时,背景暗、荧光强度高,易于观察计数。一抗稀释度为1 ∶1 000,二抗稀释度为1 ∶400 时病毒滴度最高,见表1。因此,确定该稀释度为最佳抗体稀释度。

表1 不同抗体稀释度时的病毒滴度(lgFFU / mL)Tab.1 Virus titers(lgFFU /mL)at various dilutions of antibodies
2.2 方法的验证
2.2.1 特异性 RSV 可见特异性荧光,狂犬病病毒、流感病毒、风疹病毒均未见荧光,见图3。表明该方法具有良好的特异性。
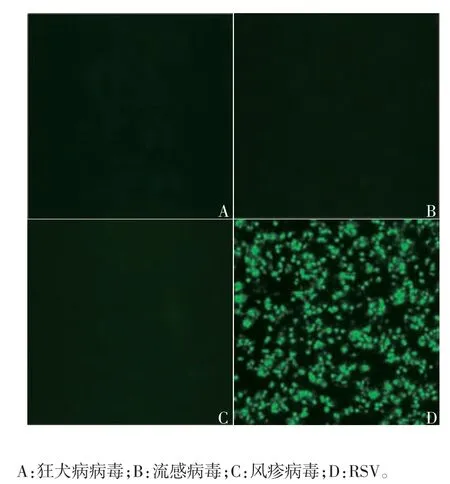
图3 荧光显微镜下观察不同病毒的特异性荧光(× 40)Fig.3 Fluorescent microscopy of specific fluorescent foci formed by various viruses(× 40)
2.2.2 线性范围 RSV 滴度检测的标准曲线见图4。RSV 滴度理论值在1.70×107~5.43×103FFU/mL范围内,与检测值呈良好的线性关系,回归方程为y = 1.031 3 x - 0.250 8,R2= 0.989 7。每个梯度病毒滴度3 次检测结果RSD 均≤15%。

图4 RSV 滴度检测的标准曲线Fig.4 Standard curve for determination of RSV titer
2.2.3 准确性 3个浓度加标样品的回收率均在70% ~130%范围内,见表2。表明该方法具有良好的准确性。

表2 准确性验证结果Tab.2 Verification for accuracy
2.2.4 重复性 同一操作人员于同一时间点对RSV A2 株(VR-1540)、RSV Long 株(VR-26)、RSV 18537 株(VR-1580)重复检测3 次结果RSD 均≤15%,见表3。表明该方法具有良好的重复性。

表3 重复性验证结果Tab.3 Verification for reproducibility
3 讨 论
免疫荧光法主要分为直接免疫荧光和间接免疫荧光,两种方法均可用于RSV 的临床快速检测[14-16],目前,《中国药典》三部(2020 版)[12]通则 3512 中已将免疫荧光法列为抗狂犬病病毒抗体效价的检测方法。有文献报道表明,采用间接免疫荧光法结合空斑法,可计算获得RSV 滴度及抗体中和活性,但由于该方法需提前1 d 在细胞板上培养,实验时长共需3 d,且仪器成本较高[14]。本实验利用 Synagis(Palivizumab)可结合RSV 融合糖蛋白F(RSV F)的特点,用其作为一抗结合经细胞培养24 ~26 h 的RSV,再结合荧光标记的二抗后,可在倒置荧光显微镜下观察结果,整个实验仅需2 d,大幅缩短了实验室检测RSV 滴度的时间,且使用的主要仪器为倒置荧光显微镜,价格较低廉。
本研究对RSV 滴度检测的间接免疫荧光法的主要影响因素(细胞接种密度及胎牛血清浓度、培养时间、抗体稀释度)进行了优化及初步验证(特异性、线性范围、准确性、精密性)。结果表明,最佳细胞密度为 6 × 104个 / 孔,血清浓度为 2.5%,培养时间为24 ~ 26 h,一抗稀释度为 1 ∶1 000,二抗稀释度为1 ∶400。特异性验证结果表明,RSV 可见特异性荧光,狂犬病病毒、流感病毒、风疹病毒均未见荧光灶;RSV 理论滴度在 1.70 × 107~ 5.43 × 103FFU / mL范围内,与检测值呈良好的线性关系,回归方程为y = 1.031 3 x - 0.250 8,R2= 0.989 7;3个浓度加标样品的回收率均在70%~130%范围内;重复性RSD均≤15%。表明该方法具有良好的特异性、线性、准确性及重复性。
综上所述,本研究建立并验证了用于RSV 滴度检测的间接免疫荧光法,与空斑法及TCID50法比较,该方法检测周期短、工作量少、结果更准确,可用于RSV 滴度的快速检测。同时,该方法的建立也为RSV 中和抗体的检测提供了参考。
