硫酸钠和碳酸氢铵复分解反应制备纯碱及母液处理
2022-08-16郭利红
冯 瑞, 郭利红,唐 印
(四川金象赛瑞化工股份有限公司,四川 眉山 620031)
我国山西、新疆、内蒙古和四川等地都有丰富的芒硝矿,同时随着现代化工产业的迅速发展,各地都副产大量的芒硝,大多数芒硝只是通过简单的蒸发生产无水硫酸钠即元明粉出售,而元明粉主要用于洗涤剂和硫化碱等工业,产能过剩严重,价格低廉,经济效益很低,所以高价值利用芒硝才能使其具有广阔的发展前景。
在现阶段碳减排、碳中和背景下,将芒硝和二氧化碳结合综合利用,以芒硝和二氧化碳为原料制备纯碱就具有更加重要的意义。芒硝制备纯碱有干法和湿法两种工艺,干法芒硝制碱是用固体或气体燃料在高温和还原气氛下,将芒硝还原为Na2S,然后在固相或液相状态下用CO2气体碳化为NaHCO3,该方法物料转运困难,劳动轻度大,自动化程度低,难以大规模生产。湿法芒硝制碱即芒硝联碱法,与NaCl为原料的联合制碱法相似,先按下列反应制取重碱:
2NH3+2CO2+2H2O+Na2SO4→2NaHCO3↓+(NH4)2SO4
重碱经过煅烧得到纯碱:
当重碳酸化度为100%时,上述过程的相图表达方法与氨碱法的相图类似,为Na+,NH4+//HCO3-,SO42--H2O四元相图。分离反应液得到固体NaHCO3,经煅烧后为纯碱,母液中含有Na2SO4、(NH4)2SO4和NH4HCO3,用相图原理进行分离,得到固体(NH4)2SO4用于农用化肥。
为了探讨合理的工艺流程和操作条件,应研究Na+,NH4+//HCO3-,SO42--H2O体系及有关的相图。
1 实验原理
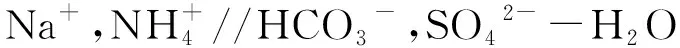
从图中可看出,相图中有5个结晶区和4个三盐共饱和点。其中5个结晶区分别为:
A-H-P2-I区域为Na2SO4(简写为S0)结晶区;
H-F-P1-P3-P2为Na2SO4·(NH4)2SO4·4H2O(名为Dawson盐,简写为Dw盐)结晶区;
F-D-E-P1区域为(NH4)2SO4结晶区;
E-C-G-P3-P1区域为NH4HCO3结晶区;
B-I-P2-P3-G区域为NaHCO3结晶区;
与以氯化钠为原料生产纯碱的氨碱法一样,Na2SO4转变为NaHCO3沉淀的百分率为钠利用率,以UNa表示;NH4HCO3转化为(NH4)2SO4结晶的百分率为氨利用率,以UNH3表示。
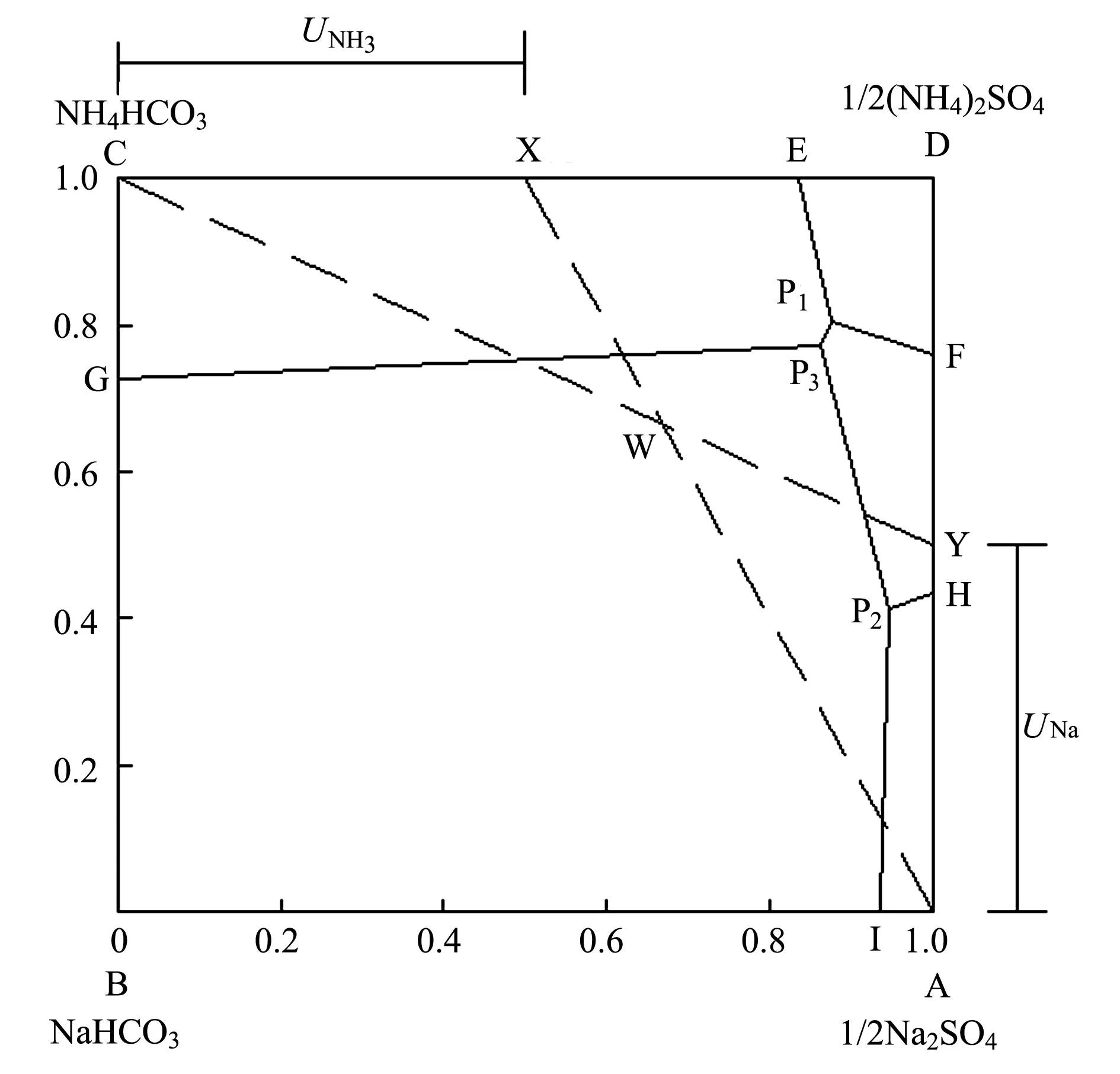
图1 UNa和UNH3相图表示法
连接A、W并延长交NH4HCO3-(NH4)2SO4边DF于X,FX之长即代表氨利用率UNH3。从图1中可以看出,当母液组成落在P2点时,UNH3最大。
现将0.1 MPa、不同温度下P3点组成及UNa、UNH3值列于表1中。

表体系P3点组成及UNa、UNH3值
由表1可看出,单次反应中钠的利用率虽然不是很高,但因工艺过程是循环进行的,未转化为碳酸氢钠的硫酸钠并未排弃,故总的钠利用率可以达到100%。 因此,在芒硝制碱中不必追求整个过程中的UNa、UNH3值最大,而应使单位重碱母液中碳酸氢钠的最大产量,即碳酸化母液中(NH4)2SO4浓度最大,欲达到这一要求,溶液组成必须落在P3点。
如果反应结束后的母液组成落在P3点,则可倒推出反应前Na2SO4、NH4HCO3和水的比例,会发现反应前的溶液是过饱和的,否则,反应后母液是不可能落在P3点的。为了使反应结束时母液组成落在P3点,本研究放弃使用传统碳化塔设备和碳化工艺,改用固体Na2SO4和NH4HCO3做原料、采用DTB结晶反应器进行复分解反应,以防止过饱和的反应物料堵塞碳化塔。
芒硝制碱母液中含有(NH4)2SO4、Na2SO4和NH4HCO3,其中主要为(NH4)2SO4。从中分离出Na2SO4返回反应工段循环利用,分离出(NH4)2SO4作为副产品出售,这是芒硝制碱在经济上可行的关键。从母液中分离Na2SO4和(NH4)2SO4有冷法和热法两种工艺流程。
所谓冷法分离工艺,就是在-5~-10 ℃的低温下使母液中Na2SO4和NH4HCO3大部分成结晶析出而返回制碱,冷析母液蒸发析出(NH4)2SO4,蒸发母液再返回与制碱母液混合,如此循环往复处理。
热法分离重碱母液中的(NH4)2SO4和Na2SO4,是利用温度升高时(NH4)2SO4溶解度变大而Na2SO4溶解度基本不变的性质,将母液蒸发使Na2SO4结晶析出,然后再将分离出Na2SO4结晶的母液温度降至常温,Na2SO4-(NH4)2SO4-H2O体系可析出复盐Na2SO4·(NH4)2SO4·4H2O晶体,分离出复盐的母液再进行蒸发使(NH4)2SO4结晶析出,分离出(NH4)2SO4结晶的母液和复盐返回前工段继续处理,如此则可依次分离出Na2SO4和(NH4)2SO4。
与冷法分离制碱母液相比,热法工艺处理过程物料温差变化小,能耗小,工艺简单,所以本研究采用热法工艺处理制碱母液。
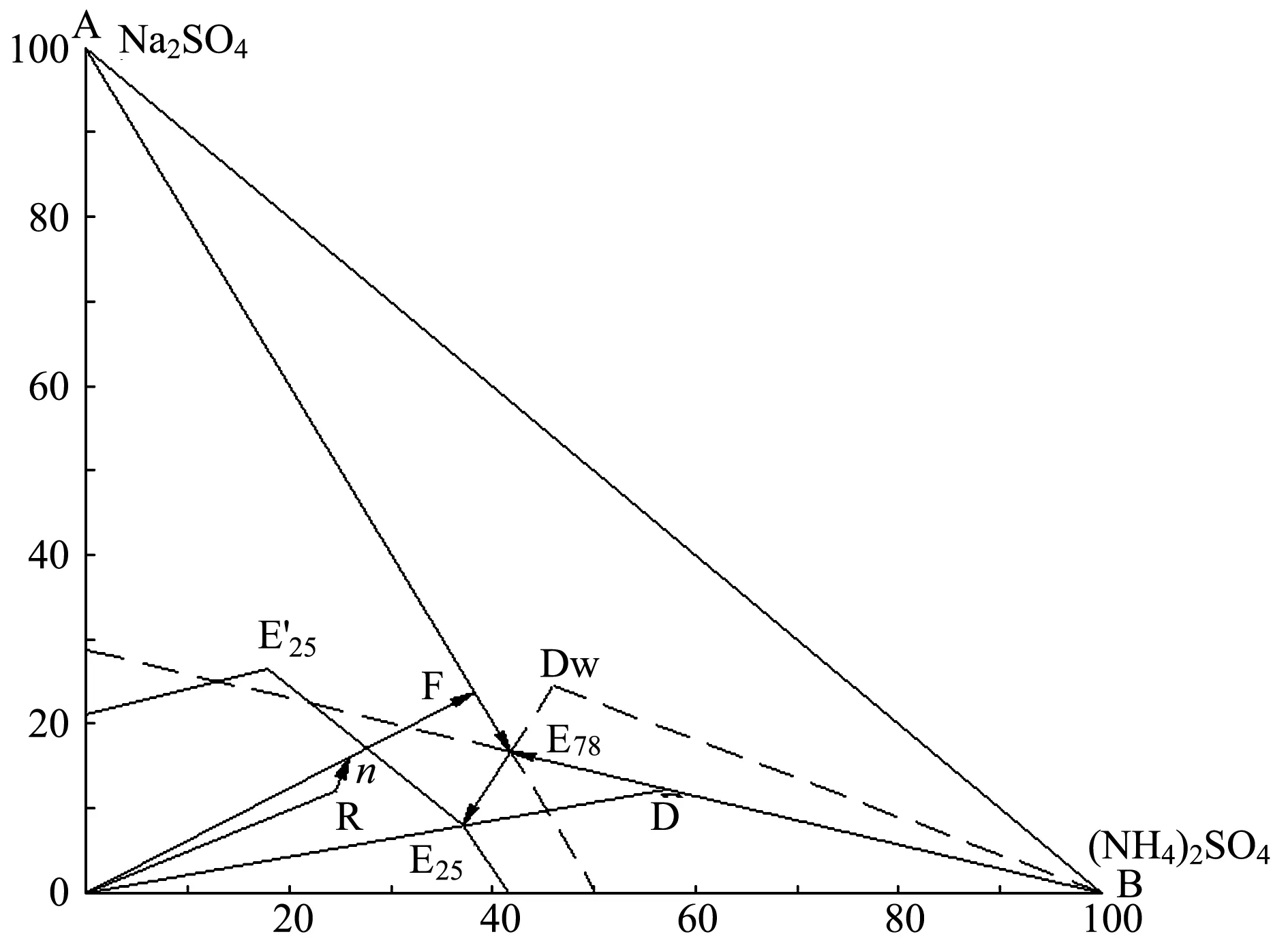
图2 热法分离制碱母液中Na2SO4和(NH4)2SO4过程
图2为25 ℃和78 ℃下的Na2SO4-(NH4)2SO4-H2O体系相图。因78 ℃以上的母液降温至常温,会有复盐Dw(Na2SO4·(NH4)2SO4·4H2O)和Na2SO4混合结晶析出,故本研究中制碱母液在78 ℃蒸发。制碱母液经过蒸氨处理后的组成点为图2中的R,与复盐混合后的体系点为n,将其在78 ℃下等温蒸发至F点,Na2SO4结晶析出,在78 ℃保温过滤,得到的Na2SO4固体返回制碱,滤液E78为78 ℃下Na2SO4和(NH4)2SO4的饱和溶液。将滤液E78冷却至25 ℃,将析出复盐Dw结晶,滤液E25为25 ℃下Na2SO4和(NH4)2SO4的饱和溶液,再将滤液E25升温至78 ℃等温蒸发至D点,保温过滤,得到(NH4)2SO4固体和滤液E78,与分离Na2SO4固体的母液E78混合后再降至25 ℃,又析出复盐Dw结晶。复盐Dw与蒸氨后的重碱母液R混合,混合后的体系点为n,继续下一循环,如此逐步分离出Na2SO4和(NH4)2SO4。
2 试验部分
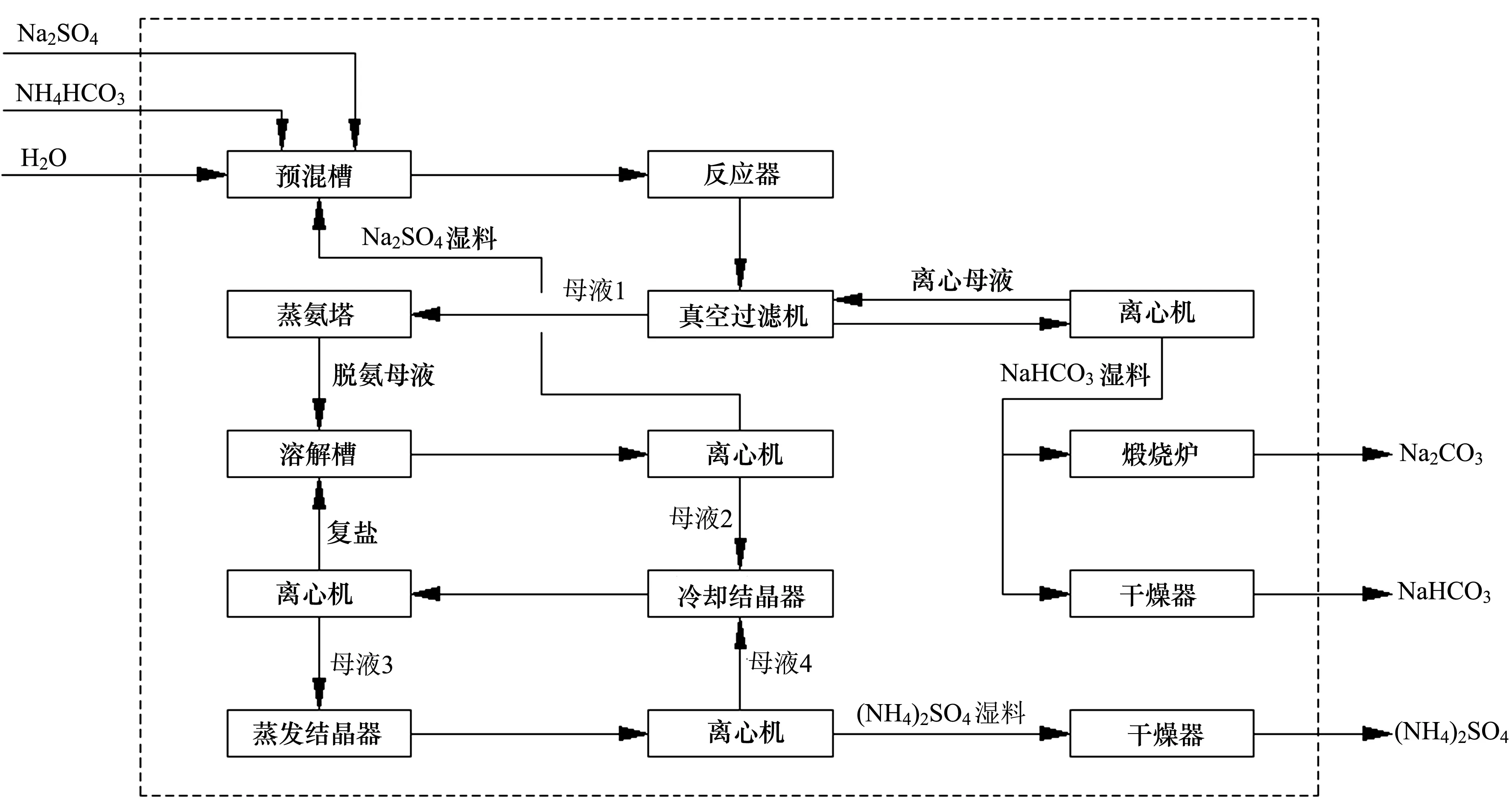
图3 芒硝制碱工艺方框流程图
2.1 试验所用主要试剂

表2 试验所用主要试剂
2.2 实验过程
2.2.1 复分解反应
首先将Na2SO4固体、NH4HCO3固体和水按比例加入预混槽常温混合,然后预混槽内物料再送至反应器,反应器内温度为30~40 ℃,压力为0.1 MPa,停留时间为0.5~2 h。
2.2.2 过滤洗涤和干燥
反应器内出料浆液经过过滤,分别得到制碱母液和NaHCO3滤饼,滤饼经过洗涤,得到纯净的NaHCO3结晶,NaHCO3直接干燥,得到小苏打产品,也可以在220 ℃煅烧2 h,得到纯碱。
2.2.3 母液处理
制碱母液经加热蒸氨及后处理,得到Na2SO4和(NH4)2SO4的混合溶液,将混合溶液在78 ℃下等温蒸发,Na2SO4结晶析出,在78 ℃保温过滤,得到的Na2SO4固体返回制碱,硫酸钠滤液为78 ℃下Na2SO4和(NH4)2SO4的饱和溶液。将硫酸钠滤液冷却至25 ℃,将析出复盐Dw结晶,复盐滤液E25为25 ℃下Na2SO4和(NH4)2SO4的饱和溶液,再将复盐滤液E25升温至78℃等温蒸发,保温过滤,得到(NH4)2SO4固体和硫酸铵滤液,与分离Na2SO4固体的滤液混合后再降至25 ℃,又析出复盐Dw结晶。复盐Dw与蒸氨后的重碱母液混合,继续下一循环,如此逐步分离出Na2SO4和(NH4)2SO4。
2.3 产品检测
按国家标准GB 210-2004检测纯碱的总碱量和SO42-,按国家标准GB 1606-2008检测小苏打的总碱量和SO42-,用欧美克科技有限公司的LS-POP(9)激光粒度仪测试碳酸氢钠的粒度,用库塞姆有限公司的EM-30扫描镜测试碳酸氢钠的外形;按国家标准GB 3559-2001检测硫酸铵的氮含量和水分。
3 结果与讨论
3.1 反应温度和物料配比对UNa的影响
由图1和表1可知,反应温度和物料配比均对UNa有影响,虽然未反应的Na2SO4在制碱母液处理工段被回收,但Na2SO4的一次转化率(即UNa)仍对能耗有较大影响,所以应尽量提高Na2SO4的一次转化率,即尽量使UNa最大。UNa最大时,制碱母液组成即表1中P3点组成,由表1中母液组分倒推反应物料配比如表3所示。
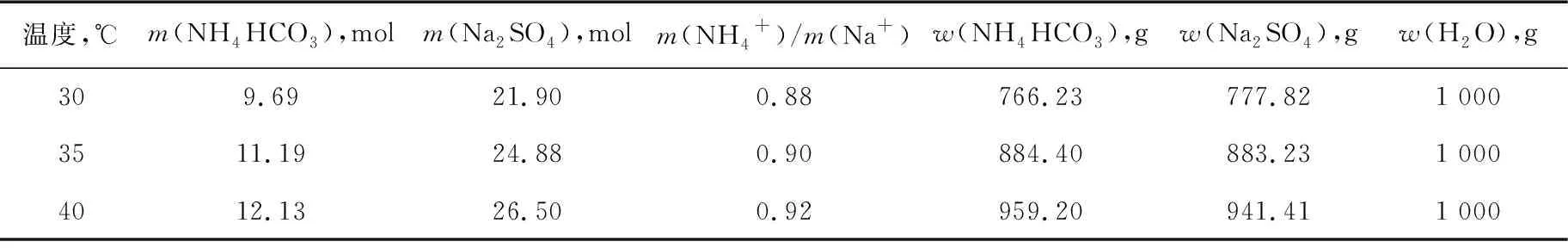
表3 反应物料组成
从表3可看出,三种温度下,反应物料中氨钠比均在0.9左右,考虑到碳酸氢铵受热容易分解,将反应物料氨钠比调整为0.9、1.0、1.1和1.2进行反应,以煅烧后得到的纯碱与原料中硫酸钠重量比计算UNa,分析结果如图4所示。

图4 不同温度和不同氨钠比时
由图4可知,在35 ℃温度下,反应物料氨钠比为1.0时,UNa最大为75.24%,40 ℃温度下,反应物料氨钠比为1.1时,UNa最大为75.12%,但40 ℃时氨钠比稍高,所以最适宜的反应条件为35 ℃、氨钠比为1.0。此时,每生产1 t纯碱产生4 t母液,而以NaCl为原料的氨碱法每生产1 t纯碱产生5.60 t母液,相比以NaCl为原料,本研究所述以Na2SO4为原料的方法需要处理的母液量减少近30%。
3.2 反应时间对纯碱纯度的影响
确定反应温度为35 ℃,反应物料氨钠比为1.0,改变物料在反应器中的停留时间,考察停留时间对纯碱纯度的影响。

表4 不同反应时间得到的NaHCO3固体粒度分布

0.5 h 1 h 2 h图5 不同反应时间得到的NaHCO3电镜图片(200倍)

表5 不同反应时间得到的NaHCO3、Na2CO3产品质量的影响
从粒度数据和电镜图片可知,反应时间延长,得到的NaHCO3固体粒度增大,原因为反应过程中,随着Na2SO4和NH4HCO3固体的溶解和反应,不断有NaHCO3晶核生成,如果物料停留时间短,则晶核未长大到预期粒度即被送出,得到的产品粒度偏小,很多细小晶体团聚形成晶簇,容易包裹和夹杂反应液,虽然最后经过洗涤但产品中杂质含量仍然偏高,如表5所示反应时间为0.5 h时小苏打和纯碱产品中硫酸盐含量偏高。而如果物料在反应器中停留时间足够长,NaHCO3晶核则可长大到预期粒度,得到的产品易洗涤,NaHCO3滤饼含水量低,可直接干燥为小苏打,也可煅烧为纯碱,煅烧能耗少,煅烧成的纯碱中杂质含量低,产品品质好。从粒度数据、电镜图片和纯碱中硫酸盐含量数据分析,反应时间为1 h即可达到要求,继续延长时间对产品品质的影响无明显改善。
4 结 论
1)以芒硝为原料制备纯碱工艺是可行的,工艺简单,投资少,能耗低,基本无三废排放,与NaCl为原料相比,每吨纯碱副产母液减少近30%;
2)芒硝制碱适宜的反应条件为:反应温度为35 ℃,反应原料配比m(NH4HCO3)∶m(1/2Na2SO4)∶m(H2O)=1.0∶1.0∶5.0,反应时间为1 h;
3)以芒硝为原料制备纯碱工艺副产硫酸铵符合农用硫酸铵质量要求;
4)以芒硝为原料制备纯碱工艺中间所得NaHCO3滤饼洗涤后可直接干燥为小苏打产品;
5)因以芒硝为原料制备纯碱工艺反应液为过饱和溶液,反应时需要添加部分固体芒硝或元明粉为原料。
