上皮间质转化在特发性肺纤维化及其信号通路中的研究进展
2022-08-16邓玲玲欧阳博书董竞成
邓玲玲 欧阳博书 魏 颖 董竞成△
(1复旦大学附属华山医院中西医结合科 上海 200040;2复旦大学中西医结合研究院 上海 200040)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因未明,成纤维细胞向肌成纤维细胞分化以及肺组织中细胞外基质过度积累的慢性进展性间质性纤维化肺炎,好发于60~70 岁的老年人,是临床上最常见的间质型肺炎类型[1],预后较差,中位生存期多为3~5 年,生存率甚至低于肺癌[2]。目 前IPF 的 治 疗 药 物 为2015 年 美 国FDA 批准的吡菲尼酮和尼达尼布,仅能改善患者症状,提高用力肺活量(forced vital capacity,FVC),不能延缓纤维化进展。越来越多的证据支持肺泡上皮细胞间质转化(epithelial-mesenchymal transformation,EMT)在IPF 发病机制中的作用,本文对特发性肺纤维化中EMT 相关的主要信号转导通路研究进展作一综述。
EMT 定义EMT 是一种上皮细胞去分化为可分泌细胞外基质(extracellular matrix,ECM)的间充质细胞,使纤维化病情长期存在,导致肺组织硬度增加[3],上皮细胞失去顶端基底极性,减少细胞间黏附特性,获得间质标记物如α-平滑肌肌动蛋白(αsmooth muscle actin ,α-SMA),N 钙 黏 蛋 白(Ncadherin),波形蛋白(vimentin),EMT 相关转录因子的表达,以及细胞骨架的重组过程[4-5]。EMT 有3 种不同的功能类型:Ⅰ型与胚胎发育过程中组织和器官形成的生理过程有关;Ⅱ型为正常的伤口愈合,在IPF 中表现为肺部组织过度修复;Ⅲ型是指恶性上皮细胞获得迁移性表型,与肿瘤的侵袭和转移有关[5]。
EMT 在肺纤维化中的作用IPF 的组织病理学特征表现为肺基底部和侧部的进行性瘢痕形成且呈不均匀性分布[6]。这些瘢痕区域的显著标志是存在成纤维细胞簇(fibroblast foci,FF)——产生ECM 的成纤维细胞/肌成纤维细胞的集合[6],位于正常和纤维化组织的边界处,代表组织重塑或瘢痕增生的前沿[7]。多年来,关于IPF 成纤维细胞簇中成纤维细胞/肌成纤维细胞的来源一直存在争议,大部分学者认为其主要来源于常驻组织成纤维细胞、骨髓源性祖细胞(所谓的纤维母细胞)和EMT来源的肺泡Ⅱ型上皮细胞(ATⅡ)[8]。在肺纤维化小鼠模型中进行的体内谱系追踪实验已证明,表达间充质标志物的细胞具有上皮来源特性[9]。来源于EMT 的成纤维细胞和肌成纤维细胞分泌胞外基质导致肺纤维化的进展,在肺纤维化的病理生理过程中发挥着关键作用[10]。因此,阐明EMT 相关信号通路,研究靶向EMT 的药物可能是治疗肺纤维化的主要途径。
EMT 信号的激活组织微环境可以决定细胞是否发生EMT[11]。在慢性病中,损伤部位的微环境表现出乏氧、慢性炎症、氧化应激、细胞因子分泌紊乱、胞外基质硬度增加等作为EMT 潜在的触发因素。近年来内质网应激(蛋白质异常折叠)在肺纤维化的机制中研究紧密[12-13]。内质网应激是指细胞受到各种刺激导致胞内未折叠蛋白发生或折叠错误的蛋白质在内质网腔的积累,引发下游信号通路的激活,导致上皮细胞功能异常和肺纤维化[14-16]。研究表示过表达突变体的肺表面活性蛋白C(surfactant,pulmonary-associated protein C,SP-C)会触发内质网应激和EMT[17],内质网跨膜蛋白需肌醇酶1(inositol-requiring protein-1,IRE1)/X 盒结合蛋白1(X box-binding protein 1,XBP1)信号通路可通过介导转录因子snail 的表达促进EMT 的进展,从而引起纤维变性[18]。此外,越来越多的证据支持胞外基质的硬度增加不仅是纤维化的结果,而且可以诱导成纤维细胞的激活,正反馈加重纤维化的程度[19]。近期,唐楠团队验证了持续的胞外机械张力升高可以激活ATⅡ细胞中的TGF-β 信号环路,从而驱动了肺纤维化病理从周围到中央的进展变化,高度模拟人体肺纤维化的病理特征,确立了肺泡再生受损、机械张力下降和进行性肺纤维化之间的直接机制联系[20]。未来以细胞外基质为信号激活起始的新视角可能会极大地促进我们对IPF 和其他纤维化疾病的理解。
EMT 相关的信号通路研究显示,调控EMT的信号转导通路主要包括TGF-β-Smad、Wnt/βcatenin、Hippo、Notch、NF-κB 通路等(图1),下面以前三个为例详细介绍。
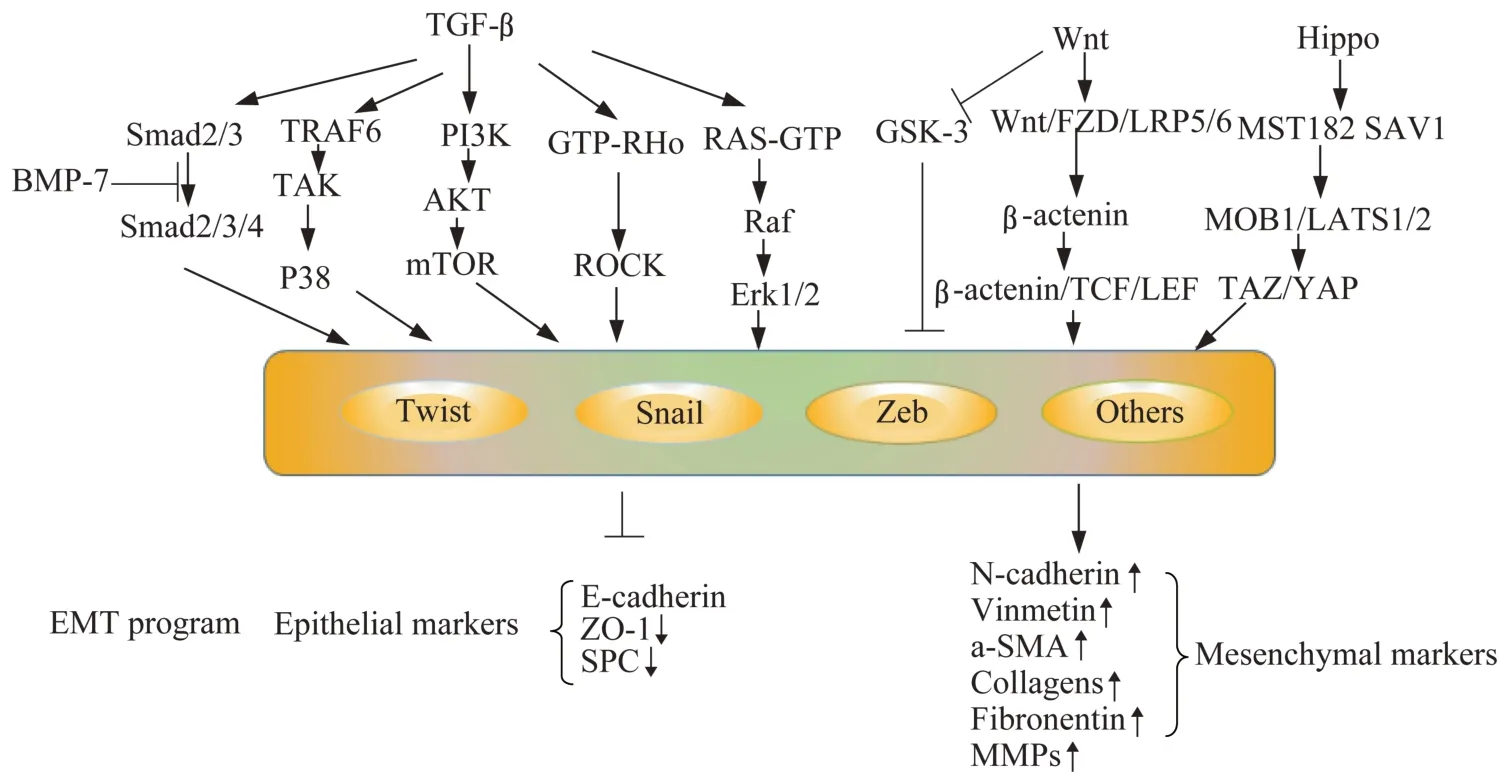
图1 EMT 主要信号通路流程图Fig 1 Flow chart of EMT related major signaling pathways
TGF- β -Smad 通 路 转 化 生 长 因 子 β(transforming growth factor-beta,TGF-β)是 驱 动EMT 的 关 键 生 长 因 子。TGF-β 家 族 包 括3 个 转 化生长因子β、2 个激活素(activins)、多种骨形态发生蛋白(bone morphogenetic protein,BMPs)和其他配体的同二聚体和异二聚体,它们都通过跨膜双特异性激酶受体(即充当Ser/Thr/Tyr 激酶的受体)的二元组合起作用[21]。肺泡上皮细胞通过整合素αvβ6结合潜伏的TGF[22],活化TGFβ1,触发信号蛋白Smad2/3 的磷酸化,与Smad4 形成复合物并易位入核[23],结合转录因子SNAI1、SNAI2、ZEB、TWIST1等,并激活间充质基因的转录,例如α-SMA、Ncadherin、纤连蛋白和波形蛋白基因,促进上皮细胞重编程,朝着更具迁移性和间充质性的表型发展[4,24]。由上皮细胞产生的TGF-β1 在肺纤 维化中起 主 要 作 用,敲 除TGF-β1 可 以 减 轻 肺 纤 维 化[25]。此外,TGF 家族成员BMP-7 可直接抑制TGF-β 诱导的Smad 依赖性细胞信号转导复合体在细胞核内的聚集和移动来逆转EMT 过程[26-27]。吡菲尼酮作为治疗肺纤维化的临床用药,主要通过抑制TGF-βsmad 通路发挥作用[28]。
TGF-β-nonSmad 通路 除了通过Smads 发出信号外,TGF-β 也可通过募集胞内信号介质如丝裂原活化蛋白激酶P38/MAPK/Erk、PI3K/AKT/mTOR 和Rho 家族的小GTPases 介导信号级联传递,参与细胞增殖,分化和骨架重排[29-31]。在EMT早期,E3 泛素连接酶SMAD 泛素化调节因子1(SMAD ubiquitylation regulatory factor 1,SMURF1)被招募至PAR6,作为紧密连接的促溶剂,经TGF-β RII 磷酸化,分解细胞骨架蛋白,促进细胞的迁移性表型获得[32]。许多证据表明,PI3K/Akt/mTOR 轴 在TGF-β 诱 导 的EMT 中 起 关 键 作用[33]。研究显示mTORC1 促进细胞运动性和侵袭性并调节细胞体积大小。而mTORC2 可调节EMT相关的细胞骨架变化和基因表达[34]。使用AKT 的抑制剂会增加E-钙黏蛋白的表达水平,减弱对Snail、波 形 蛋 白(vimentin,VIM)和α-SMA 的 表达[35-36],替 卡 格 雷 可 以 通 过 介 导PI3K 通 路 抑 制EMT 进展,降低博来霉素诱导的大鼠肺纤维化[35]。
Wnt/β-catenin 通路 在肺纤维化中起作用的为经典Wnt/β-catenin 通路,在共受体低密度脂蛋白相关蛋白(lipoprotein-related protein,Lrp)5/6 的影响下,Wnt结合细胞表面受体Fzd,并与之形成三元复合物[37],激 活 脱 链 蛋 白(disheled protein,Dvl),抑 制GSK-3β、β-catenin 发生磷酸化降解,使得β-catenin 在细胞质中积累,随后进入细胞核,与TCF/LEF 基因家族的转录子结合,激活目标基因,促进细胞外基质金属蛋白酶(matrix metalloproteinase,MMPs)、促炎症介质、生长因子等的表达[38]。在IPF 患者肺组织活检样本中发现ATII 中Wnt 3A、WISP1 表达上调,且在模型小鼠体内使用WISP1 特异性的中和抗体可减少细胞外胶原沉积,改善肺功能,下调与EMT 相关基因表达[39]。此外,使用特异性抑制β-catenin 信号转导的小分子ICG-001 可减轻博莱霉素诱导的肺纤维化和EMT[40]。
Hippo 通路 Hippo 信号通路最早由果蝇遗传筛选实验发现[41],当Hippo 信号通路激活时,下游的MOB1 和LATS1/2 在MST1/2 和SAV1 的 共 同 作用下发生磷酸化,从而激活MOB1 和LATS1/2,磷酸化下游YES 相关蛋白(yes-associated protein,YAP)和PDZ 结合基序(tafnzzin,TAZ),磷酸化的YAP/TAZ 与细胞质中的14-3-3 蛋白结合,随后被β-转导素重复序列包含蛋白(β-transducing repeatcontaining proteins,β-TrCP)泛素化降解,从而实现对细胞大小和体积的调控[42-43]。当Hippo 信号通路受到抑制时,YAP/TAZ 不能被泛素化降解,发生入核并与核内其他转录因子TEAD 结合,调节下游靶基因的表达[41]。Hippo 通路的核心转录效应子YAP/TAZ 是参与成纤维细胞活化和胞外基质形成的关键调节因子,其活性反映了细胞黏附和对细胞外基质机械信号刺激的反应能力,敲除YAP/TAZ可以减少成纤维细胞的收缩、增殖以及细胞外基质的合成[44]。最近一项研究发现骨髓间充质干细胞(mesenchymal stem cell,MSCs)内Snail/Slug-可与YAP/TAZ 形成复合体,参与MSCs 的自我更新和分化[45],且在肾纤维化、心脏纤维化中观察到活化的YAP 直接与TEAD 结合形成YAP-TEAD 异二聚体,介导EMT 的发生发展[46-47]。IPF 患者上皮细胞免疫荧光也显示核YAP 的上调以及MST1/2 表达 的 缺 失[48],YAP/TAZ 通 路 作 为 触 发 肺 纤 维 化EMT 可能的作用靶点当进一步深入研究。
靶向EMT 的中药IPF 是一种难以诊断的致命性间质性肺病,中药治疗肺纤维化逐渐被大家所认识。骨化三醇可抑制BLM 诱导的肺p38 MAPK和蛋白激酶B(Akt)的磷酸化,从而减弱EMT[49]。白藜芦醇可通过抑制氧化应激和TGF-β1/Smad 信号通路改善LPS 诱导的EMT 和肺纤维化[50]。玉屏风散中提取的天然化合物玉屏风总糖苷YPF-G 可以通过减少HMGB1 激活和逆转EMT 改善博来霉素诱导的肺纤维化[51]。芍药苷依赖Smad 途径,上调Smad7,降低转录因子Snail 的表达,抑制肺泡上皮细胞中TGF-β 引起的早期EMT[52]。黄芪甲苷通过抑制NLRP3 的表达降低肺纤维化上皮细胞间充质 转 分 化[53]。穿 心 莲 内 酯[54]、高 良 姜 素[55]、槲 皮素[56]、姜黄素[54,57]、灯盏乙素[58]等多项研究均显示中药活性单体可通过调控EMT,改善体内肺纤维化。
结语共表达上皮和间充质标志物细胞的存在表明了上皮细胞不一定是向产生ECM 的肌成纤维细胞的完全转化,可能存在细胞的不完全转化,存在杂合E/M 表型[59]。上皮细胞的可塑性应答,可视为细胞和细胞之间以及信号通路串扰的结果。除 上 文 提 及 的 通 路,Notch[60],NF-κB[59]、Sonic Hedgehog(SHH)信 号 通 路[61]、缺 氧 诱 导 因 子1α(Hypoxia-inducible factors 1α,HIF-1α)[62]、过氧化物酶 体 增 殖 物 激 活 受 体 - γ (peroxisome proliferatoractivated receptor,PPAR)[63],调 控miRNAs 的上皮剪接调节蛋白1/2(Epithelial splicing regulatory protein 1,ESRP1/ESRP2)相 关的信号转导通路等[64-65],都可不同程度上参与肺纤维化EMT 调节过程。总的来说,促进EMT 发生发展的最主要的通路仍是TGF-β-Smads 通路,但其余核心通路分子蛋白与TGF-β-Smads 信号转导间的相互串扰,营造了促纤维化的微环境,触发或增强了EMT,可成为下一步深入探索的方向。随着基础生物学的进展和新技术(如活体内成像技术,透明化技术,空间转录学等)的出现,以通路分子为靶点的治疗将取得丰硕的治疗成果。
作者贡献声明邓玲玲 文献检索,综述撰写,绘图。欧阳博书 文献调研和修订。魏颖 综述构思和修订。董竞成 综述审校。
利益冲突声明所有作者均声明不存在利益冲突。
