南极罗斯海-阿蒙森海2019—2020年夏季表层悬浮颗粒有机质组成及其控制因素
2022-08-15陶舒琴李云海唐正叶翔孙恒高众勇李国刚
陶舒琴,李云海,3,唐正,叶翔,孙恒,高众勇,李国刚
1. 自然资源部第三海洋研究所,厦门 361005
2. 福建省海洋物理与地质过程重点实验室,厦门 361005
3. 青岛海洋科学与技术国家实验室海洋地质过程与环境功能实验室,青岛 266237
4. 自然资源部第一海洋研究所,青岛 266061
5. 自然资源部海洋大气化学与全球变化重点实验室,厦门 361005
6. 自然资源部北海局北海海洋工程勘察研究院,青岛 266061
海洋生物通过光合作用合成有机碳并经过一系列复杂的迁移、转化过程最终埋藏在海洋沉积物中,这一途径被认为是海洋中除去和固定大气CO2的重要渠道,即称作生物泵,其中颗粒有机碳(POC)是整个生物泵中不同迁移碳形态中十分重要的部分。然而,绝大部分在真光层中由海洋初级生产者光合作用产生的颗粒有机质经过一系列复杂的转化和降解过程后被分解,而仅有不到1%的初级生产的颗粒有机质能落入海底沉积物中被长久地保存下来,形成长时间尺度的碳汇并实现对大气CO2长久封存。陆架边缘海是重要的碳吸收和埋藏区域,长期以来都是海洋生物地球化学的研究重点区域[1-8]。边缘海作为陆地和大洋之间的过渡地带,其受到海陆相互作用的影响,海洋环境变化和POC来源较大洋更复杂多变。罗斯海–阿蒙森海区为典型的受高纬海–气–冰系统耦合作用影响的边缘海系统,北邻全球最大的高营养盐、低叶绿素(HNLC)的南大洋海域,南靠南极大陆冰架边缘,具有极强的调控大气CO2的潜力(50°S以南海域平均初级生产力达4 414 Tg C/a)[9]。罗斯海–阿蒙森海属于西南极典型的冰架边缘海,也是地球上对全球气候变化响应和反馈最敏感的地区之一,在过去30多年时间里西南极冰架快速消融导致大量的融冰水进入邻近海洋,伴随着大量的陆源冰阀碎屑,对西南极近岸海洋环境产生了较大的影响[10]。例如,海冰融化打破了海–气界面的海冰限制,南大洋将增加对大气CO2的净吸收量;海冰覆盖面积不断减少,开阔海域增大,光照增加、水温上升以及陆源碎屑的增加将促进浮游植物生长,增加了海洋上层生源POC的产量和碳扣押能力。南极地区无河流径流的直接贡献,其陆源物质入海主要依靠冰川作用输送,冰川以及海冰的融化会提升西南极边缘海POC中陆源有机碳的贡献。因此,开展南极海洋POC的来源组成时空分布特征及其控制因素的研究对于全面认识海–气–冰系统耦合作用影响下的南极边缘海有机碳的生物地球化学循环过程具有重要意义。
在POC来源示踪研究中,可以通过总有机质元素组成(C/N比)、总有机质碳同位素(δ13C、Δ14C)和来源典型性生物标志物指标区分边缘海水体颗粒物和沉积物中浮游植物源、浮游动物源、海洋古菌源、陆地植被源、土壤源、化石岩源、化石燃烧源和人类排污源等不同来源有机质的信息[5,11-16],这些指标的综合应用为开展海洋环境中不同来源POC的运移、埋藏行为及生态环境重建提供了有力的工具。随着有机地球化学手段在颗粒态有机质来源示踪上的持续使用和发展,人们发现各类生物标志物指标和总有机质指标(包括元素组成和碳同位素性质)的分布特征除了受来源控制[17-18]外,还与不同的有机质保存机制、传输途经和成岩改造有关[19-23]。在来源复杂的边缘海颗粒有机碳来源组成区分研究中往往因为端元值重合和降解改造而导致有机地球化学指标偏离原本的端元信号,影响了其应用的准确性。
有关南极周边海域颗粒有机碳有机地球化学来源示踪研究已有一些报道。已有研究显示普利兹湾海水表层POC浓度的空间分布趋势与叶绿素a(Chl-a)等初级生产水平指标的空间分布趋势一致;C/N比指标呈现较大的时空变异性,变化范围3.6~9.2,呈现明显的藻类有机质(C/N浮= 4~10)[24]和海洋微生物源有机质(C/N微= 2.25~3.70)[25-26]共同贡献的信号,这反映了普利兹湾POC的来源主要以浮游植物衍生的生源颗粒有机质为主[27-28]。但POC的δ13C指标变化范围(-29.68‰~-26.30‰)却明显偏负于常见的海洋浮游植物源有机质的碳同位素端元值(即δ13C浮约为 -20‰)[29-31],且与陆地C3植物生源有机质的δ13C端元值范围重合(δ13C土壤约为-27‰,δ13C植物约为-29‰)[32-33]。另外,海区POC的δ13C值会受到浮游植物群落组成改变的影响,例如南极优势藻种南极棕囊藻等具有较低的δ13C值,其范围为-29.73‰~-31.85‰[34],与冰层上的陆源POC的同位素端元值有重叠[35],因此,初级生产者以南极棕囊藻为主导的海域,很难通过POC的δ13C指标对海水颗粒有机质进行来源组成的区分。生物标志物(biomarker)作为一类重要的地球化学新指标,是生物体死亡埋藏后经历了成岩作用等一系列的地质化学变化后留下的分子量较大、化学性质稳定的一类有机分子化合物;其比值在沉积物中变化不大,可以提供有关生物的输入、沉积环境、成岩等信息。于培松等在东南极普利兹湾表层沉积物中开展了浮游植物群落结构变化的生物标志物解译,结合现场调查资料发现沉积物中浮游植物典型生物标志物总含量和硅藻植物群落有较高的一致性,反映出沉积颗粒中的浮游植物源生物标志物记录能较好地反映上层水体的初级生产力及浮游植物群落结构特征[36]。但是对南极冰架边缘海的水体颗粒有机质中的生物标志物应用研究鲜有报道。因此,选取合适的且具有代表性的有机地球化学指标开展多参数综合研究是解译边缘海复杂来源颗粒有机质组成及其所蕴含环境信息的关键一步。
本文在西南极的罗斯海–阿蒙森海区开展POC来源组成的多参数重建研究包括POC、PN、δ13C以及典型海/陆源生物标志物多参数分析;评估不同有机地球化学指标在海–气–冰三重系统作用下的南极边缘海颗粒有机质来源组成示踪方面的应用潜力;以便选择有效的来源示踪指标评估POC来源组成,揭示不同来源POC空间分布的受控因素,加强对南极边缘海有机碳生物地球化学循环的认识。
1 区域概况
中国第36次南极科学考察期间(2019年11月—2020年4月),走航海水表层悬浮体组成研究区域的经度范围为164.3°E~112.8°W,纬度范围为66.1°~77.8°S,由南大洋太平洋扇区西侧进入罗斯海,沿罗斯冰架,绕过玛利亚伯德地边缘的冰架–外海区到达阿蒙森海西侧,悬浮体采样区覆盖了罗斯海内外湾区、罗斯冰架边缘外海区、苏兹伯格冰架边缘海区、尼克森冰架边缘海区和盖茨冰架边缘海区(图1)。
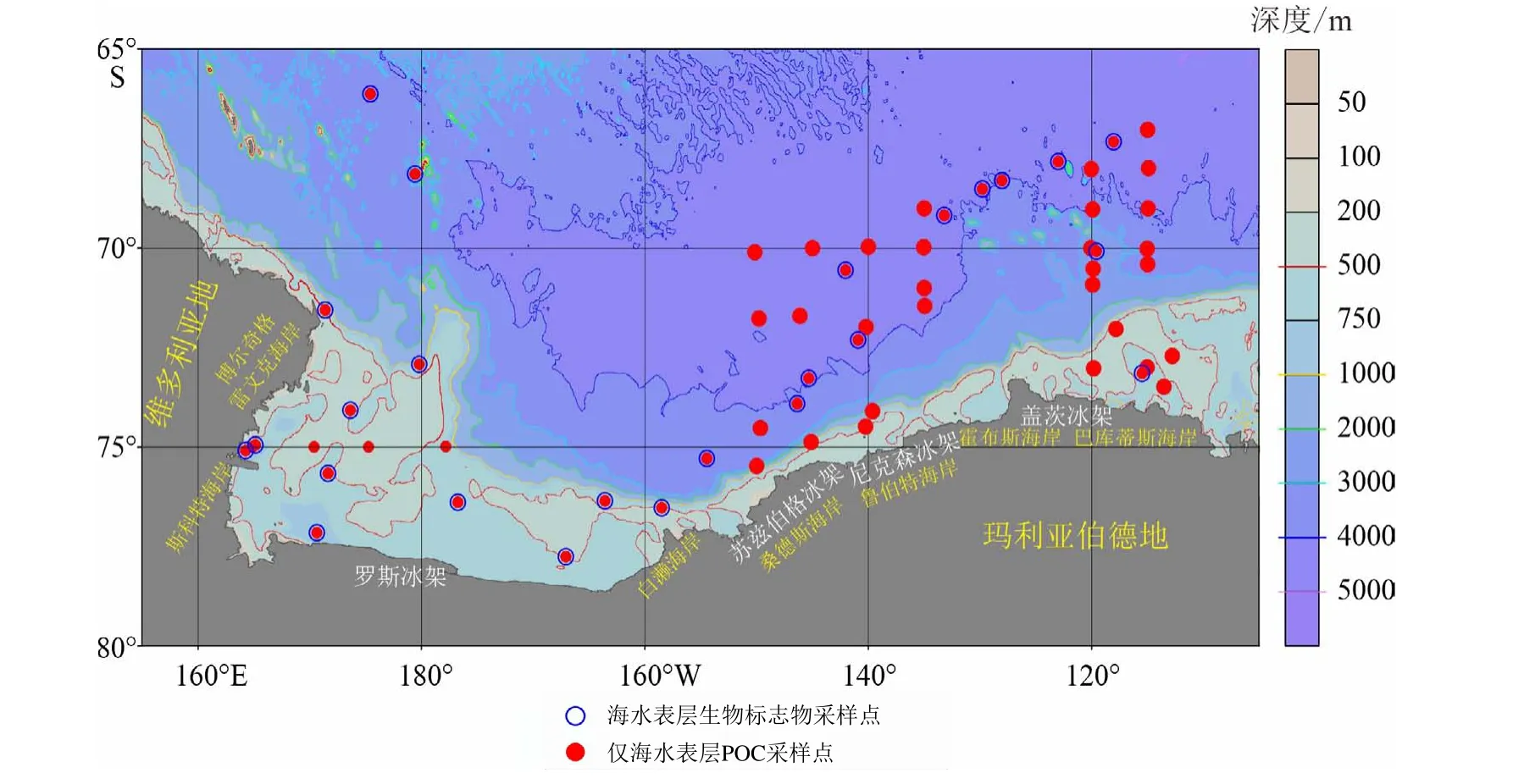
图 1 第36次南极科学考察航次海水表层生物标志物和POC采样站位图Fig.1 Sampling sites for biomarkers and POC in surface seawater in the Ross Sea-Amundsen Sea during CHINARE-36 voyage
调查海区覆盖西南极两个主要的边缘海区—罗斯海和阿蒙森海,该区域主要受自东向西的南极陆架沿岸流和自西向东的南极绕极流两大流系的影响。其中,罗斯海陆架水以低温(表层平均约为-1.9 ℃)、高盐和富氧为主要特征,海区营养盐水平较高,浮游生物极其丰富,有大量的阿黛利企鹅和帝企鹅群栖息在罗斯海周围地区。在强大的东风漂流影响下,表层海流沿冰架前缘向西流动,然后沿维多利亚地北流,与西风漂流汇合,形成大规模的顺时针环流[37-38]。阿蒙森海受深层绕极流入侵的影响,其陆架水以高温(表层平均约为+1 ℃)、低盐和低氧为主要特征,海水温度明显高于罗斯海附近海域,且与南大洋水体存在明显的交换[37]。本文中涉及调查区涵盖了南极两种典型的陆架边缘海类型,一种是类罗斯海型的边缘海(如罗斯海、威德尔海和普利兹湾等),这些陆架边缘海受中深层绕极流(CDW)入侵作用不显著,可形成低温高盐的陆架底层水;另一种是类阿蒙森海型的边缘海(如阿蒙森海和别林斯高晋海等),其受中深层绕极流入侵作用显著,无底层水形成,与陆架外的南大洋水体交换明显[39]。罗斯海和阿蒙森海发生浮游植物藻华的藻种主要是南极棕囊藻(Phaeocystis antarctica),浮游动物对这类浮游植物的摄食作用较弱,易被异养微生物迅速固定利用[40-41]。从有机碳垂直沉降和水平向外陆架输送的调控机制来看,阿蒙森海和罗斯海POC的沉降通量均较低,只有约3%的上层水体赋存的POC从真光层输出,其余有机碳可能以DOC形式存在的底层水体或者随陆架–陆坡的水体交换过程被输送至南大洋海盆区[40,42]。
2 样品与方法
2.1 颗粒物采样
航渡期间在罗斯海、阿蒙森海及其邻近海域采集了59个表层海水悬浮颗粒物样品,每个样品过水体积约5 L,经过0.7 μm玻璃纤维滤膜过滤,收集滤膜于-20℃保存,用于悬浮体浓度、POC、PN含量及稳定碳同位素比值(δ13C)等测试分析,采样站位如图1中实心红点所示。同时,本航次还采集了25个走航大体积表层海水颗粒物样品,每个样品过水体积约30~100 L,经过0.7 μm玻璃纤维滤膜过滤,收集滤膜于-20 ℃保存,用于典型生物标志物分析,采样站位如图1中空心蓝圈所示。
2.2 船载走航数据采集
表层海水温度(SST)、盐度(SSS)、荧光叶绿素(Fluorescence)和海水pCO2等环境基本参数数据来源于第36次南极科学考察“雪龙”号船载走航水环境基本参数探头实测数据。“雪龙”号上具备表层海水多要素实时采集系统,可实时观测表层海水温度、盐度、荧光叶绿素等走航水环境参数数据。表层海水pCO2数据采集自船侧约5 m深度的表层海水,利用船载表层泵水系统连续泵取至实验室仪器中测定。表层海水温度、盐度数据的测定仪器是SBE21温盐传感器,荧光叶绿素数据的测定仪器是Eco Triplet荧光计,海水pCO2的测量仪器是GO8050型pCO2走航观测仪。所有仪器在航次前都经过检定校准,以保证数据质量。
2.3 实验分析
悬浮体有机碳、氮含量及稳定碳同位素测定依据《海洋底质调查技术规程——我国近海海洋综合调查与评价专项》中第6.5部分“颗粒有机碳、氮测定”和第6.6部分“颗粒有机碳、氮稳定同位素测定”有关规定进行,酸化去除无机碳,超纯水洗至中性,烘干后利用元素分析仪和稳定同位素分析仪分别测定上述59个海水表层颗粒物样品中有机碳氮含量(TOC和TN)及δ13C组成,δ13C值按以下公式计算:
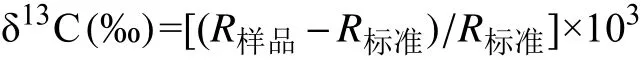
式中,R=13C/12C,R样品为样品同位素比值,R标准为标准物同位素比值。通过标准物平行测定获得有机碳氮含量和碳稳定同位素数据的分析精度分别为±0.2%和±0.2‰。元素分析仪型号为Elementar Vario ELIII,稳定同位素比质谱仪型号为Thermo MAT253 IRMS。
生物标志物分析方法参照Tao等文献中介绍方法[43],向图1中获取的25个大体积表层海水颗粒物样本中加入一定浓度的n-C24-D烷、n-C19饱和脂肪醇和n-C19饱和脂肪酸甲酯(Sigma公司)的混合内标。以9∶1(v/v)的二氯甲烷∶甲醇的混合溶剂超声萃取提取样品中的总脂后,用高纯氮气吹干溶剂。向样品瓶中加入5 mL的6%(w/w)的氢氧化钾/甲醇溶液和几滴超纯水,置于恒温条件下皂化反应过夜。用正己烷液液萃取皂化反应后的溶液3次合并上清液得到中性脂类组分。加入2 mol/L盐酸溶液并调整pH值到2,用4∶1 (v/v)的正己烷∶二氯甲烷混合溶剂液液萃取3次合并上清液得到酸性脂类组分。向所得的酸性脂类组分中加入5∶95(v/v)的盐酸:甲醇混合溶液于70℃下进行甲酯化反应后,用10 mL正己烷液液萃取3次合并上清液得到脂肪酸甲酯组分。将得到的中性脂类组分和酸性脂肪酸甲酯组分通过1%失活硅胶柱层析分离纯化。中性组分分别用8 mL正己烷、12 mL二氯甲烷∶甲醇(95∶5,v/v)淋洗分离为两个组分——烃类(F1非极性中性组分,其中包括正构烷烃)和醇酮类(F2极性中性组分,其中包括直链醇、甾醇和长链烯酮)。将上述硅胶柱层析分离后淋洗所得样品用高纯氮气吹干浓缩洗脱液后转移至2 mL细胞瓶,进行样品定容,F1组分异辛烷定容至60 μL;F2组分加入40 μL二氯甲烷和40 μL衍生化试剂(BSTFA),70 ℃衍生化反应1 h;酸性脂肪酸甲酯组分异辛烷定容至100 μL。
经过化学纯化后的烷烃、烯酮、脂肪醇及甾醇和脂肪酸甲酯组分用高效气相色谱(安捷伦7890B GC-FID)进行组成和含量分析。通过对比n-C8—C40正构烷烃混合标准,C16—C30直链醇混合标准,植醇标准,7种甾醇混合标准(粪甾醇、胆甾醇、菜籽甾醇、豆甾醇、谷甾醇和甲藻甾醇),纯颗石藻提取的 烯 酮 类 标 准(含C37:2、C37:3、C38:2、C38:3、C39:2、C39:3直链烯酮)和C12—C30脂肪酸甲酯混合标准确定不同生物标志物的出峰保留时间进行定性分析;采用内标法对不同生物标志物组分进行定量分析,生物标志物浓度测定数据的相对偏差<15%。本论文中主要测定的来源典型性生物标志物和主要来源信息见表1所示。

表 1 主要分析测定目标化合物及其来源信息Table 1 The target biomarker compounds and the major sources
本文运用长链正构烷烃的碳优势指数(carbon preference index,CPI)对罗斯海–阿蒙森海悬浮颗粒物中的岩性有机质来源进行甄别。通常,当正构烷烃的CPIΣ25-33指标>1指示存在陆地生源贡献,比值越大代表陆地生源贡献越强;当CPIΣ25-33值接近或等于1指示以岩性有机质的贡献为主。其计算公式为:
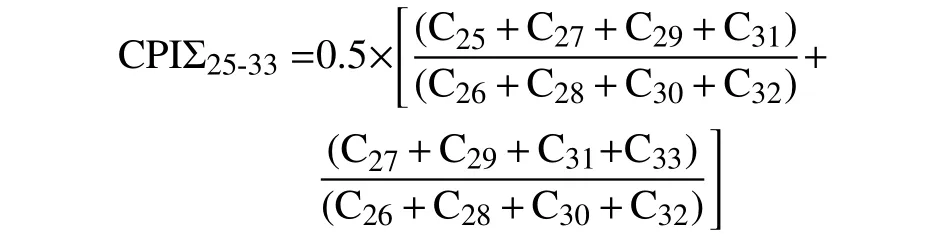
本论文中所用总有机质和生物标志物参数的所有测试分析均在自然资源部第三海洋研究所科学仪器共享平台进行。
2.4 统计分析
本文应用皮尔逊积矩相关系数R来度量水环境参数和生物标志物参数两变量之间相互关系的强弱,取值范围在[-1,+1]之间。另外,有机地球化学指标空间变化因子分析采用的是SPSS软件中的主成分分析模块,通过降维的手段把多个指标转化为少数几个综合指标的一种对多变量数据进行最佳综合简化的多元统计方法,用少数几个综合指标变量去解释多个指标空间分布之间存在的大部分差异。
3 结果与讨论
3.1 罗斯海-阿蒙森海夏季表层海水环境参数空间分布特征
图2A–D分别为第36次南极科学考察船载走航表层海水温度、盐度、荧光叶绿素和海水pCO2等环境基本参数信息。调查海区夏季海水表层温度变化范围为-1.60~1.79 ℃,平均值为-0.24 ℃;海水表层盐度变化范围为32.1~34.3 psu,平均值为33.4 psu;空间分布上呈现近罗斯海区盐度较高,近阿蒙森海区盐度逐渐降低的分布特征,这与罗斯海存在高盐陆架水的特征一致[37,39]。地形开阔的阿蒙森海温度和盐度呈现出明显的空间分区特征,阿蒙森海受深层绕极流入侵的影响,陆架水多呈现高温特征,尤其是海冰区受夏季融冰水影响呈现明显的低盐特征(图2A、B),只有阿蒙森海近岸冰间湖区水域呈现高温高盐特征,这也与前人的研究结果一致[37]。
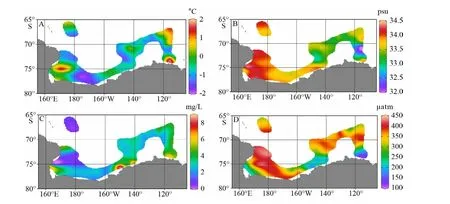
图 2 罗斯海–阿蒙森海研究区2019—2020年夏季走航表层海水环境参数空间分布图A. 表层海水温度,B. 海水表层盐度,C. 荧光叶绿素,D. 海水CO2分压。Fig.2 The spatial distributions of underway environmental parameters of surface seawater in the Ross Sea-Amundsen Sea in austral summer of 2019-2020A. SST, B. SSS, C. fluorescence, D. seawater pCO2.
调查海区荧光叶绿素变化范围为0.5~8.6 mg/L,平均值为3.9 mg/L。在空间分布上,整体呈现近岸高、外海低的趋势,高值区主要分布于冰边缘近岸区(图2C),这与冰边缘近岸区存在大量的高初级生产力的冰间湖对应[53]。调查海区海水pCO2变化范围为121~437 μatm,平均值为294 μatm。海水pCO2变化可受海水温度等物理过程中气体溶解度的影响,一般随海水温度升高而升高,但在近海高生产力海区这一参数主要受浮游植物光合作用吸收CO2过程控制,可用来表征表层水中浮游植物生物活动强度。夏季罗斯海–阿蒙森海区海水pCO2空间分布整体上呈现近岸低、外海高的趋势。海水pCO2低值区与荧光叶绿素的高值区对应,分别位于罗斯冰架边缘、苏兹伯格冰架和盖茨冰架边缘近岸区(图2D),与这些区域存在较高初级生产力结果一致[53-54]。
3.2 罗斯海-阿蒙森海表层颗粒总有机碳氮及稳定碳同位素空间分布特征
罗斯海–阿蒙森海海区夏季表层颗粒总有机碳(POC)体积浓度变化范围为59.6~487.4 μg/L,平均浓度为117.8 μg/L;颗粒总氮(PN)体积浓度变化范围为35.8~350.1 μg/L,平均浓度为95.6 μg/L(图3A、C)。海水表层悬浮体中的有机碳含量变化范围为3.6%~26.3%,平均值为13.8%;海水表层悬浮体中的总氮含量变化范围为2.0%~14.9%,平均值为6.9%(图3B、D)。表层海水POC和PN体积浓度的高值区主要分布在苏兹伯格冰架和盖茨冰架边缘海近岸区,罗斯海冰架边缘海近岸区也存在次高值,与研究区域罗斯海、苏兹伯格湾、阿蒙森海冰间湖的分布对应[53],低值区普遍存在于远离冰架的南大洋外海区(图3A、C)。由表2可以看出,表层海水POC和PN体积浓度空间变化与海水表层荧光叶绿素值呈显著正相关,与海水表层pCO2呈显著负相关,反映夏季罗斯海–阿蒙森海表层海水中颗粒有机质的空间分布差异主要受到海区初级生产水平调控。表层海水颗粒物中有机碳、氮含量(POC%和PN%)的高值区与浓度的高值区分布存在差异,尤其是在罗斯海冰架和盖茨冰架这两个大型冰架外边缘海区域,POC%和PN%并未呈现高值,可能反映了罗斯海和阿蒙森海冰架边缘近海区受大量的冰阀陆源无机碎屑的冲淡效应影响,导致近岸高生产力海区表层海水悬浮颗粒物中生源有机质含量降低(图3B、D)。
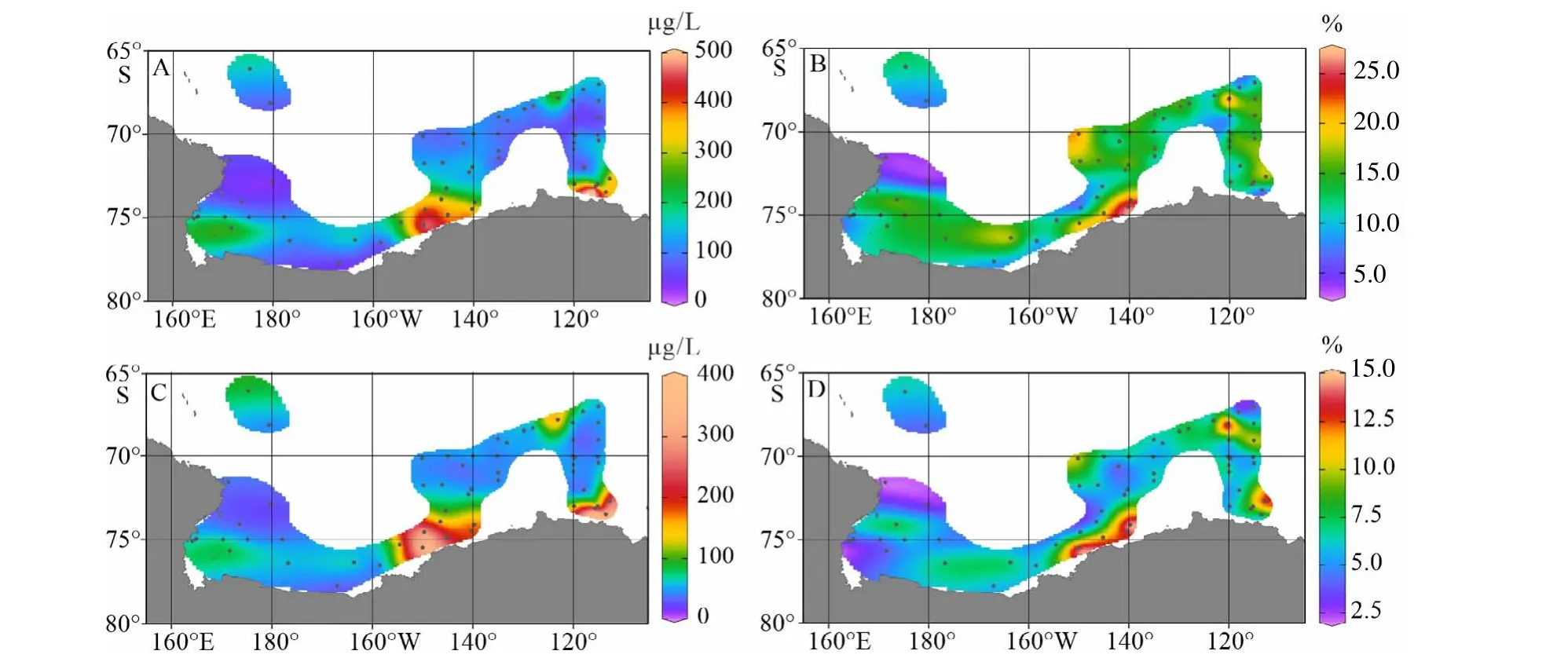
图 3 罗斯海–阿蒙森海研究区2019—2020年夏季表层海水颗粒有机碳、氮分布图A. 总有机碳体积浓度,B. 总有机碳含量,C. 总氮体积浓度,D. 总氮含量。Fig.3 The spatial distribution of surficial suspended POC and PN in the Ross Sea-Amundsen Sea in austral summer of 2019-2020A. Volume concentrations of POC, B. POC%, C. volume concentrations of PN, D. PN%.
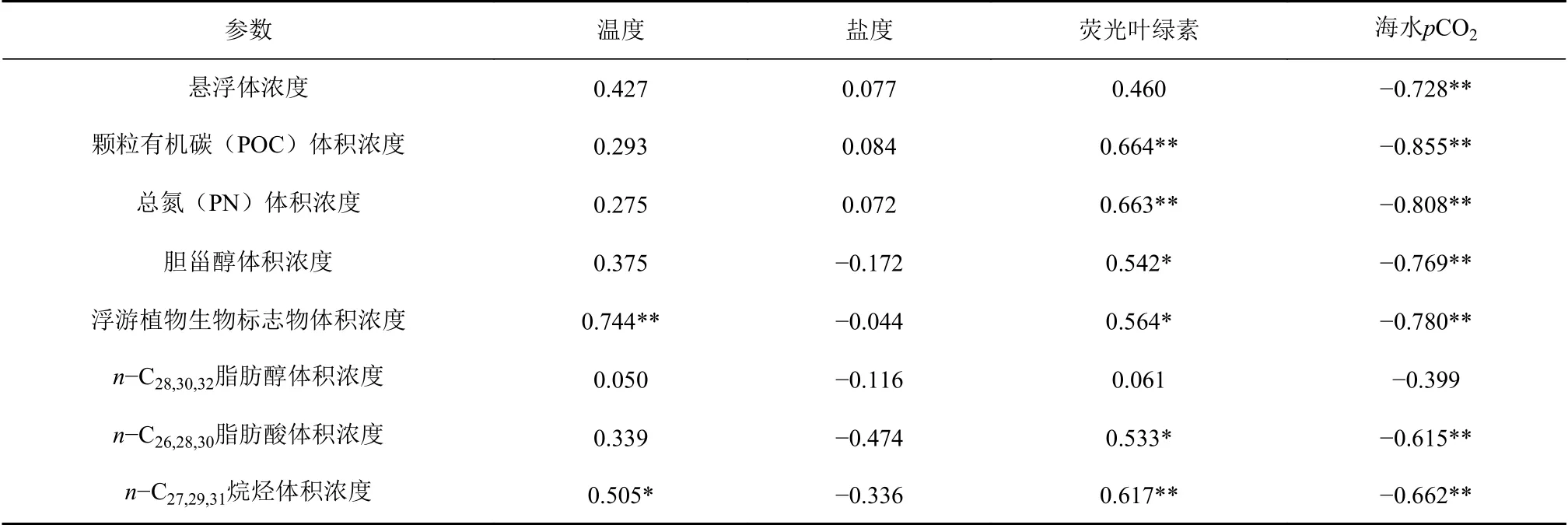
表 2 罗斯海-阿蒙森海研究区2019-2020年夏季表层水体中悬浮颗粒、总有机碳氮和不同来源生物标志物浓度与海洋环境基本参数空间变化相关性(R)Table 2 The pearson correlations (R) of concentrations of suspended particulates, POC, PN, and source-specific biomarkers versus marine environmental parameters in the Ross Sea-Amundsen Sea in austral summer of 2019-2020
海水颗粒总有机质的δ13C值和C/N比值是常见的区分POC来源组成的有机地球化学指标,其变化受到有机质来源特性和微生物降解改造等过程的共同影响[18]。罗斯海–阿蒙森海研究区海水表层悬浮体中总有机质的δ13C变化范围为-32.7‰~-25.2‰,平均值为-28.5‰(图4A),这一变化区间与前人在南极周边其他海域的表层悬浮颗粒物有机质碳同位素研究结果一致,显示表层海水悬浮颗粒有机碳的δ13C值在南极周边邻近海域空间分布特征复杂。整体上,研究区域大部分离岸区的POC的δ13C值明显偏负,普遍低于-26.1‰,南极冰架边缘海离岸区出现贫13C的POC信号归因于离岸近南大洋区较高的溶解CO2浓度和极寒环境较低的浮游植物生产率导致无机碳向有机碳的转化过程中产生了较强的生物分馏作用[55],吸收较多的12CO2,导致离岸低生产率海区POC的δ13C出现偏负的现象。这一现象在高纬度的北极海区也有类似报道[18]。罗斯海和阿蒙森海冰架边缘近岸高生产力区POC的δ13C呈现高值,显示罗斯海和阿蒙森海近岸区富13C同位素的海洋生源POC的贡献增加;但苏兹伯格湾冰架边缘“高荧光低海水pCO2”反映的高生产力近岸区POC的δ13C呈现极负的信号(-29.6‰~-31.1‰),与冰层陆源POC偏负的δ13C特征值相似;与此同时,Kopczyńska等发现南极优势藻种南极棕囊藻、自养甲藻等一些浮游植物具有较低的δ13C值,其范围为-29.73‰~-31.85‰[34],与苏兹伯格湾海水表层POC的δ13C值十分接近。可以看出,苏兹伯格湾海水表层POC偏负的δ13C值可归因为苏兹伯格湾海水表层POC陆源组分的贡献增加,还可能反映该海区初级生产者是以贫13C的浮游植物群落主导,因此南极冰架边缘海区海洋浮游植物源有机质的δ13C端元值会因浮游植物种属不同发生较大改变,从而影响总有机质δ13C指标对区域海水POC来源的解析。
罗斯海–阿蒙森海研究区海水表层悬浮体中总有机质C/N比值变化范围为1.3~3.6(图4B),呈现明显的微生物源有机质贡献的信号(C/N微=2.25~3.70)[25-26],说明该海区表层悬浮颗粒有机质受微生物源的贡献和改造明显,这也与前人发现罗斯海和阿蒙森海水体中约97%的POC可能被微生物固定、降解或随环流被输送至南大洋海盆区结果一致[39,41]。
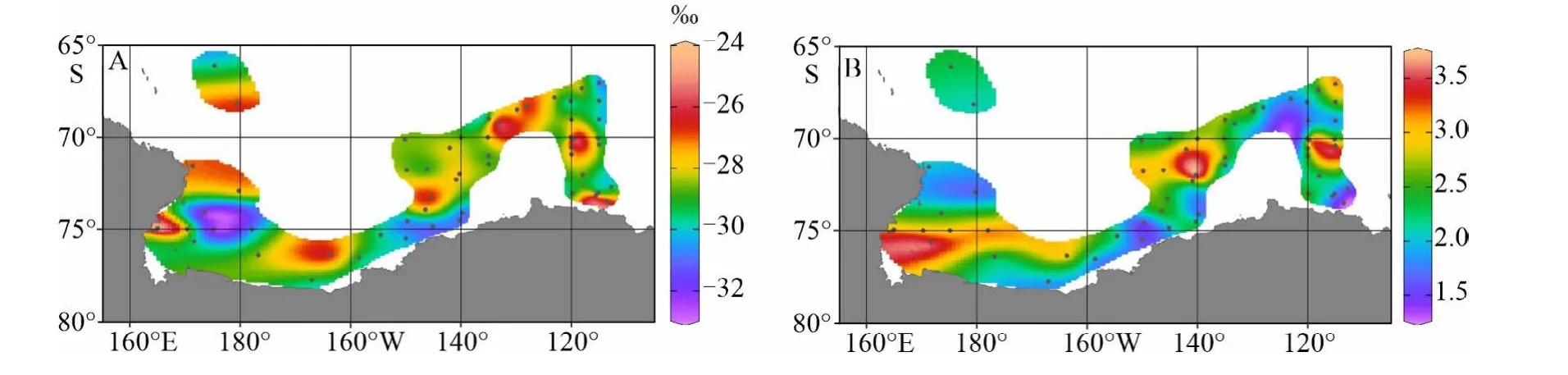
图 4 罗斯海–阿蒙森海研究区2019—2020年夏季表层海水颗粒总有机质的δ13C(A)和C/N(B)分布图Fig.4 The spatial distributions of δ13C (A) and C/N (B) ratio of surface suspended particulate in the Ross Sea-Amundsen Sea in austral summer of 2019-2020
3.3 罗斯海-阿蒙森海表层颗粒物中典型生物标志物空间分布特征
综上所述,罗斯海–阿蒙森海调查区域悬浮颗粒物总有机质指标显示表层海水POC的来源复杂,总有机质的C/N比和δ13C信号呈现多端元混合信号。为了进一步定义、划分和示踪海区表层悬浮颗粒物中不同来源有机质的贡献和空间分布特征,本文分析测定了罗斯海–阿蒙森海表层水体中59个悬浮颗粒物中的典型海洋浮游植物源、动物源和陆源生物标志物,作为指示区分不同来源POC贡献的参数指标。本文中选取了两种浓度表征方式,分别为生物标志物的体积浓度和TOC校正浓度,前者由悬浮颗粒物样本上某生物标志物质量除以过水体积来表征,后者由某生物标志物的体积浓度除以POC的体积浓度来表征。
常用区分海源有机质贡献的生物标志物主要是海洋浮游植物和海洋古菌细胞膜中的类脂有机质,例如硅藻产生的菜籽甾醇、甲藻产生的甲藻甾醇和颗石藻产生的长链不饱和C37烯酮,以及海洋泉古菌产生的类异戊二烯GDGTs等[44,56]。杨和福等对南极优势浮游植物棕囊藻细胞脂类组成的研究结果显示其甾醇组分中菜籽甾醇含量最高可达总甾醇的97.5%[57]。因此,本文选取菜籽甾醇、甲藻甾醇和长链不饱和C37烯酮这三项生物标志物浓度总和作为指示区分海洋浮游植物源POC贡献的指标。罗斯海–阿蒙森海调查海区三项浮游植物生物标志物体积浓度总和变化范围为0.034~1.114 μg/L,平均浓度值为0.286 μg/L。由图5A所示,浮游植物源生物标志物的高浓度值分布在苏兹伯格冰架和盖茨冰架边缘海近岸区,对应苏兹伯格湾、阿蒙森海高叶绿素、低pCO2特征反映的高初级生产力的冰间湖区(图2C、D);低浓度水平区分布在罗斯海、阿蒙森海离岸区和南大洋海盆区;虽然罗斯冰架边缘近岸海区从海水表层荧光和pCO2等海水环境参数反映出该区域拥有较高的浮游植物活动,但是浮游植物源生物标志物的浓度相对阿蒙森海和苏兹伯格湾的浓度水平低,但从海湾尺度看浮游植物源生物标志物浓度变化仍然呈现出冰架边缘近岸高离岸低的空间分布趋势。
由表2可以看出,三项浮游植物源生物标志物体积浓度空间变化与调查海区海水表层温度、荧光值呈显著正相关,与海水表层pCO2值呈显著负相关,反映夏季罗斯海–阿蒙森海表层海水中浮游植物生物标志物浓度空间分布差异主要受到海区初级生产水平调控。另外,海水表层悬浮体中三项浮游植物生物标志物有机碳(TOC)校正浓度变化范围为188~2 248 μg/g,平均值为911 μg/g;罗斯海冰架边缘近岸区浮游植物源生物标志物的体积浓度呈现相对较低值,而有机碳校正浓度却呈现高值(图5A、B),反映了罗斯海高生产力的近岸海域浮游植物源有机碳占总悬浮颗粒有机碳的相对比例高。受罗斯海半封闭的海湾地型的影响,罗斯海湾内的陆架水与外侧的南极中深层绕极流的交换受限[39],导致高初级生产水平的罗斯海比相对开阔的苏兹伯格冰架和盖茨冰架边缘海域受到陆架融冰水的冲淡作用更加明显,因此,罗斯海表层海水中浮游植物源生物标志物可能受到近岸融冰水的稀释作用导致体积浓度水平较低。阿蒙森海盖茨冰架边缘近岸区浮游植物源生物标志物的有机碳校正浓度明显低于罗斯海近岸区(图5B),反映了阿蒙森海冰架边缘近海区浮游植物源有机碳虽然在海水中浓度极高,而占总POC的比例变低,这可能是该区域存在明显的陆源颗粒物稀释效应造成的,也与阿蒙森海盖茨冰架边缘近海区检测到的较高的陆源烷基脂类生物标志物浓度水平结果一致。
胆甾醇是动物体内主要的甾醇类化合物,其浓度水平可以作为指示区分动物源POC贡献的指标[58]。罗斯海–阿蒙森海调查海区海水表层动物源胆甾醇体积浓度变化范围为0.056~0.495 μg/L,平均浓度值为0.225 μg/L。高浓度水平区分布在罗斯海、苏兹伯格湾、阿蒙森海盖茨冰架冰缘的里格利湾(Wrigley Gulf)和拉塞尔湾(Russell Bay)近岸区;低浓度水平区分布在罗斯海、阿蒙森海离岸区和南大洋海盆区(图6A)。在苏兹伯格冰架和盖茨冰架边缘海区胆甾醇浓度与浮游植物源生物标志物体积浓度空间分布趋势一致,反映这些冰架边缘海水体中较高的动物源POC浓度水平对应研究区高的浮游植物源POC信号,说明摄食浮游植物的浮游动物等次级生产者是这些动物源POC的主要贡献者。罗斯海冰架边缘近岸水体中出现较高浓度水平的动物源胆甾醇信号,但浮游植物源生物标志物体积浓度相对偏低,说明该区域高浓度水平的动物源有机质可能来自冰架边缘大量栖息的企鹅、海豹等高等动物。
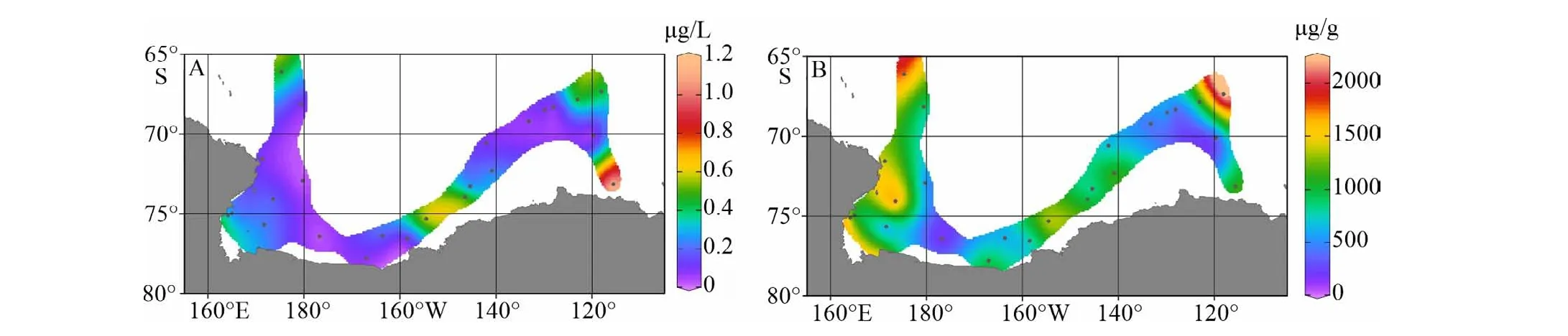
图 5 罗斯海–阿蒙森海研究区2019—2020年夏季表层海水悬浮颗粒物中三项浮游植物生物标志物丰度分布图A. 三项浮游植物生物标志物体积浓度,B. 三项浮游植物生物标志物TOC校正浓度。Fig.5 The spatial distributions of three phytoplanktonic biomarkers abundances for surface suspended particulate in the Ross Sea-Amundsen Sea in austral summer of 2019-2020A. Volume concentrations of three phytoplanktonic biomarkers, B. TOC normalized contents of three phytoplanktonic biomarkers.
由表2可以看出,胆甾醇体积浓度空间变化与调查海区海水表层荧光叶绿素值呈显著正相关,与海水表层pCO2呈显著负相关,也反映夏季罗斯海–阿蒙森海表层海水中动物源生物标志物浓度空间分布差异与海区初级生产水平相关,高胆甾醇体积浓度信号较好地对应了高动物生物量区。另外,海水表层悬浮体中胆甾醇有机碳校正浓度变化范围为313~1 997 μg/g,平均值为868 μg/g;其空间分布趋势显示罗斯海近岸区、离岸海盆区胆甾醇有机碳校正浓度呈现高值(图6B),反映了罗斯海近岸和离岸区海水表层POC中动物源有机质所占比例较高。与浮游植物生物标志物一样,阿蒙森海盖茨冰架边缘近海区虽然是生产力高水平海区,但同时也是高陆源物质输入区域(图7A、C、E),因此,动物源有机组分占悬浮颗粒有机质的比例也会受到近岸区较高的陆源物质稀释效应的影响。
目前常用的示踪陆源有机质的生物标志物有来自于高等植物蜡质的烷基脂类化合物,例如长链正构烷烃(n-C27、29、31)、脂肪醇(n-C24、26、28)、脂肪酸(n-C26、28、30)等[48,50]。而木质素则是另一类应用非常广泛的指示陆源有机质的生物标志物,维管植物中木质素的丰度很高(仅次于纤维素),又比较难降解,组成的差异还可用于区分植物类型(C3、C4、CAM);酸/醛比等降解参数可以用于评估降解程度,且受大气输送的影响很小,因此对周围的陆地植物类型的判断更准确[59-61]。还有一类由厌氧细菌合成的支链甘油二烷基甘油四醚化合物(branched glycerol dialkyl glycerol tetraethers,支链GDGTs)广泛存在于土壤之中,并且通过径流输送进入近岸沉积物中,可以作为陆源有机质的示踪物[33]。由于南极属于特殊的海–气–冰三重系统作用影响下的边缘海系统,陆源物质入海过程不是通过陆地径流,而主要通过冰川活动、融冰等过程进入到近岸水域,且在南极冰架边缘近岸海水表层悬浮颗粒物中没有检测出土壤细菌产生的支链GDGTs信号。从植物类型看,南极陆地植被以苔藓地衣为主,几乎无维管植物。因此,支链GDGTs和木质素无法用于南极冰架边缘海的陆地生源有机质甄别。
本文选取了来源于陆地植物树叶蜡质的烷基脂类化合物作为指示区分陆源POC贡献的典型生物标志物。罗斯海–阿蒙森海调查海区表层海水中n-C27、n-C29和n-C31三种常见陆源正构烷烃(n-C27,29,31)体积浓度总和,n-C26、n-C28和n-C30三种常见陆源脂肪酸(n-C26,28,30)体积浓度总和以及n-C28、n-C30和n-C32三种常见陆源脂肪醇(n-C28,30,32)体积浓度总和变化范围分别为0.002~0.031 μg/L(平均浓度值为0.009 μg/L)、0~0.016 μg/L(平均浓度值为0.008 μg/L)和0~0.017 μg/L(平 均 浓 度 值 为0.004 μg/L);大多数站位长链(碳数>24)烷基脂类等这一类指示陆源有机质分子信号基本接近检测限,只有离岸较近的冰边缘海湾区的表层悬浮体中能检测到一定的陆源有机质入海输送的信号,其体积浓度水平比海区浮游植物生物标志物低1—2个数量级(图7A、C、E),且长链正构烷烃碳优势指数(CPIΣ25-33)接近于1(图8),说明西南极冰架边缘海入海输送的陆源碎屑中陆地植物源有机碳含量较低,主要以有机碳丰度较低的岩性陆源颗粒为主,这与南极大陆植被覆盖较少的结果相符。图7A、C、E显示3类长链烷基脂类生物标志物体积浓度的高值区主要分布在近阿蒙森海扇区的苏兹伯格冰架和盖茨冰架近岸区,罗斯海扇区整体呈现低浓度水平。由表2可以看出,n-C27,29,31正构烷烃、n-C26,28,30脂肪酸这两类典型陆源生物标志物分布与海水表层荧光呈显著正相关,与pCO2呈显著负相关,说明冰架边缘近岸海区高的陆源物质贡献区同时也是海洋生物活动旺盛区。另外,海水表层悬浮体中n-C27,29,31正构烷烃、n-C26,28,30脂肪酸和n-C28,30,32脂肪醇的有机碳校正浓度变化范围分别为9~53 μg/g(平均浓度值为29μg/g)、0~81 μg/L(平均浓度值为34 μg/L)和0~43 μg/g(平均浓度值为16 μg/g),其空间分布高值区主要分布在低生产力的外海区(图7B、D、F),拥有较高初级生产力的近岸海域受到大量浮游植物源有机质产生贡献拉低了陆源有机组分在POC中所占比例。
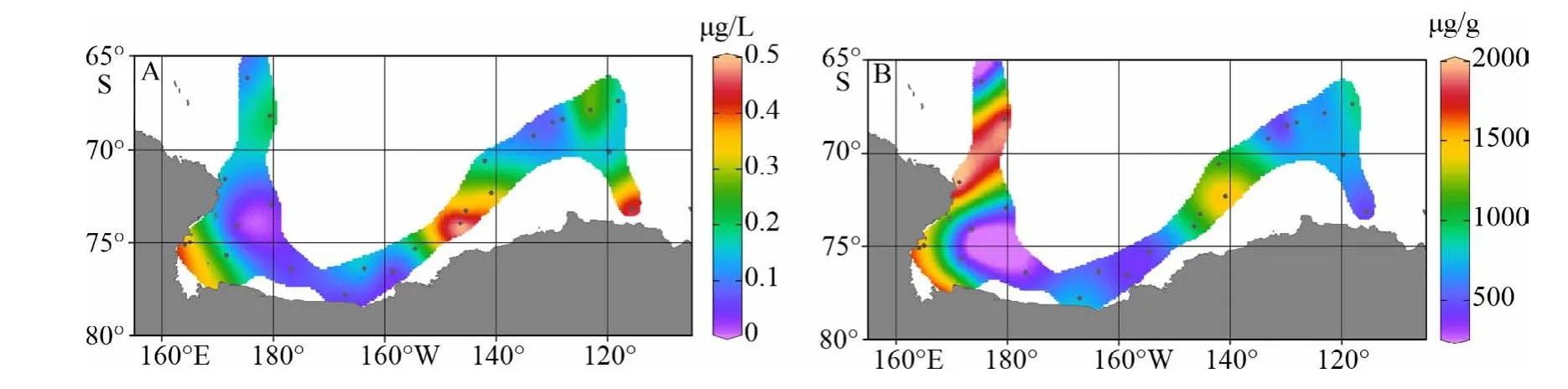
图 6 罗斯海–阿蒙森海研究区2019-2020年夏季表层海水悬浮颗粒物中胆甾醇丰度分布图A. 胆甾醇体积浓度,B. 胆甾醇TOC校正浓度。Fig.6 The spatial distributions of cholesterol abundances in surface suspended particulate in the Ross Sea-Amundsen Sea in austral summer of 2019-2020A. Volume concentrations of cholesterol, B. TOC normalized contents of cholesterol.
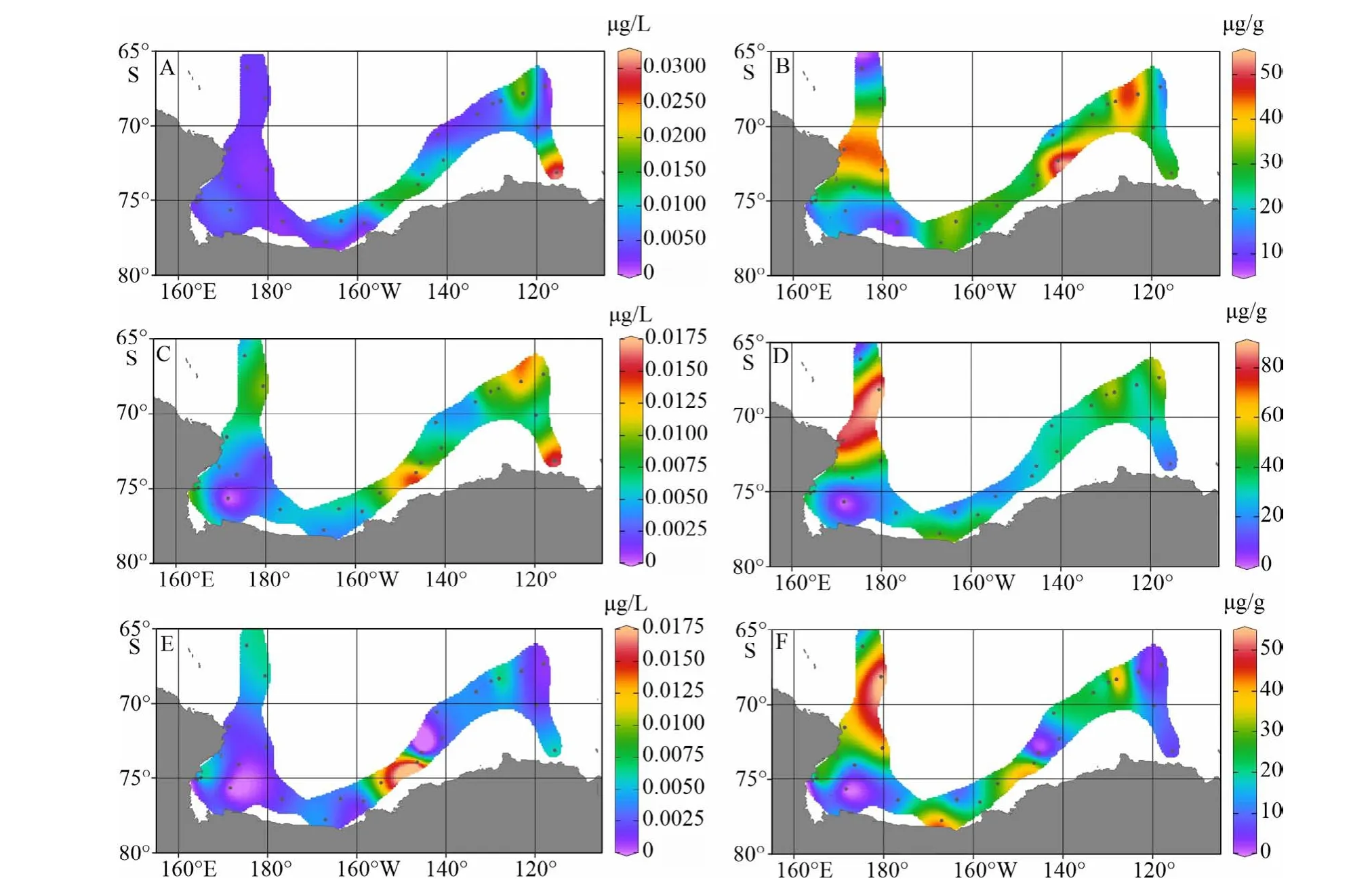
图 7 罗斯海–阿蒙森海研究区2019—2020年夏季表层海水悬浮颗粒物中三类典型陆源生物标志物丰度分布图A. n-C27,29,31烷烃体积浓度,B. n-C27,29,31烷烃TOC校正浓度, C. n-C26,28,30脂肪酸体积浓度, D. n-C26,28,30脂肪酸TOC校正浓度,E. n-C28,30,32脂肪醇体积浓度, F. n-C28,30,32脂肪醇TOC校正浓度。Fig.7 The spatial distributions of three groups of terrestrial biomarkers abundances in surface suspended particulate in the Ross Sea-Amundsen Sea in austral summer of 2019-2020A. volume concentrations of n-C27,29,31 alkanes, B. TOC normalized contents of n-C27,29,31 alkanes, C. volume concentrations of n-C26,28,30 FAs,D. TOC normalized contents of n-C26,28,30 FAs, E. volume concentrations of n-C28,30,32 alkanols, F. TOC normalized contents of n-C28,30,32 alkanols.
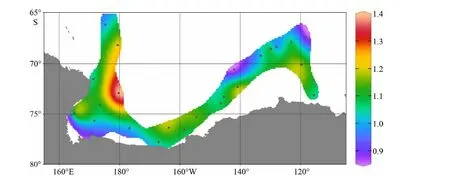
图 8 罗斯海–阿蒙森海研究区2019—2020年夏季表层海水悬浮颗粒物中长链正构烷烃碳优势指数(CPIΣ25-33)分布图Fig.8 The spatial distributions of CPI values of long-chain n-alkanes (CPIΣ25-33) of surface suspended particulate in the Ross Sea-Amundsen Sea in austral summer of 2019-2020
3.4 罗斯海-阿蒙森海表层海水悬浮体中有机地球化学指标空间变化因子分析
由以上研究结果可以发现,罗斯海–阿蒙森冰架边缘海受到南极海–气–冰三重系统作用的影响,表层海水POC组成复杂,单一的有机地球化学来源示踪指标并不能有效解译POC的来源组成,限制了对其空间分布受控机制的认识和理解。为了厘清罗斯海–阿蒙森海表层海水悬浮体中的有机地球化学指标空间变化及来源指示意义,结合海洋环境因子对研究海区海水表层POC的δ13C指标和多种生物标志物含量等有机地球化学参数进行了主成分分析(PCA)。由表3可以看出,主控调查海区表层悬浮体中有机地球化学参数空间变化特征可分为3个特征区:第一特征区(PC1,方差变化比例为32.5%)海水表层温度拥有较高的负载荷、海水表层pCO2拥有较高的正载荷,对应着较低的海水表层温度和较高的海水pCO2水平的南极冰架边缘海离岸浮冰区表层海水基本环境特征(图2A、D)。此外,在第一特征区典型的陆源长链烷基脂类生物标志物占TOC比例呈现较高的正载荷(0.650~0.759),浮游植物源生物标志物占TOC比例也呈现一定的负载荷(-0.352),说明离岸浮冰区由于较低的生产力水平,陆源颗粒有机质在POC中所占比例增强。第二特征区(PC2,方差变化比例为20.6%)海水表层盐度和浮游植物生物标志物在POC中所占比例拥有较高的正载荷(0.789和0.751),显示了盐度较高且浮游植物源有机组分占POC比例较大的海区,对应着南大洋海盆区或者冰架边缘近岸开阔的冰间湖区域(图2B和图5B)。此外,在第二特征区海水表层总POC的δ13C指标拥有较高的负载荷(-0.707),说明罗斯海–阿蒙森海研究区域浮游植物源有机质的δ13C端元值偏负,当浮游植物源有机质对POC的贡献增加时,海水表层POC的δ13C值偏低,例如苏兹伯格冰架边缘近岸海域(图5B)。这与南极优势浮游植物棕囊藻拥有较低的δ13C端元值和南极周边海区浮游植物合成有机质呈现较强的碳同位素分馏的观测结论一致[34,41,55]。第三特征区(PC3,16.5%)海水表层悬浮体中胆甾醇和陆源生物标志物(尤其是n-C26,28,30脂肪酸)在POC中所占比例拥有较高的正载荷(0.894和0.626),显示了动物源和陆源有机组分占POC较大的海区,对应着罗斯海–阿蒙森海生产力较高的冰架边缘近岸海区(图6B和图7D)。值得注意的是,海水表层总POC的δ13C指标和浮游植物生物标志物/POC也拥有一定的正载荷(0.519和0.375),说明罗斯海–阿蒙森海研究区动物源有机质拥有相对较高的δ13C端元值,当高生产力海区动物源有机质对POC的贡献增加时(图6B),海水表层POC的δ13C值会偏高,例如罗斯冰架和盖茨冰架边缘近岸海域(图4B)。
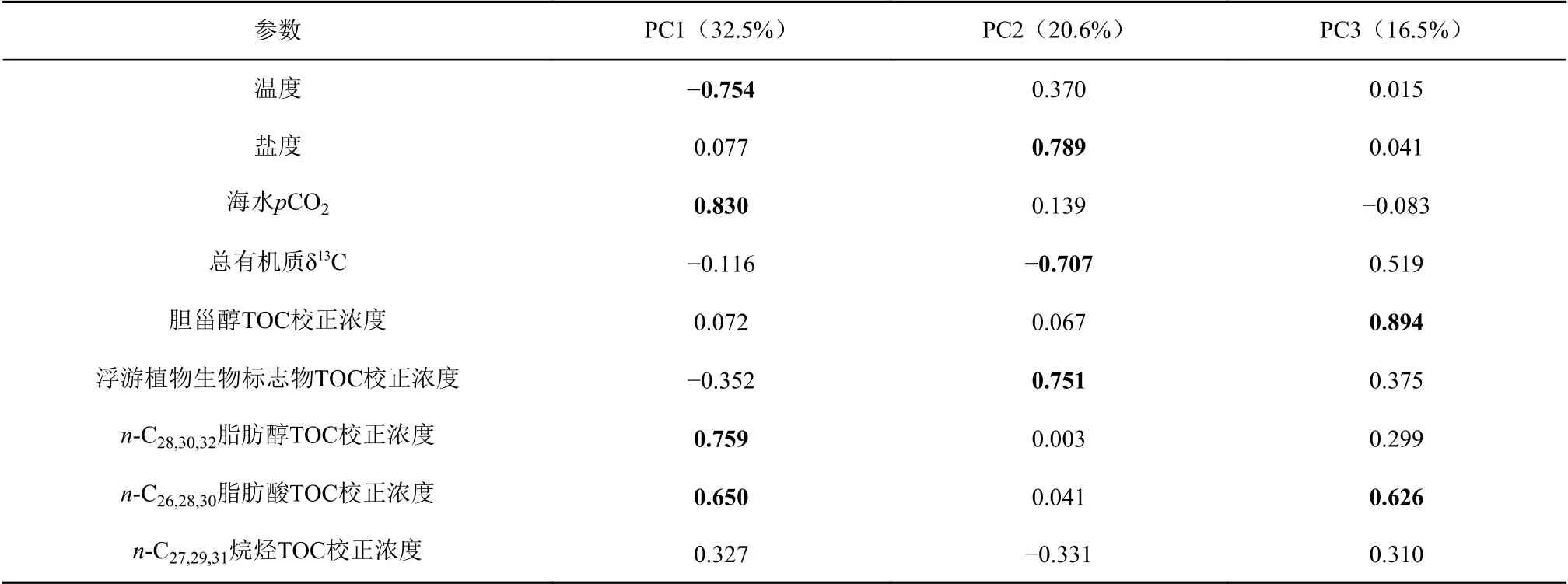
表 3 罗斯海-阿蒙森海研究区2019—2020年夏季表层海水多参数空间变化主成分因子分析Table 3 Principal component analysis of multiple parameters of surface seawater in the Ross Sea-Amundsen Sea in austral summer of 2019-2020 and the loadings of the proxies on factors 1-3
4 结论
(1) 2019—2020年夏季罗斯海–阿蒙森海海水表层悬浮体调查结果显示,表层POC总有机质参数受南极独特的海–气–冰三重系统作用影响,其来源和空间分布特征复杂。利用来源典型性的生物标志物指标发现该海区海水表层POC来源至少包括浮游植物源、动物源和南极大陆碎屑源。来源典型性生物标志物浓度空间分布趋势受物源贡献强弱、陆架水形成和陆源碎屑冲淡效应的影响。浮游植物源、动物源和陆源生物标志物的浓度水平高值区均出现在罗斯海–阿蒙森海冰架边缘的近岸高生产力海区,近岸高陆源物质贡献是高生产力的重要营养供给。陆源长链正构烷烃指标显示陆源颗粒有机质以低有机碳含量的大陆岩性有机质贡献为主,表现为研究区域海水表层颗粒物中陆源正构烷烃的CPIΣ25-33值呈现成熟的岩性有机质端元信号(≈1)。
(2)罗斯海–阿蒙森海有机地球化学指标的空间变化特征按照海区环境特征和来源特性可以分为三大类,以陆源有机质相对贡献为主的离岸浮冰区,对应高的陆源生物标志物有机碳校正浓度,δ13C呈现偏负的陆源有机质端元特征(约-28‰);以浮游植物源有机质相对贡献为主的冰架边缘和南大洋低生产力海区,对应高的浮游植物源生物标志物有机碳校正浓度,δ13C呈现南极典型的浮游植物有机质端元特征(约-29.6‰~-31.1‰);以动物源有机质相对贡献为主的冰架边缘近岸海区,对应高的动物源生物标志物有机碳校正浓度,δ13C呈现偏正的高等生物有机体端元特征(> -25.2‰)。可见,单一的有机地球化学来源示踪指标并不能有效区分研究海区海水表层POC的来源组成,本文中运用的多参数指标解译有助于我们示踪和区分复杂的南极冰架边缘海有机碳来源、组成及迁移转化规律。
致谢:衷心感谢参加中国第36次南极科学考察的全体人员在考察期间给予的大力协助,感谢自然资源部第三海洋研究所蓝艺君和柏龙军实验员协助进行样品预处理。
