防栓胶囊含药血清体外诱导骨髓间充质干细胞移植对心肌缺血再灌注损伤模型大鼠血管新生的影响
2022-08-15刘晓丹严思敏胡安康李尚洪王忠良
赵 昆,卢 磊,刘晓丹,严思敏,胡安康,李尚洪,王忠良
(1.南京中医药大学研究生院,江苏 南京 210029;2.南京中医药大学附属徐州市中医院,江苏 徐州221001;3.南京鼓楼医院,江苏 南京 210000;4.徐州医科大学,江苏 徐州 221000)
心肌缺血后再灌注损伤(ischemia reperfusion injury,IRI)指冠状动脉部分或完全急性阻塞后,在一定时间内重新获得再通时,缺血心肌虽然得以恢复正常灌注,但其组织损伤反而呈进行性加重的病理过程。IRI 可通过氧化应激、炎症等反应,引起心肌细胞凋亡、顿抑、坏死,从而减少心肌细胞存活数量,最终导致再灌注不良[1]。血管新生是保护心肌免除IRI 的机制之一,研究证实,骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)能在特定环境下分化为血管内皮细胞,促进心肌血管新生[2],从而减轻患者的临床症状和体征[3-4]。
防栓胶囊为南京中医药大学附属徐州市中医院院内制剂,由制首乌、槲寄生、制大黄、水蛭、石菖蒲、全蝎、川芎等组成。前期研究发现,防栓胶囊能减轻冠心病患者心脏血管内皮损伤,预防经皮冠状动脉支架植入术后再狭窄[5]。本文通过体外实验研究防栓胶囊含药血清体外诱导骨髓间充质干细胞(BMSCs)移植对心肌缺血再灌注损伤(IRI)血管新生的作用,以期进一步明确该制剂在改善IRI血管新生的机制。
1 实验材料
1.1 动物 BMSCs 取材动物:健康雄性SPF 级5 周龄SD 大鼠20只,体质量(100±10.5)g;含药血清制备、IRI模型及给药动物:健康雄性SPF 级8 周龄SD 大鼠112只,体质量(230±20.1)g;由北京维通利华实验动物技术有限公司提供,合格证号:SYXK(京)2017-0033。动物饲养条件:温度22~25 ℃,湿度(55±5)%,常规喂养。实验全程符合动物伦理学要求。
1.2 主要试剂 胎牛血清(批号:NWG0445,Hyclone公司);预染蛋白Marker(货号:SM0441,Fermentas 公司);PMSF(货号:10837091001,Roche 公司);蛋白裂解 液(RIPA)、1.5 mol/L Tris HCl(pH 6.8)、1.5 mol/LTris HCl(pH 8.8),均为碧云天生物技术研究所产品;ECL 发光液(货号:32132,Thermo Fisher Scientific 公司);Trizol(货号:9108-1,Takara公司);焦碳酸二乙酯(DEPC,货号:E174,Amresco 公司);PCR 引物均由生工生物工程(上海)股份有限公司合成;Anti-VEGF(血管内皮生长因子)抗体购自Affinity Biosciences 公司,Anti-Ang-1(血管生成素-1 抗体)购自Abbexa 公司,Anti-PDGFB(血小板衍生生长因子B 抗体)、Anti-GAPDH(3-磷酸甘油醛脱氢酶抗体)、Anti-CD34、Anti-CD45、Anti-CD90、Anti-Ⅷ(人凝血因子Ⅷ抗体)购自Abcam公司。
1.3 药物 防栓胶囊由南京中医药大学附属徐州市中医院制剂室制备,批准文号:苏药制字Z04002019;规格:每粒0.25 g;批号:XZY201804011127。
2 方 法
2.1 大鼠BMSCs 的分离 以颈椎脱臼法处死5 周龄SD 大鼠20 只,浸泡在75%乙醇中10~15 min,无菌操作下取出胫骨和股骨,并暴露骨髓腔,抽取DMEM 培养液反复冲洗骨髓腔,将冲洗液收集于离心管中,1∶1缓慢加入Percoll 液中,离心10 min,去上清,用完全培养基重悬细胞,反复吹打,制备单细胞悬液,以每毫升1×106个密度接种于培养瓶中,每瓶细胞悬液5 ml;置于5%的CO2培养箱中37 ℃下常规培养,48 h后换液。
2.2 体外培养大鼠BMSCs 及鉴定 传代培养BMSCs,将传代细胞依次标记为P1、P2、P3、P4。P3 代细胞生长至80%~90%融合时,收集细胞,分别使用500 μl PBS制备4管单细胞悬液(包括3个检测抗体组和1 个阴性对照组),按分组向流式管中加入CD34 抗体、CD45 抗体、CD90 抗体各10 μl,阴性对照组加入等量PBS。检测细胞表面抗原表达,以CD90 阳性率高于95%和CD34、CD45 阳性率低于5%为高纯度的BMSCs标准。
2.3 含药血清及空白血清的制备 取8 周龄SD 大鼠16 只,一周适应期后随机抽取8 只制备含药血清,另8只制备空白血清。含药血清的制备:每只大鼠灌服中药复方防栓胶囊[剂量为5.94 g/(kg·d)],每天2 次,每次2 ml,连续3 d。末次给药1 h后常规麻醉,腹主动脉处无菌采血,分离含药血清,混合同组血清,于56 ℃水浴中灭活30 min,再以0.22 μm 微孔滤膜过滤除菌,分装,-20 ℃冰箱中备存。空白血清的制备:大鼠灌服等量生理盐水,每天2次,连续3 d,同含药血清制备方法处理制备空白血清,备存。
2.4 BMSCs 的体外诱导 将生长状态良好的P5 代BMSCs 分别移至培养瓶中培养,贴壁并见到50%~60%融合后,分别加入空白血清及防栓胶囊含药血清,以20%为其体积终浓度,均诱导分化72 h,培养中各换液1次。
2.5 IRI 大鼠模型的建立 取健康雄性SPF 级8 周龄SD 大鼠,使用10%水合氯醛(3 ml/kg)麻醉大鼠后,行气管切开术,并插管接入小动物呼吸机,设定呼吸频率为60次/分钟,呼吸比为1.5∶1,潮气量为100 ml。待呼吸稳定后,沿胸骨左缘切开皮肤,分离肌肉,剪断3~4肋骨,将肺动脉圆锥和左心耳间与左冠状动脉伴行的冠状静脉暴露于视野下,予以结扎。用3/0 号带线缝合针于左心耳根部1~2 mm 处结扎左冠状动脉,结扎线下置双股2 号线做松解用。阻断左冠状动脉30 min,再灌注90 min。造模成功标准:以心电图提示心率失常,QRS 波群增高、增宽,ST 段、T 波进行性抬高为大鼠心肌缺血的表现。在结扎大鼠冠状动脉左前降支即刻可出现短暂的R 波异常增高,心律失常多出现在结扎后5~10 min。结扎30 min 后剪断结扎线,让冠状动脉恢复血液流通。冠状动脉再通表现为:再灌注15 min 内心电图表现为ST 段和T 波快速回落大于50%,15~20 min 后出现Q 波或原有Q波加深。再灌注持续进行时,Q 波也不断加深、加宽。再灌注早期,可见心率失常,以室性心动过速和心室颤动为主。
2.6 动物分组与干预 取8周龄大鼠96只,随机分为假手术组、IRI 模型组、空白血清诱导组和含药血清诱导组,每组各24 只。假手术组仅分离而不结扎,余3组均建立IRI 大鼠模型。取DMEM 培养液100 μl 2份,用微量注射器分3 个位点(3 点钟、6 点钟、9 点钟方位)分别注射到假手术组、IRI 模型组大鼠梗死部位边缘的心肌组织中;取空白血清体外诱导的BMSCs 细胞悬液、含药血清体外诱导的BMSCs细胞悬液各100 μl,用微量注射器分3 个位点(3 点钟、6 点钟、9 点钟方位)分别注射到空白血清诱导组、含药血清诱导组。移植后常规关闭胸腔,待大鼠可自主呼吸后,拔除气管插管,停用呼吸机,逐层缝合,创面消毒,并注射青霉素防止感染,置于单笼喂养。于移植后3 d、7 d、14 d进行相应指标的检测。
2.7 Western blot 检测各组心肌组织中VEGF、Ang-1、PDGFB 的表达 采用添加苯甲基磺酰氟(PMSF)的RIPA 裂解液裂解心肌组织后离心5 min,抽提得到组织蛋白,并通过SDS-PAGE 分离目标蛋白。将蛋白转移到硝酸纤维素膜上,将膜上的残余液体用TBST 缓冲液洗干净,并加入用TBST 缓冲液稀释至适宜浓度的一抗,袋口密封,4 ℃下过夜。剪开自封袋,用TBST缓冲液洗膜3 次。加入适量适宜浓度的二抗,密封袋口,室温下孵育1 h。然后打开密封袋,用TBST 洗膜3次。将化学发光试剂A 液与B 液等体积混合,用Tanon6600发光成像工作站进行图像采集。
2.8 Real-time PCR 检测各组心肌组织中VEGF、Ang-1、过氧化物酶体增殖物激活受体α(PPAR-α)及肾上腺素能受体β3(ADRB3)的mRNA 含量 用预冷PBS 洗涤心脏组织2 次,在液氮下把组织样品充分研磨成粉末,装入有Trizol 的EP 管中剧烈振荡,静置10 min,离心15 min,取上清加等量异丙醇后剧烈振荡,-20 ℃下静置30 min,让RNA 沉淀,再离心10 min,去上清。加入1 ml 75%乙醇洗涤,离心5 min,弃上清,自然干燥5~10 min。用DEPC 水10 μl 溶解RNA,吹打混匀,得到总RNA 溶液,取2 μl 样品,使用Nanodrop2000 测定microRNA 的 浓 度 和 纯 度。cDNA 合 成采用20 μl 体系,25 ℃反应5 min,42 ℃反应30 min,85 ℃反应5 min,获得cDNA,-70 ℃保存。实时定量PCR 采用20 μl 体系,于8 联管内加入预混合的试剂,密封,置于仪器内,调整反应参数,进行扩增,结果以2-ΔΔCt进行计算,所用引物见表1。

表1 Real-time PCR 引物序列
2.9 免疫组化试验(IHC)检测各组心肌边缘区Ⅷ因子和CD34的表达 将石蜡切片置于电热恒温干燥箱中,60 ℃烘烤3 h;随后用乙醇水化、蒸馏水洗,抗原修复;之后滴加3%H2O2灭活内源性酶。每张切片滴加正常山羊免疫血清封闭,滴加第一抗体(1∶100稀释),4 ℃冰箱中过夜。取出并达到室温后,给每张切片分别滴加聚合物增强剂(试剂A)和酶标抗鼠兔聚合物(试剂B),DAB显色,苏木素复染,蒸馏水充分水洗终止显色。切片脱水干燥并封片后用相差显微镜在200倍视野下拍照。阳性表达为棕黄色显色,且强度明显高于背景无特异性染色的部位,细胞核为浅蓝色显色。
2.10 统计学分析 计量数据以均数±标准差(±s)表示,多组间差异采用GraphPad Prism 中Tukey-Kramer HSD post test进行分析,P<0.05认为差异有统计学意义。
3 结 果
3.1 BMSCs 生长的形态学特征 于倒置相差显微镜中观察到刚接种的原代细胞为圆形,悬浮于培养液中,24 h 后可见大部分已贴壁。如图1 所示,2 d 后换液,除去悬浮细胞,换液后可见部分细胞贴壁,多为圆形;4 d 后细胞出现不同形态,后伸出2~3 个小突起,呈三角形、短梭形、多边形改变,有的细胞两极端有细丝,细胞位置较分散,核较大、位于细胞中央或边缘;培养6 d 后细胞呈梭形的成纤维细胞样,部分呈宽大扁平的多边形,并以克隆集落方式快速增殖;原代细胞培养10 d 时,细胞密集排列,融合成单层。于细胞融合达到80%~90%后,予以首次传代,可见传代细胞快速生长,24 h内完全贴壁,6 d可见铺满底部;细胞融合再次达到80%~90%后,第二次传代培养,第3代时可见细胞形态呈较均匀一致的平行样、纺锤形或漩涡样生长。

图1 BMSCs生长的形态学特征(×200)
3.2 BMSCs 表面抗原的鉴定 用流式细胞仪检查内皮细胞表面抗原CD90、CD45、CD34 时,可见CD90 阳性表达率为94.2%(C),CD45 阳性表达率为0.7%(B),CD34阳性表达率为0.4%(A)。表明细胞均一性较好,纯度较高,符合实验要求。见图2。

图2 大鼠BMSCs表面抗原CD34、CD45和CD90的表达
3.3 各组心肌边缘区Ⅷ因子的表达情况 见图3、表2。再灌注后,与假手术组同时相点比较,模型组、空白血清诱导组及含药血清诱导组中心肌边缘区Ⅷ因子的表达均有不同程度的升高(P<0.05),且含药血清诱导组和空白血清诱导组明显高于模型组;再灌注3 d 时,Ⅷ因子在含药血清诱导组和空白血清诱导组的心肌组织中无显著性差异,而再灌注7 d、14 d后,含药血清诱导组中Ⅷ因子的含量明显高于空白血清诱导组(P<0.05)。

图3 各组心肌边缘区Ⅷ因子的表达
表2 各组心肌边缘区Ⅷ因子的表达比较 (±s)

表2 各组心肌边缘区Ⅷ因子的表达比较 (±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与空白血清诱导组比较,③P<0.05;下同
组别假手术组模型组空白血清诱导组含药血清诱导组n8 8 8 8 3 d 395.56±56.23 512.72±60.22①744.28±63.32①②775.03±78.26①②7 d 415.53±77.12 602.65±68.42①790.65±49.03①②924.37±43.49①②③14 d 402.29±51.01 629.35±95.18①826.98±53.67①②1 043.87±64.35①②③
3.4 各组心肌边缘区CD34的表达情况 见图4、表3。再灌注后,与假手术组同时相点比较,模型组、空白血清诱导组及含药血清诱导组中心肌边缘区CD34 的表达均有不同程度的升高(P<0.05),且含药血清诱导组和空白血清诱导组明显高于模型组;再灌注3 d 时,CD34 在含药血清诱导组和空白血清诱导组的心肌组织中无显著性差异,而再灌注7 d、14 d 后,含药血清诱导组中的CD34 含量明显高于空白血清诱导组(P<0.05)。再灌注14 d 时CD34 在含药血清诱导组及空白血清诱导组中的表达均达到峰值。

图4 各组心肌边缘区CD34的表达
表3 各组心肌边缘区CD34的表达情况 (±s)

表3 各组心肌边缘区CD34的表达情况 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n 8 8 8 8 3 d 376.54±63.87 539.62±52.67①680.42±56.75①②676.40±78.32①②7 d 390.63±82.59 572.95±55.31①830.08±43.41①②854.08±52.85①②③14 d 390.39±58.96 617.38±80.19①859.93±43.63①②919.46±114.46①②③
3.5 各组心肌组织中VEGF、Ang-1、PDGFB 的表达情况 见图5、表4、表5、表6。再灌注后,与假手术组同时相点比较,模型组、空白血清诱导组以及含药血清诱导组的心肌组织中VEGF、Ang-1、PDGFB 的表达均有不同程度的升高(P<0.05);再灌注3 d 时,空白血清诱导组与模型组中VEGF 的表达比较无显著性差异,其余各个不同时相点含药血清诱导组和空白血清诱导组中VEGF、Ang-1、PDGFB 的表达均明显高于模型组;VEGF、Ang-1、PDGFB 的表达在含药血清诱导组的心肌组织随着灌胃时间的延长而逐步升高,14 d 时达到峰值,且各个时相点VEGF、Ang-1、PDGFB 的表达均高于空白血清诱导组(P<0.05)。

图5 各组心肌组织中VEGF、Ang-1、PDGFB的表达
表5 各组心肌组织中Ang-1的表达情况 (±s)
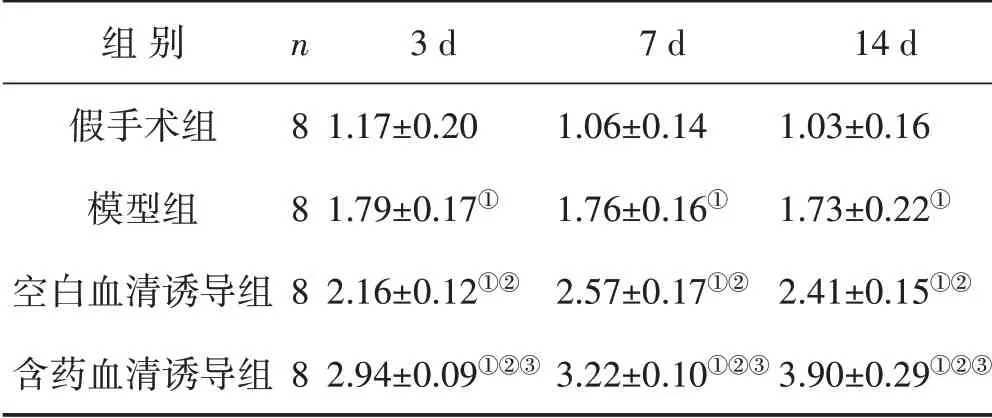
表5 各组心肌组织中Ang-1的表达情况 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n 8 8 8 8 3 d 1.17±0.20 1.79±0.17①2.16±0.12①②2.94±0.09①②③7 d 1.06±0.14 1.76±0.16①2.57±0.17①②3.22±0.10①②③14 d 1.03±0.16 1.73±0.22①2.41±0.15①②3.90±0.29①②③
表4 各组心肌组织中VEGF的表达情况 (±s)

表4 各组心肌组织中VEGF的表达情况 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n 8 8 8 8 3 d 0.95±0.18 1.85±0.17①1.93±0.09①2.87±0.13①②③7 d 0.97±0.18 1.86±0.18①2.31±0.14①②3.06±0.14①②③14 d 0.92±0.05 1.80±0.18①2.50±0.14①②3.99±0.27①②③
表6 各组心肌组织中PDGFB的表达情况 (±s)

表6 各组心肌组织中PDGFB的表达情况 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n8 8 8 8 3 d 0.87±0.18 1.78±0.19①1.96±0.12①②2.28±0.17①②③7 d 0.90±0.14 1.50±0.19①1.86±0.10①②3.05±0.15①②③14 d 0.88±0.13 1.34±0.12①1.89±0.10①②3.99±0.36①②③
3.6 各 组 心 肌 组 织 中VEGF、Ang-1、PPAR-α 及ADRB3 的mRNA 含量的表达情况 见表7 至表10。再灌注后,与假手术组同时相点比较,模型组、空白血清诱导组以及含药血清诱导组的心肌组织中VEGF、Ang-1、PPAR-α 及ADRB3 的mRNA 含量均有不同程度的增加(P<0.05);再灌注3 d 时,空白血清诱导组与模 型 组 中VEGF、Ang-1、PPAR-α 以 及ADRB3 的mRNA 含量比较无显著性差异,其余各个不同时相点含药血清诱导组和空白血清诱导组中VEGF、Ang-1、PPAR-α 以及ADRB3 的mRNA 含量均明显高于模型组;VEGF、Ang-1、PPAR-α以及ADRB3的mRNA 含量在含药血清诱导组的心肌组织中随着灌胃时间的延长而逐步升高,14 d 时达到峰值,且各个时相点VEGF、Ang-1、PPAR-α 以及ADRB3 的mRNA 含量均高于空白血清诱导组(P<0.05)。
表7 各组心肌组织中VEGF mRNA的含量表达 (±s)

表7 各组心肌组织中VEGF mRNA的含量表达 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n 8 8 8 8 3 d 0.85±0.03 1.61±0.06①1.64±0.08①2.84±0.21①②③7 d 0.88±0.09 1.77±0.07①2.65±0.13①②5.07±0.20①②③14 d 0.84±0.09 1.93±0.07①2.73±0.12①②10.08±0.25①②③
表8 各组心肌组织中Ang-1 mRNA的含量表达 (±s)

表8 各组心肌组织中Ang-1 mRNA的含量表达 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n 8 8 8 8 3 d 0.97±0.05 1.81±0.06①1.89±0.06①2.93±0.05①②③7 d 1.13±0.04 1.96±0.06①2.21±0.11①②3.48±0.15①②③14 d 1.10±0.04 1.97±0.05①2.49±0.08①②4.49±0.07①②③
表9 各组心肌组织中PPAR-α mRNA的含量表达 (±s)

表9 各组心肌组织中PPAR-α mRNA的含量表达 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n 8 8 8 8 3 d 0.87±0.04 1.57±0.08①1.60±0.07①1.99±0.03①②③7 d 0.90±0.02 1.47±0.06①2.09±0.03①②3.08±0.14①②③14 d 0.82±0.01 1.58±0.05①2.40±0.07①②4.86±0.06①②③
表10 各组心肌组织中ADRB3 mRNA的含量表达 (±s)

表10 各组心肌组织中ADRB3 mRNA的含量表达 (±s)
组别假手术组模型组空白血清诱导组含药血清诱导组n 8 8 8 8 3 d 0.88±0.04 1.43±0.07①1.56±0.21①1.92±0.10①②③7 d 0.91±0.03 1.53±0.02①1.94±0.43①②2.60±0.10①②③14 d 0.99±0.04 1.52±0.01①2.17±0.26①②3.92±0.02①②③
4 讨 论
缺血发生时,腺苷酸环化酶活性和细胞内cAMP水平降低,从而打破内皮细胞屏障,增加血管通透性和渗漏,减少线粒体ATP 的产生[6]。再灌注时,线粒体产生的活性氧簇ROS 增加,ATP 生成进一步减少,线粒体通透性转移水平提高,从而进一步加重内皮功能障碍,DNA 受到损伤[7-8]。长期的I/R 损伤会引起纤维化瘢痕组织的生成,以及受损部位的结构改变和功能降低[9]。
BMSCs 是在标准培养条件下能够保持可塑性的多能细胞,其内皮细胞表面抗原CD90 表达水平较高,CD45、CD34 表达相对较低[10]。本文观察结果与此一致,培养得到的内皮细胞表面抗原CD90 阳性表达率为94.2%,CD45阳性表达率为0.7%,CD34阳性表达率为0.4%,说明本研究中BMSCs 贴壁生长良好,纯度较高。
在血管新生过程中,CD34 和Ⅷ因子是内皮细胞主要的表面标志物[11],其机制可能与CD34 细胞表面蛋白的分化、细胞迁移和黏附作用相关,CD34 基因敲除老鼠最明显的功能缺陷之一是HSC 的严重迁徙障碍,从而降低骨髓的再增殖能力[12];而与Ⅷ因子相对应的抗原位于内皮细胞的Weibel-palada小体上,可以较好地显示观察目标中的小动脉、小静脉和毛细血管,因此本实验选择此两种因子来判断IRI 模型大鼠梗死心肌边缘区的恢复情况。此外,BMSCs 能够促进并分泌功能性Ⅷ蛋白因子[13]。本研究结果显示:7 d 后含药血清诱导组中CD34 和Ⅷ因子的含量明显高于空白血清诱导组(P<0.05),14 d时CD34和Ⅷ因子在含药血清诱导组以及空白血清诱导组中的表达均达到峰值。由此可知,防栓胶囊能够加强BMSCs 促进缺血心肌新生血管的生成,改善缺血区的血液灌注,从而发挥保护缺血心肌的作用。
BMSCs具有免疫抑制和促血管生成的作用[14],能够在缺血组织中产生血管生成因子,从而促进IRI 组织的恢复[15]。本研究发现,再灌注后,同时相点的模型组、空白血清诱导组以及含药血清诱导组与假手术组相比,心肌组织中VEGF、Ang-1、PDGFB 的表达均有不同程度的升高(P<0.05),再灌注3 d 时,空白血清诱导组和模型组中VEGF 的表达无显著性差异,其余各个不同时相点含药血清诱导组和空白血清诱导组中VEGF、Ang-1、PDGFB 的表达均明显高于模型组;VEGF、Ang-1、PDGFB 的表达在含药血清诱导组的心肌组织随着时间的延长而逐步升高,于14 d 时达到峰值,且各个时相点VEGF、Ang-1、PDGFB 的表达均高于空白血清诱导组。VEGF 属于酪氨酸激酶受体,其受体只存在于内皮细胞中,在血管新生过程中具有重要作用[16]。Ang-1 和其受体Tie1、Tie2 在血管新生过程中具有重要调控作用,可促进血管稳定性和抑制纤维化,与VEGF 发挥协同作用,能够诱导血管出芽生长,使其形成血管,并且外源性使用或局部使用Ang-1可减少心肌梗死面积,促进新生血管,提高组织灌注,改善心脏功能,为血管形成末期特异标志[17]。PDGFB具有趋化、缩血管、促分裂、激活磷酸酰脂酶和前列腺素代谢等作用,激活创伤部位的免疫系统,诱导受损的内皮细胞分裂增殖,促进血管形成和再生。再灌注损伤发生时,VEGF、Ang-1、PDGFB 被激活,对损伤的内皮细胞起到保护作用,BMSCs 能够进一步提高VEGF、Ang-1、PDGFB 的表达,从而进一步修复受损的内皮和促进血管的新生。此外,本研究中发现VEGF、Ang-1、PPAR-α 以及ADRB3 的mRNA 含量在含药血清诱导组的心肌组织中随着灌胃时间的延长而逐步升高,14 d 时达到峰值。ADRB3 作为G 蛋白耦联受体超家族成员之一,能够通过交感神经动员MSCs 迁移和分化[18]。PPAR-α 作为核超家族的一类依赖配体的转录因子,能够通过ERK1/2 信号通路参与抑制心肌重塑[19],通过抑制AKT/mTOR,间接抑制VEGF的释放,因此PPAR-α可间接刺激VEGF的释放并最终导致血管新生[20]。
本研究发现,防栓胶囊含药血清体外诱导BMSCs移植能够上调BMSCs 细胞表面抗原CD34 表达,从而促进BMSCs 分化、增殖;并通过自分泌或旁分泌的方式分泌血管生长相关因子VEGF、Ang-1、PDGFB,上调VEGF、Ang-1、PPAR-α 以及ADRB3 的mRNA 表达,促进血管新生,从而保护IRI造成的心肌损伤。
