患病细鳞鲑栖鱼肉杆菌的分离鉴定及药敏分析
2022-08-15刘宁杜迎春何亚鹏
文/刘宁 杜迎春 何亚鹏
细鳞鲑()属鲑形目(Salm oniformes)、鲑科(Salm onidae)、细鳞鱼属(),是我国名贵的陆封型冷水性珍稀鱼类,具有重要的生态、科学和社会价值。近年来,由于栖息地破坏、环境污染、过度捕捞等因素的影响,细鳞鲑在我国的分布区域急剧缩小,种群数量锐减,2012年被列为北京市二级保护水生野生动物,2021年被列为国家二级保护野生动物。
栖鱼肉杆菌(),也被称为居鱼肉杆菌、居鱼乳杆菌。Ross和Toth于1974年首次报道从感染“拟肾病”的3龄虹鳟分离到栖鱼肉杆菌,据B.Austin等记述,截至1999年该菌引起的鱼病曾仅发生在欧洲和北美,鉴于该菌引发鱼病的报道极少,尚不清楚其何时传入我国。本研究从患病死亡的人工养殖细鳞鲑体内分离得到1优势菌株QY-3,经生化鉴定、16S rDNA序列分析确定为栖鱼肉杆菌,用该菌感染健康细鳞鲑能够引起发病、死亡,且能够从病鱼体内再次分离得到该菌,确定了该菌的致病性。由该菌引起的疾病造成人工养殖细鳞鲑一定规模的死亡,给该物种的保护和恢复带来了不利影响。
一、材料与方法
(一)实验材料
1.实验用鱼
自然患病细鳞鲑10尾,健康细鳞鲑24尾,均取自北京市水生野生动植物救护中心。
2.实验试剂与设备
胰蛋白胨大豆琼脂(TSA)、营养肉汤培养基、全自动细菌鉴定/药敏分析仪、标准药敏试纸、DNA Marker DL2000、2×Taq PCR Master Mix和琼脂糖凝胶等。
3.引物
利用oligo6软件设计细菌16S rDNA引物27f和1492r,由北京华大科技有限公司合成,引物序列见表1。
高校作为行业专门人才培养的主体,必须积极应对就业环境和国际形势所发生的变化,在人才培养模式上要注重理论教学与实践能力培养相结合的人才培养模式,积极探索适合社会企业需求的人才培养新机制。

表1 16S rDNA基因PCR扩增引物序列
(二)实验方法
1.患病鱼体的剖检
无菌条件下按照从外到内的顺序,对具有典型病症的细鳞鲑进行临床检查,检查体表、鳃、内脏等有无病变。
2.细菌的分离、纯化
无菌条件下,用接种环蘸取病变部位溢出液,主要集中在鳃、肝、脾等器官组织,采用划线法接种于TSA平板和5%绵羊血平板上,25℃恒温培养18h~24h,观察细菌的生长状况及菌落特征,挑选形态、色泽一致的优势菌落进行纯化,反复纯化2次以获得单菌落,4℃保藏备用。
3.细菌的生化鉴定
4.16S rDNA基因扩增
以分离纯化菌液、阳性对照菌液及阴性对照无菌水作为模板,用50μL反应体系进行PCR扩增,其中引物浓度为10μmol/L,反应体系见表2。PCR反应条件设置为:94℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸45s,共30个循环,最后72℃延伸7min。通过电泳对PCR产物进行检测,并对目的条带进行回收、测序。
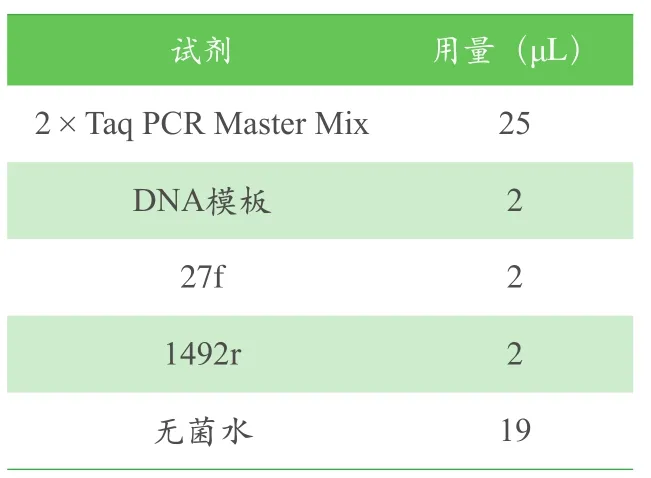
表2 PCR反应体系
5.人工感染实验
选取健康细鳞鲑24尾,分别饲养在实验室2个水循环控温鱼缸内,实验开始前暂养7d,以适应环境。设实验组和对照组,每组细鳞鲑12尾。按照平板计数法制成10CFU/mL的细菌悬液,通过背鳍基部注射方式进行感染,注射剂量为0.2mL,对照组注射0.2mL无菌肉汤。以15d作为实验周期,期间每天观察受试细鳞鲑的活力、摄食、发病症状及死亡情况,并做好相关记录。最后,对感染发病细鳞鲑进行剖检、细菌分离、PCR鉴定,确定分离细菌的致病性。
6.药物敏感性实验
实验选取了26种抗菌药物,根据美国临床标准委员会(NCCLS)推荐的K-B琼脂法进行,将培养24h的菌液均匀涂布于检测平板上,每个平板贴5张纸片,将平板倒置25℃培养24h,测量抑菌圈直径,药敏结果判定标准按照NCCLs手册2005版进行分析。
二、结果
(一)病鱼的临床症状
该病出现在亲鱼和产后的细鳞鲑中,病鱼背部体色变暗近黑色,腹部膨胀,皮肤表面有出血点、脓肿,经剖检皮下肌肉出血,鳃、肝脏、肾脏、脾脏等颜色变浅(见图1)。
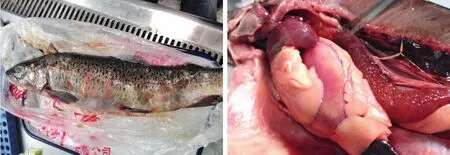
图1 自然患病细鳞鲑的临床症状
(二)菌落的形态特征与理化特性
分离菌株QY-3在TSA培养基上生长良好,25℃培养24h~48h,能形成圆形、边缘整齐、有光泽半透明的菌落,颜色呈微白色至浅米色;在5%绵羊血平板上形成圆形、边缘整齐、奶油色光滑的菌落,与在TSA平板上的基本一致(见图2),经染色为革兰氏弱阳性(着色较浅)。经BD-PhoenixTM100全自动细菌鉴定系统鉴定及对比《常见细菌系统鉴定手册》(见表3)初步鉴定为栖鱼肉杆菌(KC213947.1)。与《常见细菌系统鉴定手册》相比,QY-3菌株仅精氨酸双水解酶、阿拉伯糖、乳糖、木糖、蔗糖的利用上与鉴定手册上的栖鱼肉杆菌标准存在差异,可能与不同分离菌株之间存在差异有关,具体还有待深入研究。
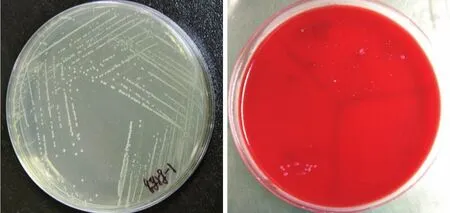
图2 分离菌株QY-3在不同培养基上的菌落形态
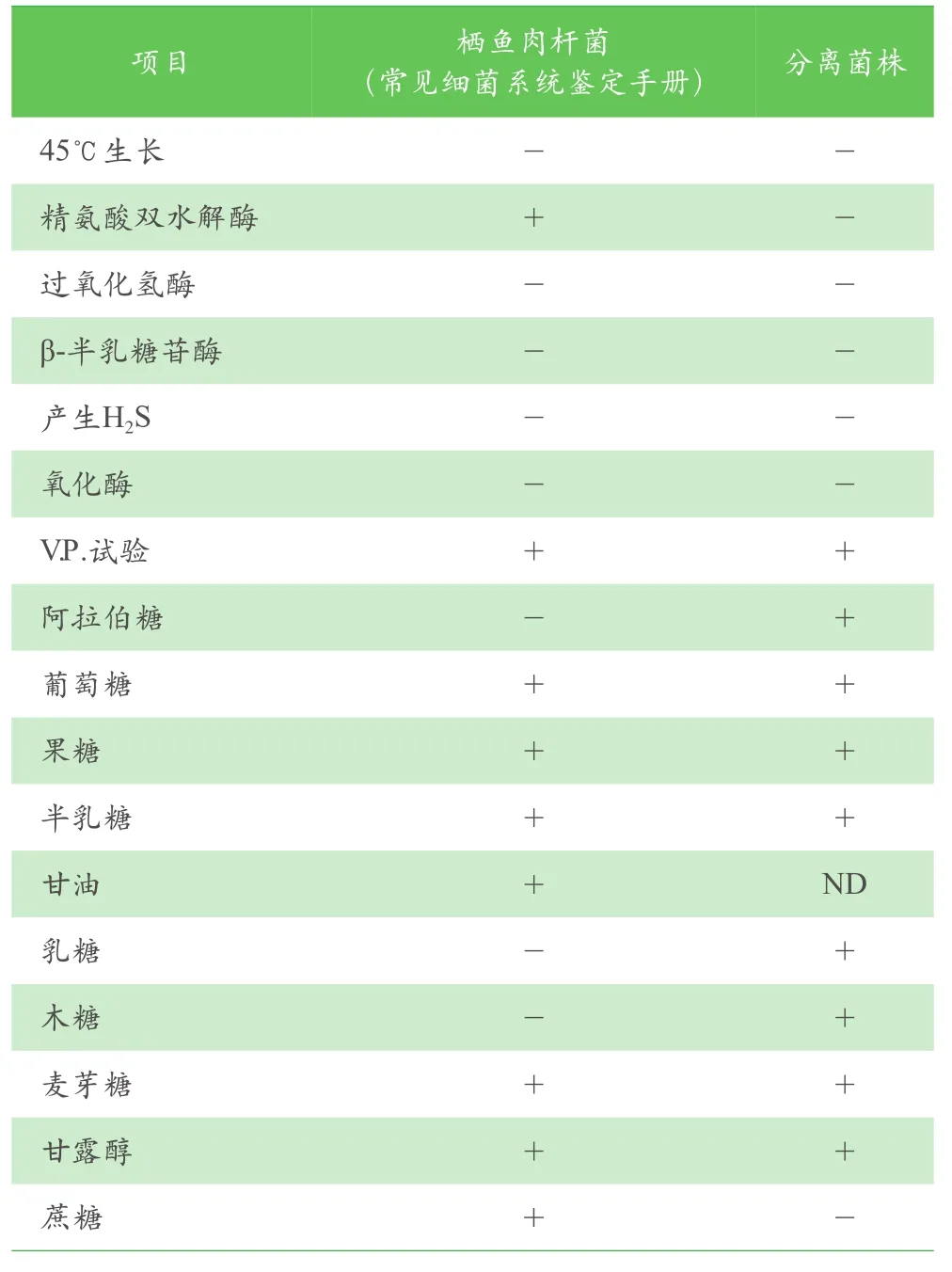
表3 分离菌株QY-3的生理生化鉴定
(三)PCR扩增结果
分离菌株QY-3经16S rDNA基因扩增后的序列条带如图3所示,其条带位置与阳性对照的条带位置一致,在1500bp左右。将QY-3的16S rDNA基因序列递交NCBI进行BLAST比对分析,结果与GenBank database中栖鱼肉杆菌(KC213947.1)具有较高的同源性。这与全自动细菌鉴定系统鉴定的结果一致,即可确定分离菌株QY-3为栖鱼肉杆菌。
(四)人工感染实验结果
患病细鳞鲑精神沉郁,食量减少,病鱼失去平衡,离群独游,常出现阵发性急游;体色变暗,背部皮下出血,严重个体背部脓肿或溃疡,病鱼常用体侧磨蹭池底或池壁,眼球突出。剖检发现腹腔积水,肝脏、肾脏有坏死(见图4),后期实验组12尾细鳞鲑全部感染发病,至15d实验周期结束时仅有2尾存活且呈垂死状态,死亡率极高,详见表4。对具有典型病症的细鳞鲑进行细菌分离、培养及16S rDNA基因扩增,发现分离菌株与已鉴定的QY-3一致。由此,诊断栖鱼肉杆菌()为引起细鳞鲑发病的病原菌。
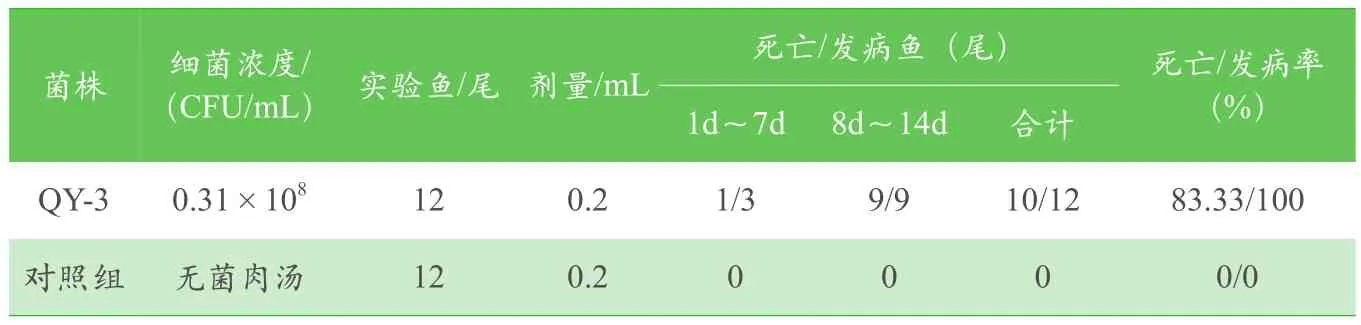
表4 QY-3细鳞鲑人工感染实验
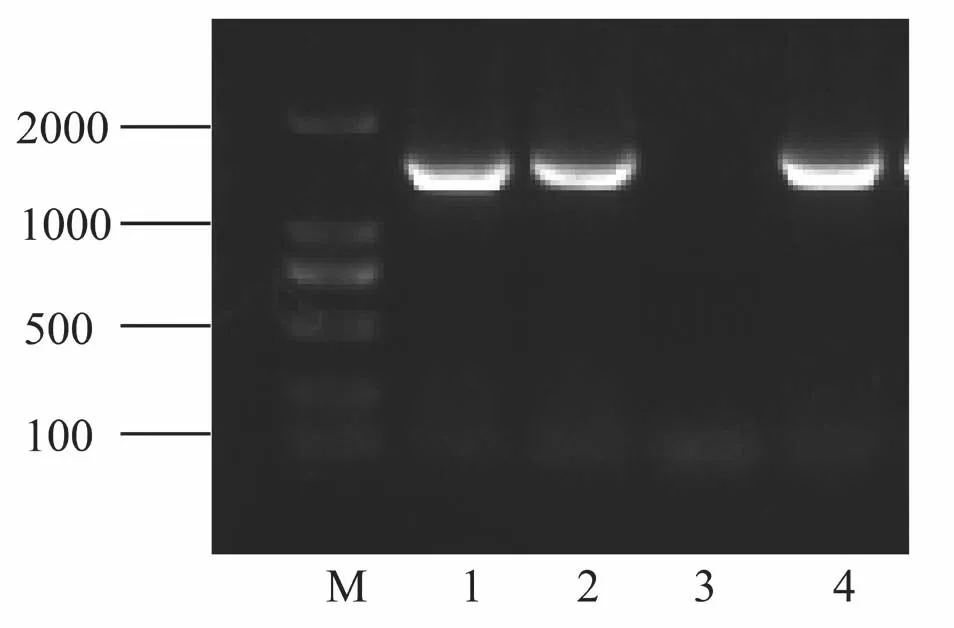
图3分离菌株QY-3 16S rDNA PCR扩增结果

图4 人工感染细鳞鲑的临床症状
(五)药敏实验结果
用26种常用抗菌药物做敏感性实验,结果(见表5)显示,分离菌株QY-3对氨苄西林等10种抗生素敏感;对新霉素和呋喃妥因2种抗生素中度敏感;对羧苄西林等14种药物耐受。
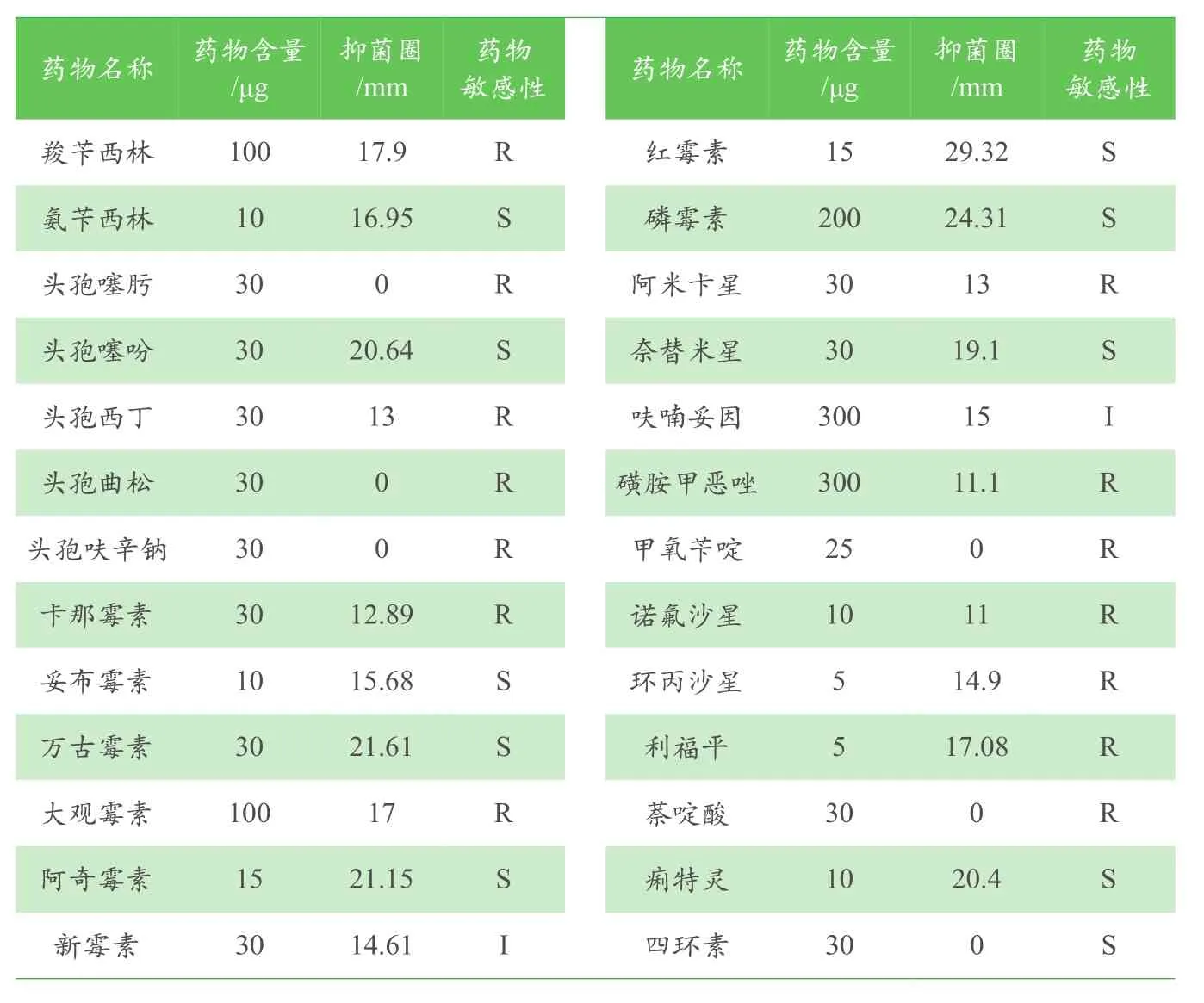
表5 分离菌株QY-3的药物敏感性
(六)组织病理学结果
实验对人工感染发病细鳞鲑的肝脏组织切片进行了观察,如图5所示,肝索结构疏松、紊乱;血管壁破损,内皮细胞脱落坏死;血管内嗜中性粒细胞出现大量凝集。

图5 人工感染患病细鳞鲑的组织病理学
三、讨论
本研究从自然患病的细鳞鲑中分离得到QY-3菌株,经形态学、生理生化和分子生物学鉴定为栖鱼肉杆菌,通过人工感染实验、组织病理学观察进一步证明该菌是引起细鳞鲑发病的致病菌,并且发病症状与文献记载的症状基本一致。通过药物敏感性实验发现该菌对26种抗生素中的14种表现出耐药性,因此,在对感染栖鱼肉杆菌的细鳞鲑用药治疗过程中应注重抗生素药物的选取和用量,避免盲目用药扩大其耐药性。此外,人工感染实验表明,健康细鳞鲑从感染到发病、死亡均要经过一定的时间,在这一时间段内及时采取用药等措施,对治愈疾病以及对保护和恢复该物种资源具有重要意义。
