Mg(BH4)2对典型硝胺炸药热分解性能的影响
2022-08-13汪慧思晏嘉伟李毅恒林励云陶博文
杜 芳,汪慧思,卢 辉,晏嘉伟,李毅恒,林励云,李 磊,陶博文,顾 健
(1. 航天化学动力技术重点实验室,湖北 襄阳 441003;2. 湖北航天化学技术研究所,湖北 襄阳 441003)
0 引言
对于固体推进剂而言,提高能量水平始终是发展的核心。H2燃烧时会释放大量能量[1],将其引入固体推进剂燃烧中,不仅可显著降低燃气的平均分子质量,还可提高固体推进剂的比冲。H2储存在推进剂组分中,可以有效提升固体推进剂的能量水平。
镁基储氢材料的储氢量大,被认为是具有发展前途的一种材料[2]。对于推进剂、温压炸药等含能材料而言,镁基储氢材料释氢温度高,热稳定性好,部分镁基储氢材料储氢量高且燃烧热值高,极具有研究价值。镁基储氢材料在燃烧过程中释放出的氢气可以催化推进剂中氧化剂的燃烧,可改善推进剂的点火性能和燃烧效率,近年来已有学者[3-6]开展了Mg(BH4)2、MgH2、镁基合金等镁基储氢材料在固体推进剂、温压炸药等中的应用研究。Mg(BH4)2理论储氢量为14.9%,热分解温度为315 ℃,燃烧热高达54.0 kJ·g-1,具有储氢密度高、热值高、污染小、安全可靠等优点[7-10],在推进剂的燃烧过程中,Mg(BH4)2可以在高温下释放氢,参加爆轰反应,释放出大量的热和水蒸汽,引发体系中的硼、镁高热值燃烧剂释放能量,因此是理想的推进剂能量提升新材料。
目前,随着推进剂能量的不断提高,硝铵类炸药六硝基六氮杂异伍兹烷(CL-20)、奥克托金(HMX)、黑索今(RDX)等用量也越来越大,对固体推进剂性能的影响越来越大,特别是其热分解特性对固体推进剂能量水平的影响尤为重要。因此,为探索Mg(BH4)2对CL-20、HMX、RDX 的影响,本研究采用差示扫描量热 仪(DSC)对Mg(BH4)2/CL-20、Mg(BH4)2/HMX、Mg(BH4)2/RDX 3 种混合物的热性能进行了研究,并与CL-20、HMX、RDX 分别进行了对比;采用TG-FITR测试了Mg(BH4)2对RDX、HMX、CL-20 分解过程的影响,并对其机理进行了初步探讨。
1 实验部分
1.1 试剂与仪器
Mg(BH4)2,湖 北 航 天 化 学 技 术 研 究 所,自 制;CL-20,工业级,中国兵器工业集团第375 厂;HMX:纯度>99%,中国兵器工业集团第575 厂;RDX:纯度>99%,中国兵器工业集团第575 厂。
1.2 混合物样品制备
以MgH2和三乙胺·硼烷为原材料,采用液相反应法 合 成Mg(BH4)2[11]。将 制 备 的Mg(BH4)2置 于 惰 性溶剂中,超声分散后再将CL-20、HMX、RDX 分别按照质量比1∶1 加入溶液中,继续超声,确保样品的均匀性,抽 滤 烘 干,分 别 得 到 样 品Mg(BH4)2/CL-20、Mg(BH4)2/HMX、Mg(BH4)2/RDX 的混合物。
1.3 性能测试
采用美国TA 公司的SDTQ600 型TG-DSC 热分析仪对硝胺炸药及其与Mg(BH4)2混合物样品热分解特性进行研究。测试条件:样品质量约3 mg,精度0.1 μg,温度范围为室温~500 ℃,升温速率分别为2、5、10、20 ℃·min-1,气氛为氮气。
采用德国耐弛公司和布鲁克公司的TG 209-TENSOR27 型热重-红外联用仪对硝胺炸药及其与Mg(BH4)2混合物的热分解气相产物进行研究。测试条件:样品重约2 mg;氩气作为保护气和吹扫气,总流量为50 mL·min-1;升温速率10 ℃·min-1;红外检测器为MCT型,分辨率4 cm-1。测试温度范围为30~500 ℃。
2 结果与讨论
2.1 热分解特性研究
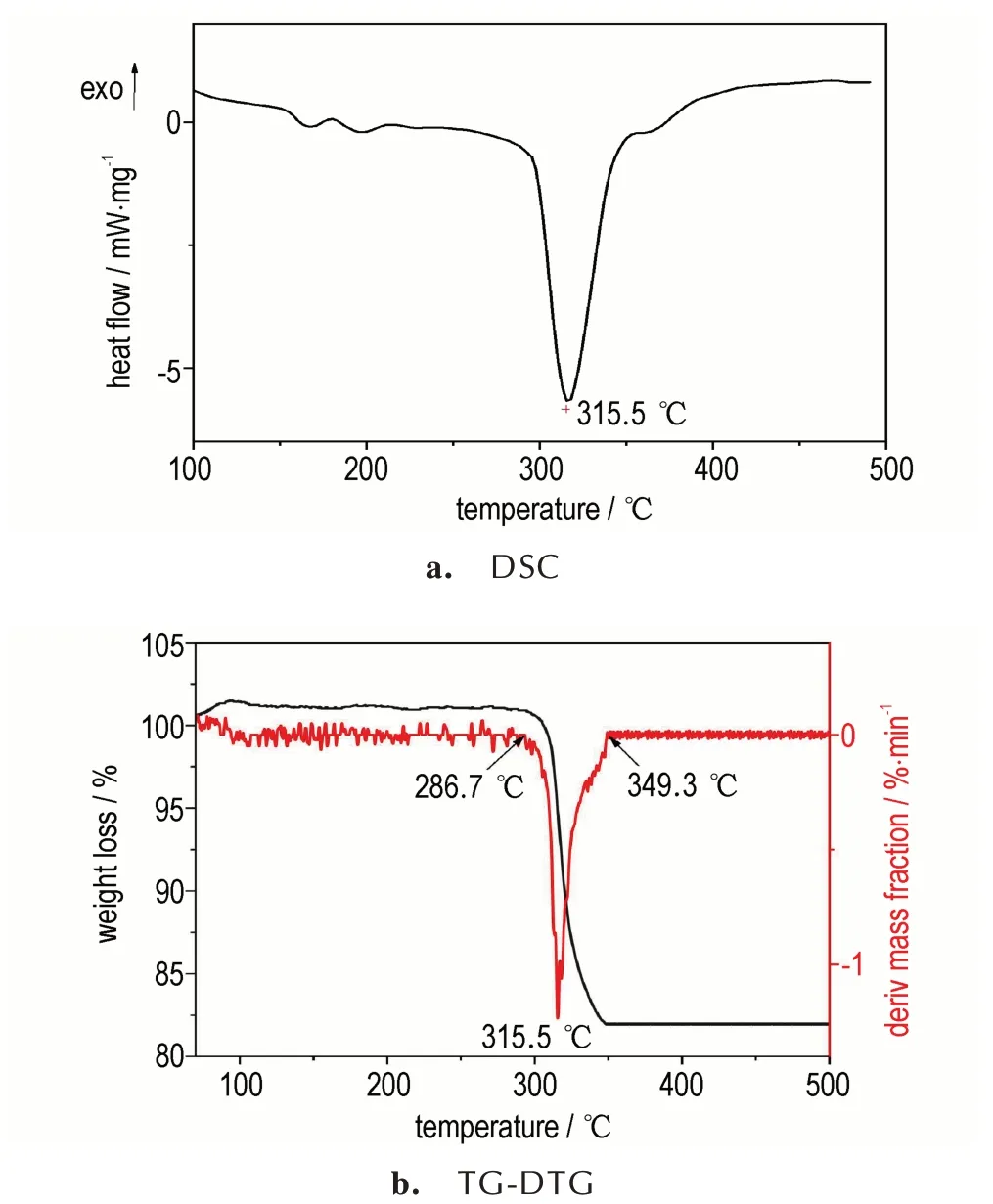
为探讨Mg(BH4)2对硝胺炸药热分解性能的影响,开 展 了 升 温 速 率10 ℃·min-1下 的Mg(BH4)2的DSC-TG 测试,结果如图1 所示。由图1a 可知,Mg(BH4)2的热分解过程是1 个明显的吸热分解过程。由 图1b 中TG 和DTG 曲 线 可 知,Mg(BH4)2在286.7 ℃至349.3 ℃左右失重分解,总失重率为8.01%,且在315.5 ℃时,最大失重率1.25 %·min-1。根 据 文 献[12]可 知,Mg(BH4)2的 热 分 解 过 程 为:Mg(BH4)2→MgH2+2B+3H2→Mg+2B+4H2→MgB2+4H2。说明升温至500 ℃时,Mg(BH4)2发生了部分分解,分解产物为氢化镁、硼和氢气。
RDX、HMX 和CL-20 的热分解特性主要表现在150~350 ℃范围内[13-17],因此,研究Mg(BH4)2对3 种硝胺炸药热分解性能影响的过程中,所选取的温度范围为150~350 ℃。图2~4 分别 为Mg(BH4)2/CL-20、Mg(BH4)2/HMX、Mg(BH4)2/RDX 混 合 物 与 硝 胺 炸 药在不同升温速率下的DSC 曲线。
由 图2 可以看出,RDX 和Mg(BH4)2/RDX 混合物的DSC 曲线上均显示在RDX 熔融吸热后紧邻其分解放热峰,吸热峰与放热峰会有重叠的部分。随着升温速 率 的 增 大,无 论 是RDX 还 是Mg(BH4)2/RDX 混 合物,样品的吸热峰和放热峰均向高温方向移动,峰的宽度逐渐变大;且通过计算放热峰的面积可知,不同升温速率下的放热量发生了明显的变化,随着升温速率的增加,Mg(BH4)2/RDX 混合物的吸热量/放热量明显增加,其中升温速率为2 ℃·min-1时,放热量为328.8 J·g-1,而升温速率为20 ℃·min-1时,放热量为488.8 J·g-1,放热量增加了48.6%。由图2b 可知,Mg(BH4)2的加入对RDX 热分解曲线没有明显的影响。2 ℃·min-1和5 ℃·min-1的升温条件下,RDX 分解放热过程分为2个阶段(图2a),第一阶段,分解放热缓慢进行;第二阶段,分解峰迅速变为尖锐的峰,整个热分解峰为非对称结构。而加入Mg(BH4)2后,混合物的热分解过程基本为对称结构,尖锐的放热峰消失(图2b)。在20 ℃·min-1的升温条件下,加入Mg(BH4)2后,混合物的吸热峰明显减小,而放热峰明显变宽,放热量为280.28 J·g-1,因Mg(BH4)2/RDX混合物中RDX含量为50%,且Mg(BH4)2为吸热分解,故Mg(BH4)2/RDX 混合物中RDX 的放热量为560.4 J·g-1,与RDX 相比,放热量增加了14.7%。



由图3 可知,与Mg(BH4)2/RDX 混合物DSC 曲线相似,Mg(BH4)2/HMX 混合物随着升温速率的增大,样品的吸热峰和放热峰均向高温方向移动,峰的形状也有所改变。峰宽逐渐变大,吸热量/放热量明显增加。与RDX 熔融-分解过程不同的是,HMX 为典型的“分解熔融”型物质[14-15],其热分解是固液反应同时进行的非均相过程,因此随着升温速率的提高,其熔融吸热峰才显现出来。由于HMX 的融吸热过程紧邻分解放热过程,所以其熔融吸热峰很容易被分解放热峰掩盖。在2、5 ℃·min-1时,HMX 和Mg(BH4)2/HMX 混合物的DSC 曲线上均没有观测到熔融吸热峰,而10、20 ℃·min-1升 温 速 率 下,HMX 和Mg(BH4)2/HMX 混合物的DSC 曲线上分别在278.50 ℃和281.31 ℃处都可观测到明显的熔融吸热峰。不同升温速率下Mg(BH4)2/HMX 混 合 物 的DSC 曲 线 均 在300 ℃以 上观测到明显的吸热峰,结合图1 中Mg(BH4)2的DSC和TG-DTG 分解,认为这是Mg(BH4)2/HMX 混合物中Mg(BH4)2的吸热分解过程。
由图3b 可知,Mg(BH4)2/HMX 混合物中在195℃左右的小的放热峰基本消失,在同一升温速率下,混合物放热峰的峰温略有降低,且放热量明显减少,不同升温速率下,混合物的分解放热量均小于HMX 的50%,尤其是在10 ℃·min-1的升温速率下,HMX 的分解放热量为753.4 J·g-1,而混合物的分解放热量仅为204.0 J·g-1,Mg(BH4)2的加入使得HMX 的分解放热量降低了45.8%。但是Mg(BH4)2的起始分解温度为286.7 ℃,HMX 的最终分解温度为312.5 ℃,两者分解温度有交叉,但在混合物的DSC 曲线上没有明显的放热峰信号,说明HMX 的分解放热量大于Mg(BH4)2的分解吸热量,造成混合物的放热量降低可能的原因是:①Mg(BH4)2对HMX 热分解的抑制作用;②Mg(BH4)2的吸热分解导致热量降低;③两种因素协同作用。
由 图4 可 知CL-20 和Mg(BH4)2/CL-20 混 合 物 的DSC 曲线在100~350 ℃范围内,只有一个放热峰。与RDX、HMX 及Mg(BH4)2/RDX、Mg(BH4)2/HMX 的DSC 曲线类似的是,同一样品,随着升温速率的增大,样品的放热峰均向高温方向移动,峰的形状也有所改变,放热峰的峰宽逐渐变大,放热量明显增加。值得注意的是,在20 ℃·min-1下,Mg(BH4)2/CL-20 的DSC 曲线存在2 个明显的分解阶段,在251.8 ℃分解峰出现一个明显的拐点,在251.8 ℃之前,其分解放热比较缓慢,当温度升高至251.8 ℃时,DSC 曲线变的非常尖锐,温度继续上升至254.6 ℃后,分解放热又减缓,整个分解过程不对称。分析认为,随着升温速率的增大,Mg(BH4)2/CL-20 混 合 物Mg(BH4)2的 热 分 解 温 度 升高,20 ℃·min-1升温速率条件下,热量积聚,温度升高至251.8 ℃时,催化Mg(BH4)2分解,提前释氢,氢与CL-20 反应放热,进一步加速了Mg(BH4)2/CL-20 混合物的分解,导致分解峰变得尖锐。而随着温度的进一步升高,Mg(BH4)2吸热分解,降低了混合体系的温度,分解峰又变得较为平缓。放热峰的面积计算结果表明,20 ℃·min-1下,CL-20 分 解 放 热 量 为730.4 J·g-1,添加Mg(BH4)2后混合物的分解放热量为482.3 J·g-1,Mg(BH4)2的 加 入 使 得CL-20 的 分 解 放 热 量 增 加32.1%。因此,初步认为Mg(BH4)2对于CL-20 热分解具有一定的促进作用。
2.2 动力学参数计算
S.F.Sarner[18]指出,非金属无机氧化剂的热分解活化能与推进剂的燃速有关,即推进剂中的无机非金属氧化剂的热分解活化能越低,推进剂的燃速就越高。为了进一步研究硝胺炸药及混合物的热分解特性,采用Kissinger 法对样品的DSC 放热峰进行动力学分析。
Kissinger 法[19]采用的动力学方程为:

式中,β为升温速率,℃·min-1,Ea为表观活化能,kJ·mol-1;A为指前因子,min-1;R 为气体常数,8.314 J·(K·mol)-1;Tp为反应放热峰值温度,℃。按式(1)进行ln(β/Tp2)对1/Tp的线性回归分析可得到一条直线,利用该直线的斜率和截距即可获得表观活化能Ea和lnA。对比研究3 种 硝 胺 炸 药 及Mg(BH4)2/CL-20、Mg(BH4)2/HMX、Mg(BH4)2/RDX 3 种混合物的热分解动力学参数,结果如表1 所示。

Samples RDX Mg(BH4)2/RDX HMX Mg(BH4)2/HMX CL-20 Mg(BH4)2/CL-20 β/℃·min-1 2 218.2 215.1 274.5 275.3 229.8 228.7 Ea 5 r 10 239.8 241.7 283.3 283.2 248.8 248.4 20 251.9 252.3 287.0 287.2 256.6 252.8/KJ·mol-1 141.5 125.7 442.4 462.1 179.5 191.0 lnA/s-1 25.9 24.0 55.6 57.5 23.7 23.6 0.9995 0.9996 0.9999 0.9998 1.000 0.9999 235.0 232.5 279.1 279.0 240.0 239.6
表观活化能是物质分解难易程度的重要指标,对分析Mg(BH4)2对3 种硝铵炸药热分解的影响有重要作用。由 表1 可 知,添加Mg(BH4)2后RDX 的表观活化能降低15.8 kJ·mol-1,结合图2 以及放热量计算结果表明,Mg(BH4)2对RDX 的热分解具有一定的促进作用。与之相反的是,添加Mg(BH4)2后HMX 的活化能提高了19.7 kJ·mol-1,指前因子变化不大,结合图3测试结果和放热量的计算表明,Mg(BH4)2对HMX 的热分解过程产生了明显的抑制作用。与RDX 和HMX不同的是,添加Mg(BH4)2后CL-20 的活化能提高了11.5 kJ·mol-1,指前因子基本无变化,这说明Mg(BH4)2对CL-20 的热分解过程产生了抑制作用,但是在DSC测试中,添加Mg(BH4)2后CL-20 的放热量增大,具有一定的促进作用,故需要进一步研究Mg(BH4)2对CL-20 热分解的影响。
2.3 热分解气体产物分析
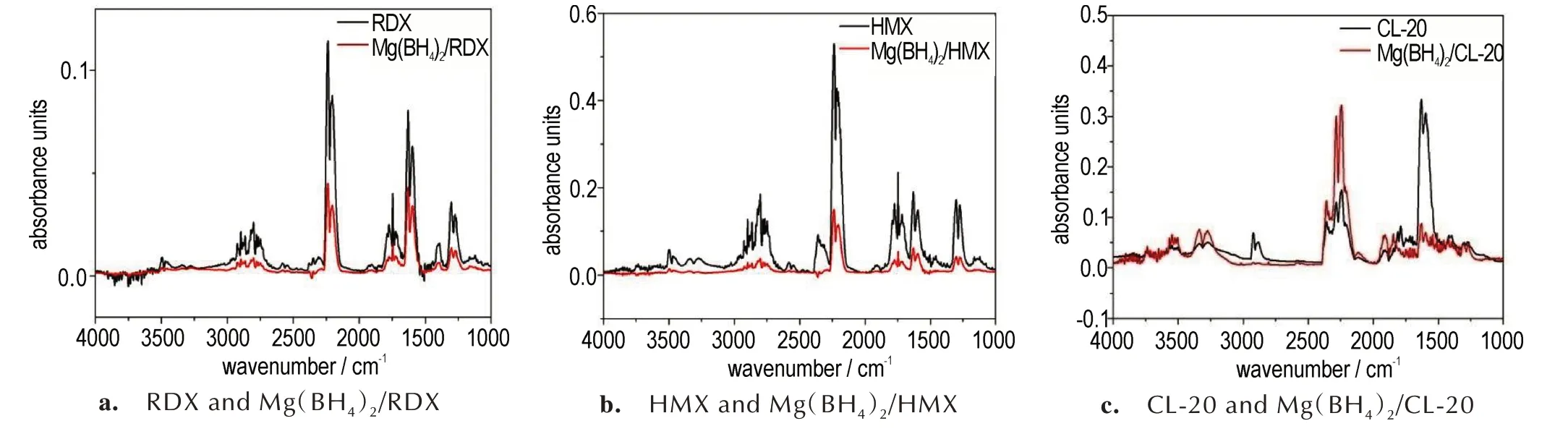
随着温度的不断升高,硝铵炸药分解,TG-FTIR 联用系统可以在程序升温模式下加热样品,同时样品分解的气相产物可以实时传送至红外检测器内,实现对样品分解的气相产物的实时监测。图5 为10 ℃·min-1下RDX、HMX、CL-20及Mg(BH4)2/RDX、Mg(BH4)2/HMX、Mg(BH4)2/CL-20 混合物的热分解气相产物。对照标准 红 外 图 谱 查 得,3500、2240、1300 cm-1为N2O,3750、3400、1600 cm-1为H2O,1260、1630、1750、2920 cm-1为NO2,2360 cm-1为CO2,1745 cm-1为HCHO,3 种硝胺炸药热分解气相产物均有CO2、H2O、N2O、HCHO、NO2等。
由 图5a 和 图5b 可 知,RDX 与Mg(BH4)2/RDX、HMX 与Mg(BH4)2/HMX 热分解气相产物的种类基本相同,混合体系的吸光度较纯的RDX 和HMX 明显降低,但峰的位置基本不变。由图5c 可知,CL-20 与Mg(BH4)2/CL-20 热分解气相产物有明显的区别,混合物的热分解气相产物在2920 cm-1和1750 cm-1波数位置附近的红外信号峰基本消失,1630 cm-1波数位置信号峰值明显变小,这说明Mg(BH4)2/CL-20 混合物的热分解气相产物中NO2的特征信号明显降低。Mg(BH4)2/CL-20 的 热 分 解 气 相 产 物 在3500 cm-1和2240 cm-1波数位置附近信号峰明显变强,说明CL-20/Mg(BH4)2的热分解气相产物中N2O 的特征信号明显增强。与此同时,在3750、3400、1600 cm-1处的信号明显增强,其峰值甚至高于纯CL-20 的红外峰值,说明Mg(BH4)2/CL-20 的热分解气相产物中H2O的特征信号增强明显。
由图5 可知,加入的Mg(BH4)2后,对于硝铵类炸药热分解气相产物的影响,尤其是对CL-20 热分解气相产物的影响主要表现为对N2O 和NO2特征峰的影响,因此在研究Mg(BH4)2对硝胺炸药热分解气相产物影响过程中,选取NO2和N2O 为主要研究对象。
由于不同硝胺炸药与Mg(BH4)2混合后特征峰的吸光度有所不同,本节研究了硝胺炸药及其分别与Mg(BH4)2混合体系热分解气相产物中主要气体产物NO2和N2O 吸光度随温度的变化,结果如图6~8所示。


为了进一步研究吸光度随温度的变化规律,本节对主要气相产物含量进行了分析。依据朗伯比尔定律[20],其中吸光度A与被测组分浓度c入射光通过样品的光程b的乘积成正比,即

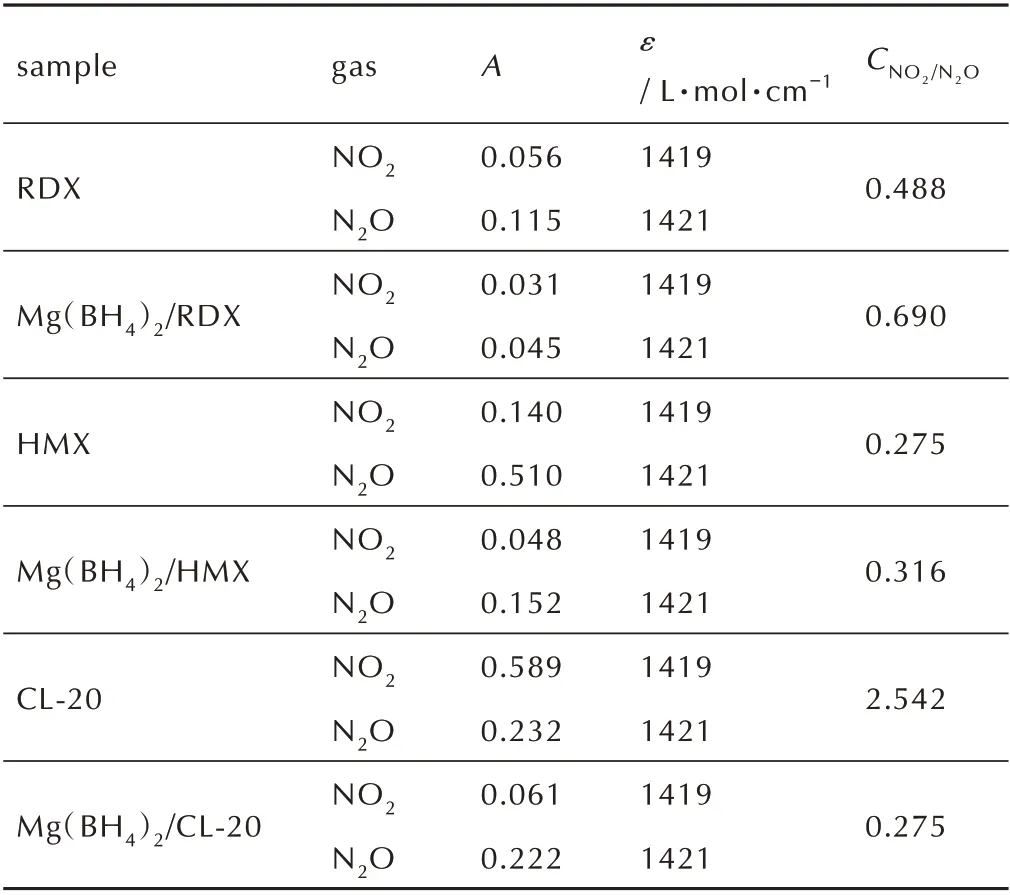
式中,ε为摩尔吸光系数。恒定光程下的浓度c只与气体种类及吸光度A有关;主要热分解气相产物的ε值均由文献中查得[21]。由于无法获得光程b的准确值,因此,选取NO2为基准,由式(2)计算硝胺炸药及其与Mg(BH4)2混合体系中热分解气相产物中NO2同N2O的浓度比来表示气相产物组成的变化情况,记作CNO2/N2O,结果如表2 所示。
由图6 可知,RDX 与Mg(BH4)2/RDX 混合物均在238 ℃剧烈分解,与图2 的DSC 结果一致。混合物热分解气体产物NO2和N2O 均来源于RDX,故按照质量比1∶1 加入Mg(BH4)2后,若无作用,其吸光度减半,对其他结果无明显影响。图6a 和6b 均表明,加入Mg(BH4)2后,释放气体的温度范围变窄,说明Mg(BH4)2在一定程度上促进了RDX 的热分解,这与DSC 测试放热量增加和动力学计算结果表观活化能降低结果相一致,进一步证明了Mg(BH4)2对RDX 热分解具有一定的促进作 用。表2 结 果 表 明,添 加Mg(BH4)2后,RDX 的CNO2/N2O变化不大,结合图2 不同升温速率下,添加Mg(BH4)2前后,RDX 的DSC 曲线形状无明显变化可知,Mg(BH4)2对RDX 的热分解历程无明显影响。
sample gas A ε CNO2/N2O RDX 0.488 Mg(BH4)2/RDX 0.690 HMX 0.275 Mg(BH4)2/HMX 0.316 CL-20 2.542 Mg(BH4)2/CL-20 NO2 N2O NO2 N2O NO2 N2O NO2 N2O NO2 N2O NO2 N2O 0.056 0.115 0.031 0.045 0.140 0.510 0.048 0.152 0.589 0.232 0.061 0.222/ L·mol·cm-1 1419 1421 1419 1421 1419 1421 1419 1421 1419 1421 1419 1421 0.275
由图7 可知,HMX 与Mg(BH4)2/HMX 混合物均在282 ℃剧烈分解,与图3 的DSC 测试结果一致;混合物热分解气体产物NO2和N2O 均来源于HMX,加入Mg(BH4)2后,若无作用,其吸光度应减半,测试结果无其他明显变化。图7b 表明,加入Mg(BH4)2后,释放气体的温度范围变宽,说明Mg(BH4)2在一定程度上抑制了HMX 的热分解,这与DSC 测试放热量降低和动力学计算结果表观活化能提高结果相一致,进一步证明了Mg(BH4)2对HMX 热分解具有较强的抑制作用。表2 结 果 表 明,添 加Mg(BH4)2后,HMX 的CNO2/N2O值变化不大,结合图3 不同升温速率下,添加Mg(BH4)2前后,HMX 的DSC 曲线形状无明显变化可知,Mg(BH4)2对HMX 的热分解历程无明显影响。由图8 可以看出,相比与CL-20,混合物Mg(BH4)2/CL-20 特征峰的峰温明显提高,N2O 和NO2的峰温由242.7 ℃提 高 至246.3 ℃,说 明 加 入Mg(BH4)2后,CL-20 的热分解温度明显提高。图8 表明,加入Mg(BH4)2后,释放气体的温度范围变窄,说明Mg(BH4)2在一定程度上催化加速了CL-20 的热分解,这与DSC测试放热量增大结果相一致,进一步证明了Mg(BH4)2对CL-20 热分解具有一定的促进作用。与混合物Mg(BH4)2/RDX 和Mg(BH4)2/HMX 的FIIR-TG 测 试 结 果不同的是,Mg(BH4)2/CL-20 热分解特征产物N2O 的吸光度明显增强,而NO2的吸光度显著降低,且添加Mg(BH4)2后,CL-20 的CNO2/N2O由2.542 降低至0.275,降低了89.2%,热分解产物中NO2的吸光度大大降低,由0.589 降至至0.061,而N2O 的吸光度变化不大。图5c 红外谱图中水的特征峰进一步表明气相产物中有大量的水存在,推测是由于Mg(BH4)2中含有大量的H+,NO2与H+进一步反应,导致气相产物中NO2的含量大幅下降,由此说明加入Mg(BH4)2对CL-20 的热分解历程产生了明显的影响。
3 结论
(1)20 ℃·min-1下,与RDX 相比,Mg(BH4)2/RDX混合物的放热量增加了14.7%,表观活化能降低15.8 kJ·mol-1,热分解产物中CNO2/N2O值变化不大,说明Mg(BH4)2对RDX 热分解具有一定的促进作用,且对热分解历程没有明显的影响。
(2)与HMX相比,Mg(BH4)2/HMX混合物表观活化能提高了19.7 kJ·mol-1,热分解产物中CNO2/N2O值变化不大,说明Mg(BH4)2对HMX 热分解速率具有一定的抑制作用,但对HMX 的热分解历程没有产生明显的影响。
(3)20 ℃·min-1下,与CL-20相比,Mg(BH4)2/CL-20的放热量增加了32.1%,表观活化能提高了11.5 kJ·mol-1,热分解产物中CNO2/N2O值大幅降低,产生大量H2O,说明Mg(BH4)2对CL-20 的热分解放热量和热分解历程均产生了明显的影响。
