安石榴苷通过Akt/NF⁃κB/Cyclin D1 通路对幼龄哮喘大鼠气道平滑肌细胞增殖和凋亡的影响
2022-08-13王荣环
王 莹 王荣环 谢 意
天津医科大学第二医院药剂科 天津 300211
哮喘是儿童慢性呼吸道疾病,慢性气道炎症和气道高反应性是其主要特征,气道重塑是其最重要的病理性特点[1,2]。一线药物吸入型糖皮质激素能改善儿童哮喘症状,但不能改变疾病进程并预防哮喘复发[3,4]。气道平滑肌细胞(airway smooth mus⁃cle cell,ASMC)其恶性增殖是气道重塑的重要基础[5]。蛋 白 激 酶B(protein kinase B,Akt)/核 因子⁃κB(nuclear factor⁃κB,NF⁃κB)/细胞周期蛋白D1(Cyclin D1)通路是炎症引发细胞增殖的重要途径,Akt 磷酸化后可激活NF⁃κB,导致NF⁃κB 磷酸化后调节炎症反应,同时上调Cyclin D1 表达,加快细胞周期进程[6,7]。安石榴苷是从石榴果皮中提取的主要活性成分之一,具有抗炎、抗氧化、抗菌、抗肿瘤等作用[8]。研究显示,安石榴苷能缓解慢性支气管炎大鼠体内的炎性反应,但对哮喘的影响尚无人研究[9]。本研究将探究安石榴苷对幼龄哮喘大鼠ASMC 增殖、凋亡及Akt/NF⁃κB/Cyclin D1 通路的影响,以期为治疗儿童哮喘提供新依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 3 周龄SD 雄性大鼠,体质量90~100 g,购自肇庆市瑞思元生物科技有限公司,许可证号:SCXK(粤)2020⁃0053。在温度20~25 ℃、自由饮食饮水条件下适应性喂养7 d。
1.1.2 主要试剂 氢氧化铝、卵白蛋白、Annexin V⁃FITC/PI 试剂盒(北京百奥莱博);安石榴苷、HE试剂盒、CCK⁃8 试剂(北京索莱宝);兔抗p⁃Akt、兔抗Akt、兔抗NF⁃κB p⁃p65、兔抗NF⁃κB p65、兔 抗Cy⁃clin D1、兔抗GAPDH、山羊抗兔(杭州戴格公司)。
1.1.3 主要仪器 AH⁃2 型显微镜(日本Olym⁃pus);SynergyH 1 型酶标仪(美国BioTek);BD FACSCanto Ⅱ型流式细胞仪(美国BD);Alpha View 型凝胶成像系统(美国Protein Simple)。
1.2 方法
1.2.1 实验分组与哮喘大鼠模型制备 幼龄大鼠随机分为正常组、哮喘组和安石榴苷低、中、高剂量组,每组10 只。按照文献[10]制备哮喘模型,出现口唇发绀、腹肌抽搐、呼吸急促及站立不稳等现象代表哮喘模型建立成功。
1.2.2 实验给药 于激发过程第1 天开始给药,安石榴苷低、中、高剂量组灌胃10、20、40 mg/kg 安石榴苷[9],正常组、哮喘组灌胃等量生理盐水,每天1次,连续4 周。
1.2.3 大鼠一般情况观察 给药结束后24 h 内,记录幼龄大鼠体质量及临床症状,测定肺功能,计算出大鼠最大呼气流量(peak expiratory flow,PEF)及0.2 秒用力呼气容积占用力肺活量比率(ratio of forced expiratory volume at 0.2 second and forced vi⁃tal capacity,FEV0.2/FVC)。
1.2.4 HE 染色观察大鼠肺组织学 给药结束后24 h 内将大鼠处死取材。开胸迅速分离肺组织,右侧肺组织以液氮冻存待检;左侧肺组织用多聚甲醛固定,石蜡包埋,切片,厚度5 µm,HE 染色观察。
1.2.5 哮喘大鼠ASMC 的分离、培养及分组 取1只哮喘模型大鼠,用10%水合氯醛(40 mg/kg)麻醉,在无菌条件下分离气道平滑肌组织,组织贴壁法培养ASMC,差速贴壁法纯化细胞[11],在含20%胎牛血清及双抗的DMEM 培养基中培养、传代。
取第5 代ASMC 5×104个/mL 接种于细胞培养板,分为对照组和安石榴苷低、中、高浓度组,分别加入0、100、200、400 μmol/L 的安石榴苷[12]。
1.2.6 CCK⁃8 法检测细胞增殖 细胞培养48 h,加入10 μL CCK⁃8 试剂,培养2 h,使用酶标仪(波长450 nm)检测各孔吸光度(A)值。
1.2.7 流式细胞仪检测细胞凋亡 细胞培养48 h,收集细胞并用结合缓冲液调整为1×106个/mL,按Annexin V⁃FITC/PI 试剂盒说明书步骤进行操作,使用流式细胞仪分析细胞凋亡率。
1.2.8 Western Blot 检测肺组织、ASMC 中Akt/NF⁃κB/Cyclin D1 通路相关蛋白表达 收集培养48 h 后的ASMC,提取右侧肺组织及细胞中总蛋白,BCA 法定量,10% SDS⁃PAGE 电泳分离蛋白,转移至PVDF 膜后封闭1 h,加入一抗(兔抗p⁃Akt、兔抗Akt、兔抗NF⁃κB p⁃p65、兔抗NF⁃κB p65、兔抗Cy⁃clin D1、兔抗GAPDH,均1∶100),4 ℃孵育过夜,加入二抗(山羊抗兔,1∶2 000)孵育1 h,化学发光法显色,凝胶成像系统扫描图像,分析条带灰度。
1.3 统计学分析采用SPSS 24.0 软件进行统计学分析,P<0.05 为差异有统计学意义。数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK⁃q检验。
2 结果
2.1 幼龄大鼠一般情况图1 显示,与正常组相比,哮喘组体质量、PEF、FEV0.2/FVC 降低;与哮喘组相比,安石榴苷低、中、高剂量组体质量、PEF、FEV0.2/FVC 升高,且呈剂量依赖(P<0.05)。
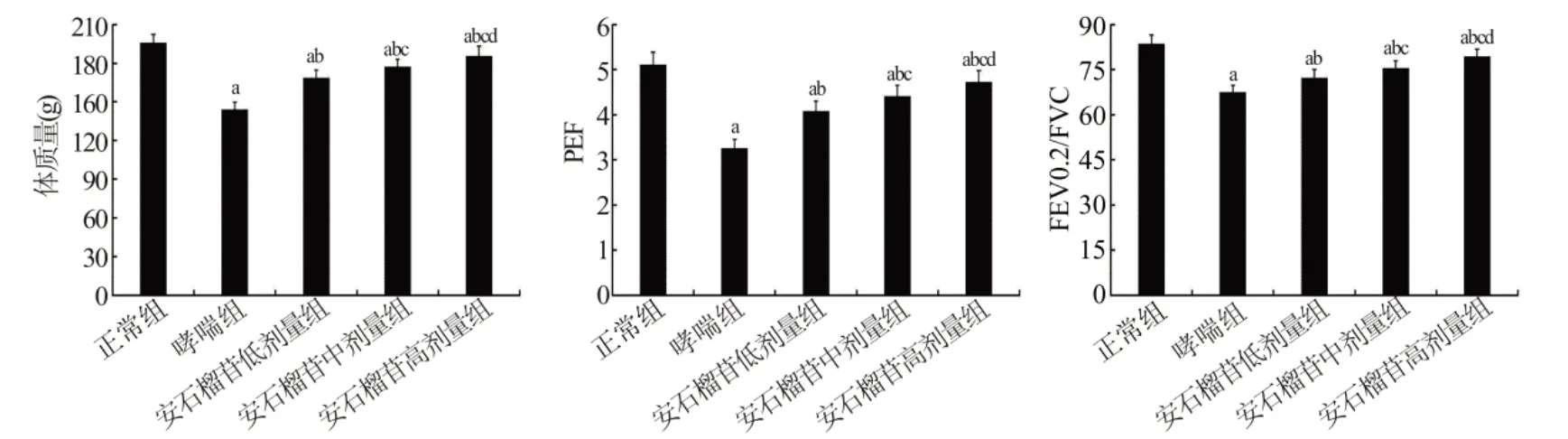
图1 各组体质量、PEF、FEV0.2/FVC 的比较
2.2 肺组织学观察正常组肺组织黏膜上皮完整,支气管管腔及肺泡形态规则,无炎性细胞浸润及气管平滑肌增厚现象;哮喘组肺组织黏膜上皮破损,可见大量的炎性细胞浸润及明显的气管平滑肌增厚;安石榴苷低、中、高剂量组肺组织中炎性细胞浸润、气管平滑肌增厚情况逐渐减轻(图2)。
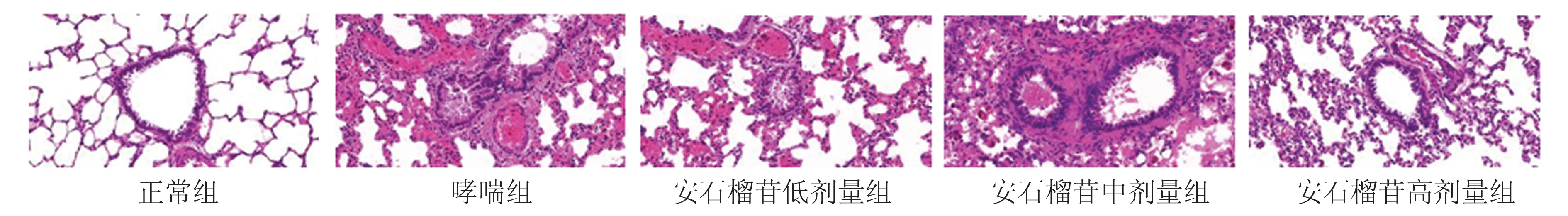
图2 HE 染色观察各组肺组织学情况(×200)
2.3 肺组织中Akt/NF⁃κB/Cyclin D1 通路相关蛋白表达情况图3 显示,与正常组相比,哮喘组肺组织p⁃Akt/Akt、NF⁃κB p⁃p65/NF⁃κB p65、Cyclin D1/GAPDH 蛋白表达水平升高;与哮喘组相比,安石榴苷 低、中、高 剂 量 组 肺 组 织p⁃Akt/Akt、NF⁃κB p⁃p65/NF⁃κB p65、Cyclin D1/GAPDH 蛋 白表达水平降低,且呈剂量依赖(P<0.05)。

图3 各组肺组织中蛋白表达水平
2.4 各组ASMC增殖情况见图4。与对照组相比,安石榴苷低、中、高浓度组ASMC 的A值降低;随着安石榴苷浓度的升高,ASMC的A值降低(P<0.05)。

图4 各组ASMC 增殖情况(A 值)的比较
2.5 各组ASMC 凋亡情况图5 显示,与对照组相比,安石榴苷低、中、高浓度组ASMC 凋亡率升高,且呈剂量依赖(P<0.05)。
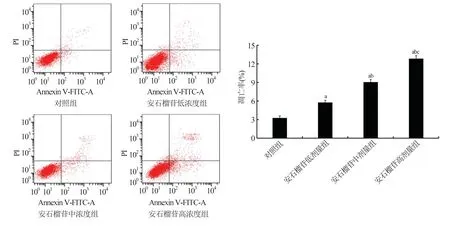
图5 各组ASMC 凋亡情况及凋亡率比较
2.6 ASMC 中Akt/NF⁃κB/Cyclin D1 通路相关蛋白表达情况图6 显示,与对照组相比,安石榴苷低、中、高浓度组ASMC 细胞中p⁃Akt/Akt、NF⁃κB p⁃p65/NF⁃κB p65、Cyclin D1/GAPDH 蛋白表达水平降低,且呈剂量依赖(P<0.05)。

图6 各组ASMC 的蛋白表达水平比较
3 讨论
哮喘是常见于儿童的慢性呼吸道疾病,为了模拟儿童哮喘,本研究选用幼龄大鼠作为实验动物,并通过氢氧化铝、卵白蛋白诱导建立幼龄哮喘大鼠模型,成功建立了哮喘大鼠模型。
安石榴苷具有抗氧化、抑菌、抗病毒、抗炎等多种活性[13]。研究发现,安石榴甙在脂多糖诱导的RAW264.7 巨噬细胞炎症反应中起抗炎作用[14]。本研究提示安石榴苷可抑制ASMC 增殖并诱导其凋亡,即其可抑制ASMC 的恶性增殖状态。Akt/NF⁃κB/Cyclin D1 通路调节炎症反应及细胞增殖、凋亡进程,Akt 通路激活后可通过激活NF⁃κB,上调其磷酸化表达并使其从细胞质中转至细胞核,进而上调Cyclin D1 表达促进细胞增殖[15]。本研究发现,哮喘组幼龄大鼠肺组织中p⁃Akt/Akt、NF⁃κB p⁃p65/NF⁃κB p65、Cyclin D1/GAPDH 蛋白表达水平较正常组升高,提示Akt/NF⁃κB/Cyclin D1 通路参与哮喘发病过程。使用安石榴苷作用于幼龄哮喘大鼠及其ASMC,可降低肺组织及ASMC 相关蛋白表达水平,提示安石榴苷可抑制Akt/NF⁃κB/Cy⁃clin D1 通路的激活,可能与抑制ASMC 细胞恶性增殖进而减轻气道重塑有关。
综上所述,安石榴苷可减轻幼龄哮喘大鼠气道重塑病理状态,抑制ASMC 增殖并诱导其凋亡,其机制可能与抑制Akt/NF⁃κB/Cyclin D1通路激活有关。
