结直肠癌细胞过表达tricellulin促进人脐静脉内皮细胞侵袭转移*
2022-08-12张金秀李梦诗覃蒙斌吴晴茹程若溪刘诗权黄杰安
彭 鹏,张金秀,李梦诗,覃蒙斌,孙 娟,吴晴茹,程若溪,刘诗权,黄杰安
(广西医科大学第二附属医院消化内科,广西南宁 530007)
结直肠癌(Colorectal Cancer,CRC)是一种常见的消化道肿瘤。在全球人类肿瘤中,结直肠癌的总发病率排名第三,死亡率排名第二。虽然多种治疗手段可应用于结直肠癌的治疗,但是其预后仍然不理想,尤其是在疾病晚期[1]。因此,研究结直肠癌侵袭转移的分子机制和寻找更有效的生物分子标记物具有重要意义。Tricellulin,也称为TRIC、MARVELD2,是2005年科学家通过免疫电镜技术首次发现的存在于三细胞连接处的紧密连接蛋白,是第一个被发现的分布于三细胞连接处的分子[2]。它为细胞最终构成各种立体结构提供支点,是构成和维持细胞间黏附功能的重要结构[3]。近年来的研究发现,tricellulin与肿瘤的发生发展、侵袭转移密切相关,有可能成为评估肿瘤进展和治疗的新靶点[4,5]。研究发现,tricellulin在结直肠癌组织中高表达,且与结直肠癌肿瘤浸润深度、TNM分期、淋巴结转移和远处转移有关[6],但是其中的分子机制尚不清楚。血管生成是肿瘤侵袭转移的重要因素之一。血管内皮细胞是构成血管内膜的基本元素,在血管新生过程中起决定作用。基质金属蛋白酶(MMPs)在介导肿瘤血管新生、转移和侵袭等过程中发挥重要作用。因此,研究tricellulin和内皮细胞的联系对于探索其与肿瘤血管生成、侵袭转移具有重要作用。本研究通过慢病毒转染结直肠癌细胞HCT116过表达tricellulin,检测转染前后结直肠癌细胞MMP2、MMP7的表达及侵袭能力的变化,检测转染前后细胞上清液对人脐静脉内皮细胞HUVEC侵袭能力的影响,以探索tricellulin影响结直肠癌侵袭转移能力的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞与慢病毒载体
人结直肠癌细胞株HCT-116、SW620、HCT8,正常人结肠黏膜上皮细胞系NCM460,人脐静脉内皮细胞HUVEC均购于中国科学院上海生物化学与细胞生物学研究所细胞资源中心。根据tricellulin基因(GeneID:NM_001038603.2)设计的重组慢病毒过表达载体LV-tricellulin和空载体LV-GFP(阴性对照)购自上海吉凯基因医学科技股份有限公司。
1.1.2 主要仪器
CO2恒温细胞培养箱购自美国赛默飞世尔科技公司;移液器购自德国epppendorf公司;倒置相差显微镜、倒置荧光显微镜购自日本Nikon公司;垂直电泳仪、湿转转膜仪购自美国Bio-Rad公司;Odyssey双色红外荧光成像仪购自美国LI-COR公司。
1.1.3 主要材料与试剂
Transwell小室、细胞培养皿及24孔细胞培养板购自美国Corning公司;10%胎牛血清、DMEM培养基购自美国Gibco公司;青霉素-链霉素溶液(100×)购自北京索莱宝科技有限公司;结晶紫购自大连美仑生物技术有限公司;tricellulin兔抗人多克隆抗体购自美国赛默飞世尔科技公司;GAPDH抗体购自美国Proteintech Group公司;IRDye®680RD Goat anti-Rabbit购自美国LI-COR公司;硝酸纤维素膜购自美国Millipore公司;Matrigel胶购自美国B&D公司;嘌呤霉素购自北京索莱宝科技有限公司;MMP2、MMP7 ELISA kits购于美国CLOUD-CLONE公司。
1.2 方法
1.2.1 细胞培养
人结直肠癌细胞株HCT-116、SW620、HCT8,正常人结肠黏膜上皮细胞系NCM460以及人脐静脉内皮细胞HUVEC分别用含有10%胎牛血清DMEM培养基放置于37℃、5% CO2的培养箱中培养。
1.2.2 慢病毒转染
选取处于对数生长期的HCT116细胞进行慢病毒转染,待细胞铺满孔50%时,按照说明书将编码人tricellulin的过表达慢病毒载体(TRIC-OE)及空载慢病毒(NC)分别转染HCT116细胞,运用嘌呤霉素筛选后获得稳定转染细胞株。采用western blot验证转染效率。
1.2.3 Western blot
将40 μg细胞蛋白和上样缓冲液混合并变性后,上样在12%分离胶/5%积层胶上进行SDS-PAGE。应用电转移将电泳分离后的蛋白转移至PVDF膜上,滤膜经5%脱脂奶粉-TBS溶液于室温封闭1 h后,一抗孵育过夜。滤膜经TBST缓冲液清洗3次后,再与荧光二抗于室温孵育1 h。滤膜经TBST缓冲液清洗3次后,应用Odyssey 双色红外荧光扫描成像系统显影。GAPDH设置为内参对照。
1.2.4 Transwell小室检测HCT116细胞侵袭能力
将Matrigel胶用无血清DMEM培养基按照1∶8的比例稀释,吸取50 μL铺于上室,将铺好的基质胶放置到4℃冰箱包被过夜。分别将TRIC-OE、NC组细胞悬液种在上室,下室加入含20%胎牛血清(Fetal Bovine Serum,FBS)的DMEM培养基,放置到培养箱中培养24 h。使用适量甲醇将小室底膜上的细胞固定后置于0.1%结晶紫中染色。清洗后倒置风干,倒置显微镜下随机选取5个视野进行拍照计数。
1.2.5 Transwell小室检测TRIC-OE上清液对HUVEC细胞侵袭能力的影响
TRIC-OE在10 cm培养皿中长至约80%汇合度时,换成6 mL新鲜的完全培养基。24 h后收集细胞培养上清液,3 000 r/min离心5 min后,将上清液转移到新的15 mL离心管中。使用TRIC-OE上清液配制条件培养基(TRIC-OE-CM),上清液∶20%FBS=8∶2。当HUVEC细胞达到约60%汇合度时,将培养基换成条件培养基继续培养,48 h后消化、离心并收集HUVEC细胞。铺胶方法同1.2.4节,将HUVEC细胞悬液种在上室,使用无血清培养基培养,下室加入培养条件培养基。培养24 h后,固定、染色、拍照方法同1.2.4节。
1.2.6 ELISA法检测MMP2、MMP7的表达
各组细胞培养24 h后收集细胞上清液。根据ELISA试剂盒操作说明检测TRIC-OE、NC两组细胞上清液中MMP2、MMP7的表达含量。根据标准品浓度及A 值绘制标准曲线,计算每孔待测品浓度。
1.3 统计学方法
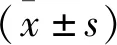
2 结果与分析
2.1 Tricellulin在人结直肠癌细胞系中的表达
Tricellulin蛋白在人结直肠癌细胞系HCT116、SW620、HCT8的表达量均高于人结肠黏膜上皮细胞系NCM460(图1),说明tricellulin在人结直肠癌细胞中高表达。选择中等量表达内源性tricellulin蛋白及侵袭能力中等的HCT116细胞株,以进行下一步实验。
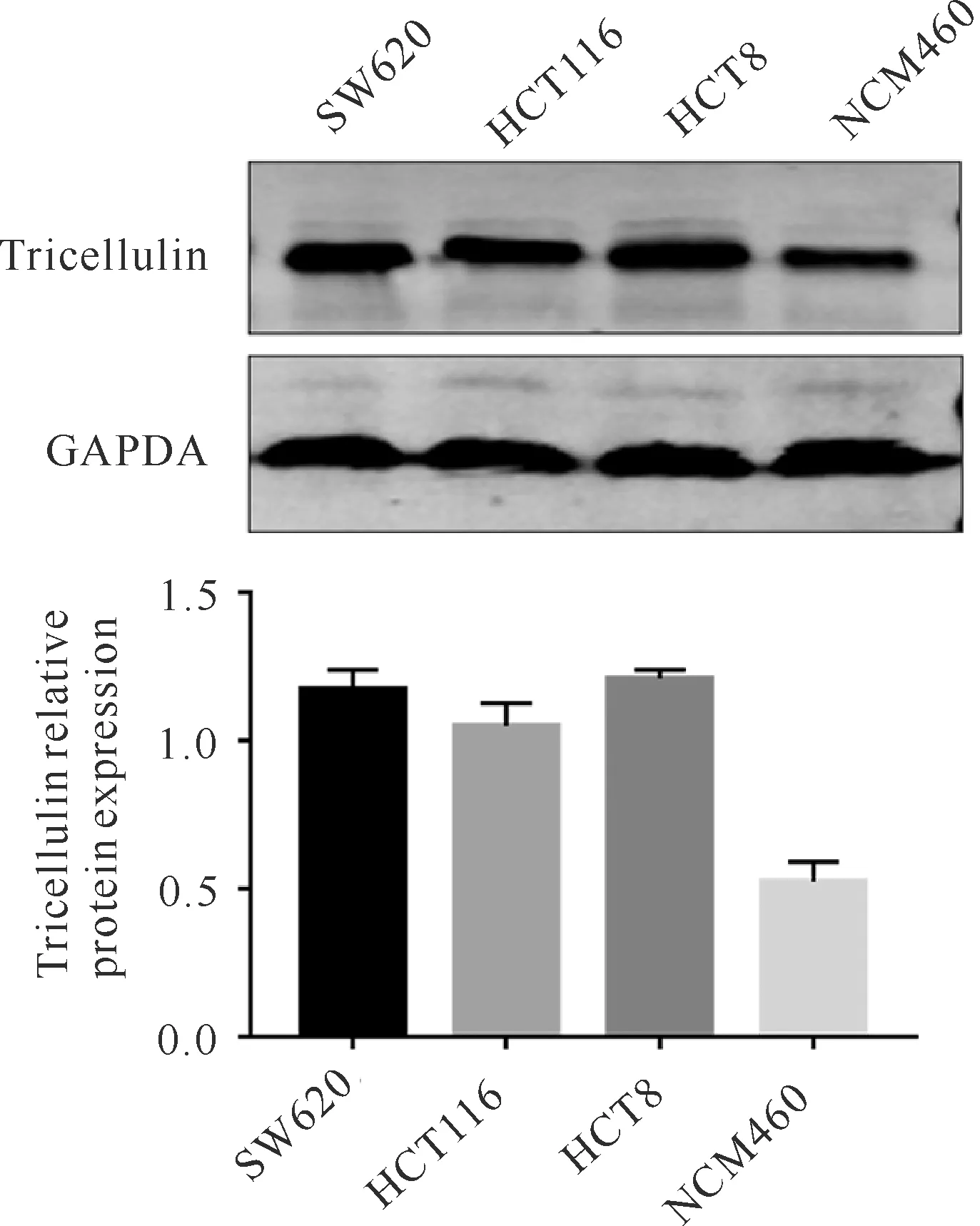
图1 Tricellulin在人结直肠癌细胞系及人结肠黏膜上皮细胞系的表达Fig.1 Expression of tricellulin in human colorectal cancer cell lines and human colonic mucosal epithelial cell lines
2.2 过表达tricellulin的鉴定
过表达慢病毒转染结直肠癌细胞HCT116,经过筛选后获得稳定过表达tricellulin的细胞株,荧光显微镜下可见绿色荧光表达大于70%(图2)。提取总蛋白进行western blot实验,以GAPDH为参照基因,结果如图3。Western blot的验证实验结果说明,稳定过表达tricellulin 的HCT116细胞株成功构建,此细胞株可用于后续实验。
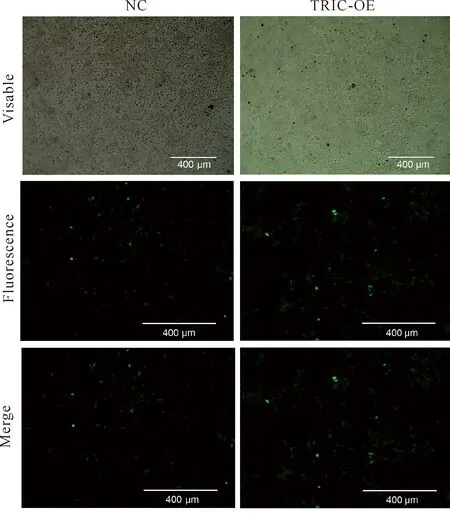
图2 慢病毒转染tricellulin (TRIC-OE)与阴性对照组细胞(NC)内绿色荧光蛋白表达(250×)Fig.2 Green fluorescent protein expression in lentivirus-transfected tricellulin (TRIC-OE) and negative control cells (NC)(250×)
**indicates significant difference at P<0.01
2.3 过表达tricellulin对人结直肠癌细胞侵袭能力的影响
通过Transwell小室实验检测各组细胞对人结直肠癌细胞的侵袭能力的影响,结果显示,与NC组相比,TRIC-OE组的侵袭细胞数量明显增加(图4,P<0.01),说明过表达tricellulin可增强人结直肠癌细胞的侵袭能力。
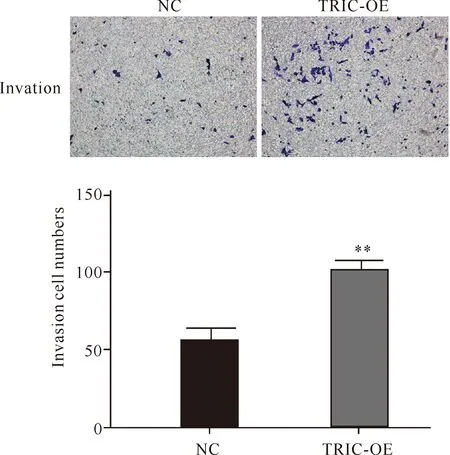
**indicates significant difference at P<0.01
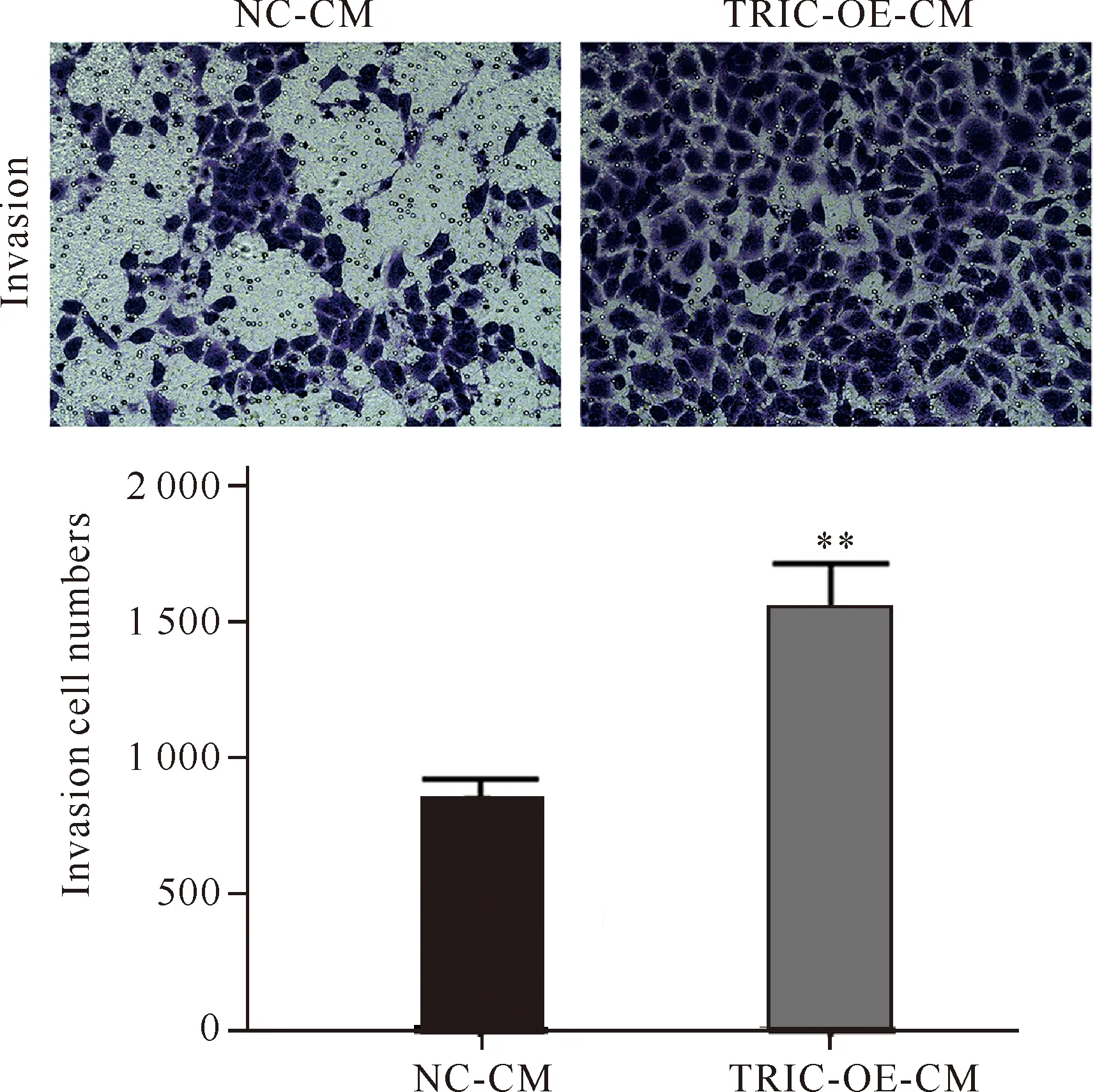
2.4 过表达tricellulin细胞上清液对HUVEC细胞侵袭能力的影响
通过Transwell小室实验检测各组细胞上清液对HUVEC细胞的侵袭能力的影响。与NC组相比,使用TRIC-OE上清液配制条件培养基(TRIC-OE-CM组)可使HUVEC细胞侵袭数量明显增加(图5,P<0.01),说明过表达tricellulin人结直肠癌细胞上清液可增强HUVEC细胞的侵袭能力。
2.5 过表达tricellulin细胞上清液对MMP2、MMP7表达的影响
ELISA法检测各组细胞上清液中MMP2、MMP7的表达,结果显示TRIC-OE组中MMP2、MMP7的含量明显升高(图6,P<0.01),说明tricellulin可能通过MMP2、MMP7影响HUVEC的侵袭能力。
**indicates significant difference at P<0.01
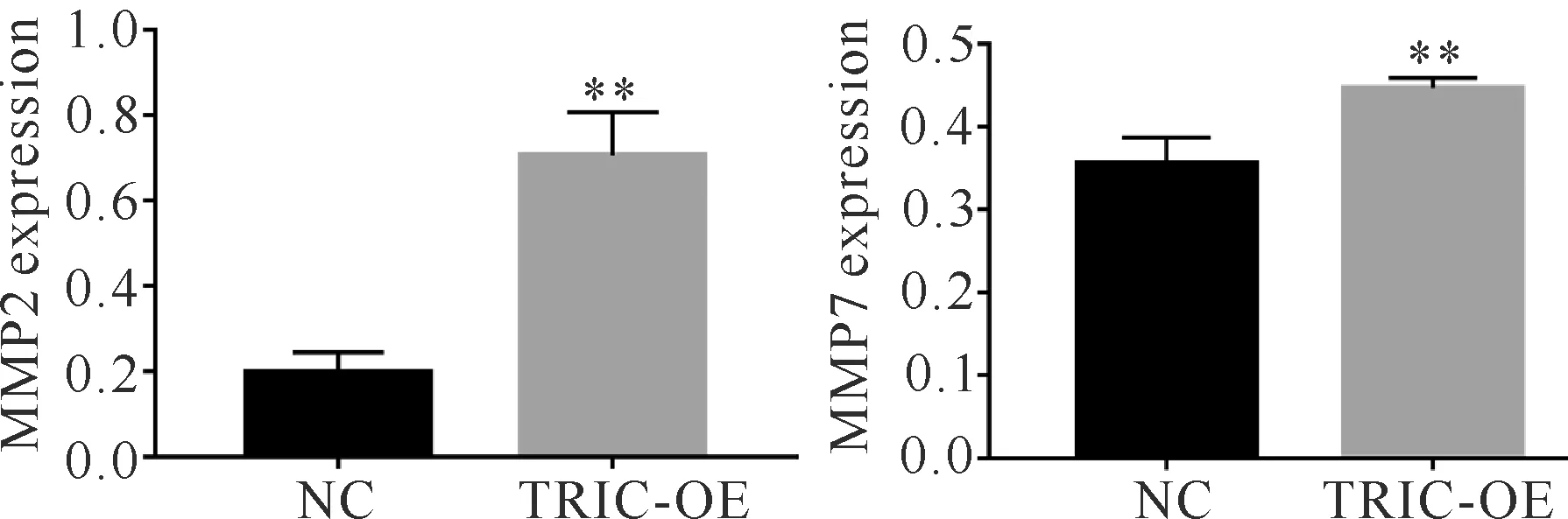
**indicates significant difference at P<0.01
3 讨论
虽然多种治疗手段可应用于结直肠癌的治疗,如手术、放化疗、免疫治疗、靶向治疗等,但是结直肠癌的预后仍不佳[7]。在所有肿瘤中,结直肠癌的转移率位居第三,是消化内科临床患者的常见死亡原因。目前结直肠癌侵袭转移的分子机制尚未完全阐明。肠上皮屏障由单层细胞和细胞间连接组成,细胞间连接包括紧密连接、黏附连接、桥粒、缝隙连接[8]。越来越多的研究表明,紧密连接蛋白在肿瘤的发生、侵袭转移中扮演着重要角色[9-11]。Tricellulin作为紧密连接蛋白中的一员,其主要表达在三细胞连接处。笔者在前期研究工作中发现,tricellulin在结直肠癌组织中高表达,且与结直肠癌肿瘤浸润深度、TNM分期、淋巴结转移和远处转移有关[6],但是其异常表达对肿瘤的生物学行为产生影响,目前作用机制尚不明确。
肿瘤的侵袭转移是一个复杂的、多阶段的过程[12]。内皮细胞构成了血管的内层,参与了血管生成的关键环节,是肿瘤治疗的重要靶点之一[13]。血管生成与肿瘤细胞侵袭转移密切相关。肿瘤细胞生长必须依赖血管的生成来提供必要的营养物质和氧气[14],此外,肿瘤细胞可分泌蛋白降解酶类(如MMPs),降解细胞外基质(ECM)后形成肿瘤细胞移动的通道,肿瘤细胞穿透ECM,并穿透血管壁的基底膜进入血液循环,从而实现远处转移[15]。MMPs作为目前已知能降解细胞外基质的重要酶类,在介导肿瘤血管新生、转移和侵袭等过程中发挥重要作用[16]。本研究通过基因工程技术调控tricellulin的表达发现,过表达tricellulin可增强结直肠癌细胞HCT116的侵袭能力,并且其上清液可增加HUVEC细胞的侵袭能力,可能是通过增加MMP2、MMP7的表达来实现的。综上所述,结直肠癌细胞过表达tricellulin可能通过调控MMP2、MMP7的表达促进HUVEC细胞的侵袭能力。本研究为探索tricellulin调控结直肠癌侵袭转移提供了新的理论依据,但仍需更深入的探索。
4 结论
结直肠癌中过表达tricellulin可能通过MMP2、MMP7调控HUVEC细胞的侵袭能力,可能与肿瘤血管生成密切相关。Tricellulin有望成为结直肠癌治疗的分子靶点。
