稻瘟病菌无毒效应因子Avr-PikD与水稻蛋白OsDjA9的互作鉴定
2022-08-12郭嘉媛洪永河黄健强吴亦灵王宗华陈松彪陈晓峰
郭嘉媛,洪永河,黄健强,吴亦灵,王宗华,陈松彪,陈晓峰
(1.闽江学院地理与海洋学院,福建 福州 350108;2.福建农林大学植物保护学院,福建 福州 350002)
0 引言
【研究意义】水稻(Oryza sativa)是世界上最重要的粮食作物之一,养育着世界50%以上的人口,更是我国65%以上人口的主食,其产量及生产安全关乎国计民生。而由稻瘟病菌(Magnaporthe oryzae)引起的稻瘟病常年危害水稻生产,据统计,平均每年因稻瘟病导致的全球水稻产量损失可达10%~30%[1−2]。可见,稻瘟病是全球范围内粮食生产中的重要限制因子,是全球粮食安全治理的重中之重,系统、深入地解析稻瘟病菌的致病机理对稻瘟病的绿色防控具有重要意义。【前人研究进展】与其他病原微生物相似,稻瘟病菌在侵染过程中会分泌效应因子到宿主细胞内或细胞间隙,通过改变宿主细胞正常的生命活动,例如免疫反应和新陈代谢,来促进对宿主的侵染[3−4]。无毒效应因子(avirulence effector,AVR effector)是一类特殊的效应因子,由无毒基因编码,它们除了具有调节宿主免疫反应等一般效应因子的功能,还能直接或间接地被宿主的抗病蛋白(resistance protein)所识别,从而激发宿主ETI反应(effector-triggered immunity)。因此,稻瘟病菌无毒效应因子一直都是稻瘟病菌致病机理研究中的重点和热点。迄今为止,稻瘟病菌中被成功克隆的无毒基因仅有12个[5],而很长一段时间内关于无毒基因的研究主要集中在新无毒基因的克隆及已克隆无毒基因的变异机理上,在其功能机理方面缺乏系统而深入的研究,目前仅有AvrPiz-t、Avr-Pii与Avr-Pita的水稻靶标有研究报道[6−14],如表1所示。最近有研究显示,AvrPiz-t、Avr-Pii、Avr-Pia、PWL2、Avr-Pi9、Avr-PikC和Avr-PikD等都可与水稻去泛素化酶PIC1互作,其中Avr-Pi9可通过降解PICI1来抑制水稻免疫反应[15]。总而言之,当前有关稻瘟病菌无毒效应因子作用机理的了解和认识仍十分有限,尚不足以支撑我们将已获得的理论数据广泛地与日新月异的分子育种技术相结合以指导水稻抗病育种。AVR-Pik/Pik是稻瘟病菌与水稻互作系统中的一对编码产物可直接相互作用的无毒基因/抗病基因组合。稻瘟病菌无毒基因AVR-Pik具有多个等位基因,群体进化分析结果显示,AVR-PikD是最为常见的,也是进化上最原始的[16]。水稻抗病基因Pik同样也是一个复等位基因,每个等位基因均由两个紧密连锁、走向相反的ORF组成,分别编码Pik-1与Pik-2,二者功能相对独立。无毒效应因子Avr-Pik能与Pik-1直接互作,而Pik-2则与ETI反应的激活有关,它能与Pik-1直接互作,使得抗病反应信号从Avr-Pik传递给了Pik-2,从而激活特异的ETI反应[17]。【本研究切入点】目前,对AVR-PikD的研究几乎都集中在其与Pik的共进化关系方面,而对Avr-PikD作用的宿主靶标及其在稻瘟病菌致病过程中的作用机理方面鲜有研究报道。有鉴于此,我们前期借助酵母双杂交技术、以去除信号肽的Avr-PikD为诱饵筛选了接种稻瘟病菌后的水稻的均一化cDNA文库,获得了若干候选互作蛋白。【拟解决的关键问题】利用酵母双杂交、pull-down、Co-IP、荧光素酶互补成像试验以及在水稻原生质体中的共定位分析等多种方法对其中一个候选互作蛋白OsDjA9与Avr-PikD的互作关系进行验证,明确水稻蛋白OsDjA9是否为稻瘟病菌无毒效应因子Avr-PikD的作用靶标,为进一步揭示稻瘟病菌无毒效应因子 Avr-PikD的作用机理奠定基础。
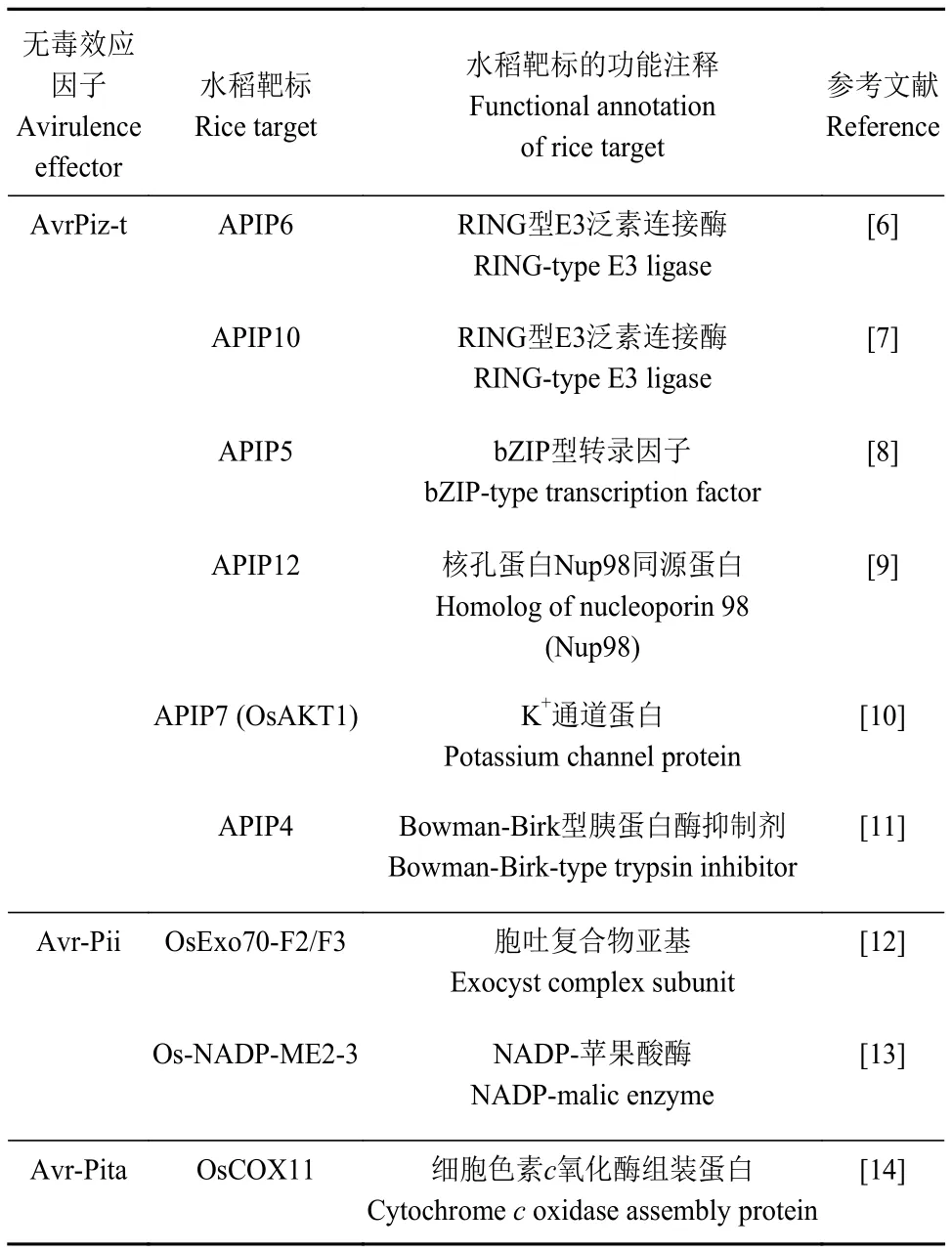
表1 目前已知的稻瘟病菌无毒效应因子的水稻靶标Table 1 Currently known rice targets for AVR effectors of M.oryzae
1 材料与方法
1.1 酵母双杂交试验
以水稻品种日本晴的总cDNA为模板、使用引物Y2H-F/R(表2)扩增获得OsDjA9的全长CDS片段,并亚克隆进pGADT7载体获得重组质粒pGADT7-OsDjA9,经测序鉴定无误后,与筛库用的诱饵质粒pGBKT7-AvrPikDNS(无信号肽Avr-PikD)共转化酵母菌株AH109感受态细胞(试验组),同时分别以pGADT7-RecT与pGBKT7-53、pGADT7-RecT与pGBKT7-Lam、pGADT7-OsDjA9与pGBKT7以及pGADT7与pGBKT7-AvrPikDNS等组合进行的共转化为对照组。酵母感受态细胞的制备及转化使用 Invitrogen 公司的S.c.EasyCompTMTransformation Kit,具体方法参见试剂盒说明书。将转化产物均匀涂布于SD/-Leu/-Trp平板筛选共转成功的阳性克隆子,而后随机挑选若干阳性克隆子培养并调整细胞含量分别达到 106、104和 103个·mL−1,分别取 5 μL 不同浓度菌液点滴接种至 SD-Leu/-Trp 和含有 10 mmol·L−13-AT的SD/-Ade/-His/-Leu/-Trp/X-α-Gal平 板上,于30 ℃恒温培养箱中倒置培养3~5 d后,观察菌落生长与显色情况。若菌落能在SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板上正常生长且显蓝色,则表明Avr-PikD能与OsDjA9发生互作。

表2 本研究所用引物序列Table 2 Sequences of primers used in this study
1.2 Pull-down 试验
使用引物GST-F/R、MBP-F/R分别扩增Avr-PikDNS与OsDjA9的CDS片段,并分别亚克隆进含有GST标签的载体pGEX-4T-1与含有MBP标签的载体pMAL-c2X,获得重组融合表达载体GSTAvrPikDNS与MBP-OsDjA9,经测序鉴定无误后,转化到大肠杆菌菌株BL21的感受态细胞中。获得相应阳性克隆后,通过IPTG诱导表达并纯化出GST-AvrPikDNS蛋白、MBP-OsDjA9蛋白以及作为对照的GST蛋白、MBP蛋白后,将结合有GSTAvrPikDNS蛋白的GST磁珠分别与纯化的MBPOsDjA9蛋白(试验组)和MBP蛋白(对照组)混匀,将结合有GST蛋白的GST磁珠与纯化的MBPOsDjA9蛋白混匀(对照组),4 ℃孵育过夜后,通过蛋白免疫印迹试验(western blot),并分别使用GST抗体和MBP抗体检测各组洗脱液中所含的蛋白。若试验组能同时检测到GST-AvrPikDNS与MBP-OsDjA9两种蛋白,而对照组只能分别检测到原先磁珠上结合的诱饵蛋白,则表明Avr-PikD能与OsDjA9在体外发生互作。
1.3 Co-IP 试验及亚细胞共定位分析
使用引物GFP-F/R、RFP-F/R分别扩增OsDjA9与Avr-PikDNS的CDS片段,并分别亚克隆进含有GFP标签的载体pRTVcGFP与含有RFP标签的载体pRTVcRFP,获得重组融合表达载体OsDjA9-GFP与AvrPikDNS-RFP,经测序鉴定无误后,参照水稻原生质体遗传转化的方法[18],分别将OsDjA9-GFP与AvrPikDNS-RFP(试验组)以及OsDjA9-GFP与空载体pRTVcRFP(对照组)共转进水稻原生质体中。室温孵育18~24 h后收集原生质体,一方面,借助激光共聚焦显微镜观察OsDjA9与Avr-PikDNS的定位情况;另一方面,提取水稻原生质体总蛋白,向其中加入适量GFP磁珠,4 ℃孵育过夜后,通过western blot,并分别使用GFP抗体和RFP抗体检测试验组和对照组洗脱液中所含的蛋白。若激光共聚焦显微镜能观察到OsDjA9与Avr-PikDNS存在共定位情况,且western blot在试验组能同时检测到OsDjA9-GFP与AvrPikDNS-RFP两种蛋白,而在对照组只能检测到OsDjA9-GFP蛋白,则表明Avr-PikD能与OsDjA9在水稻细胞内进行互作。
1.4 荧光素酶互补成像试验
使用引物NLuc-F/R、CLuc-F/R分别扩增Avr-PikDNS与OsDjA9的CDS片段,并分别亚克隆进pCAMBIA1300-NLuc与pCAMBIA1300-CLuc载 体,获得重组融合表达载体NLuc-AvrPikDNS与CLuc-OsDjA9,经测序鉴定无误后,将二者及两个空载分别导入根癌农杆菌菌株GV3101。获得相应阳性克隆后,参照农杆菌介导的烟草瞬时表达方法[6],将NLuc-AvrPikDNS与CLuc-OsDjA9( 试 验 组)、pCAMBIA1300-NLuc与pCAMBIA1300-CLuc(阴性对照组)、NLuc-AvrPikDNS与pCAMBIA1300-CLuc(阴性对照组)、pCAMBIA1300-NLuc与CLuc-OsDjA9(阴性对照组)以及NLuc-AvrPiz-t与CLuc-APIP5(阳性对照组)两两混匀后共注射至生产旺盛期的本氏烟叶背面,22 ℃黑暗培养48 h后,在叶片上均匀涂布荧光素酶底物D-荧光素,置于植物活体成像仪观察荧光。若只有试验组和阳性对照组可观察到荧光,则表明Avr-PikD能与OsDjA9在烟草细胞内进行互作。
1.5 互作相关结构域鉴定试验
借助Prosite数据库中的在线蛋白质结构域预测工具(https://prosite.expasy.org/)对OsDjA9蛋白所含保守结构域进行预测分析,而后使用结构域特异引物扩增相应CDS片段,并分别亚克隆进pGADT7载体,再通过酵母双杂交试验鉴定出OsDjA9蛋白中参与互作的关键结构域。酵母双杂交试验具体方法参见1.1。
2 结果与分析
2.1 酵母双杂交试验验证 Avr-PikD 与 OsDjA9 的互作
为了明确无毒效应因子Avr-PikD与水稻蛋白OsDjA9之间的互作关系,我们首先通过酵母双杂交试验进行验证。结果如图1所示,所有对照组及试验组的转化产物均能在SD/-Leu/-Trp平板上正常生长,表明所有组合质粒均成功导入酵母细胞;阴性对照组(pGADT7-RecT+pGBKT7-Lam)及自激活验证对照组(pGADT7-OsDjA9+pGBKT7、pGADT7+pGBKT7-AvrPikDNS)的转化产物在含有 10 mmol·L−13-AT的SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板上没有生长迹象,只有阳性对照组(pGADT7-RecT+pGBKT7-53)及试验组(pGADT7-OsDjA9+pGBKT7-AvrPikDNS)的转化产物在SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板上能够生长正常且菌落呈现蓝色,表明在酵母双杂交系统中Avr-PikD能与OsDjA9发生相互作用。
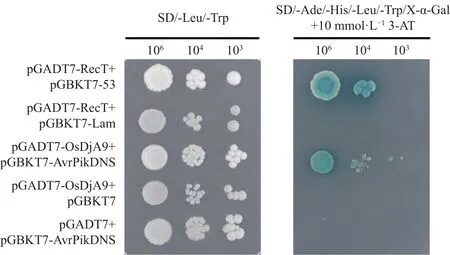
图1 酵母双杂交验证Avr-PikD与OsDjA9的互作关系Fig.1 Interaction between Avr-PikD and OsDjA9 verified by yeast two-hybrid assay
2.2 Pull-down 试验验证 Avr-PikD 与 OsDjA9 的互作
由于酵母双杂交系统较易出现假阳性结果,因此,我们接着通过pull-down试验对Avr-PikD与OsDjA9之间的互作关系进行验证。结果如图2所示,当分别用GST与MBP抗体进行检测时,Input中对照组与试验组所检测出的蛋白组分均与试验设置相符,表明相关试验操作过程无误;pull-down中两个对照组均未检测到待测融合蛋白,表明单一的MBP标签或GST标签均无法与待测融合蛋白互作,而只有试验组能同时检测到两个待测融合蛋白组分,表明Avr-PikD能与OsDjA9在体外条件下发生相互作用。
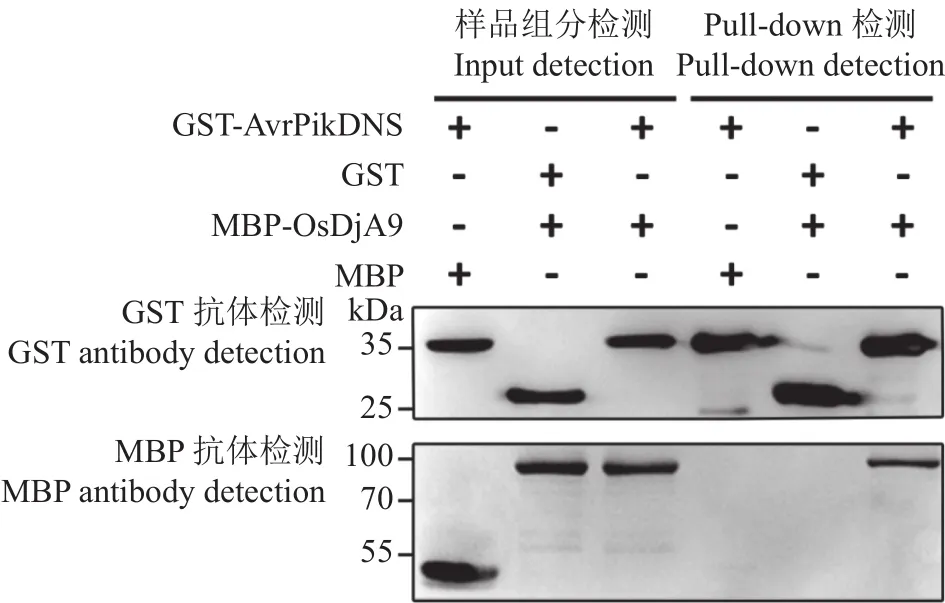
图2 Pull-down验证Avr-PikD与OsDjA9的互作关系Fig.2 Interaction between Avr-PikD and OsDjA9 verified by pull-down assay
2.3 Co-IP 及亚细胞共定位分析验证 Avr-PikD 与OsDjA9的互作
为了明确Avr-PikD与OsDjA9在植物细胞内是否会发生相互作用,我们通过水稻原生质体瞬时表达系统分别进行Co-IP验证及亚细胞共定位分析。如图3所示,当OsDjA9与无信号肽Avr-PikD在水稻原生质体中共表达时,二者在水稻细胞质中呈现点状的共定位模式。随后,提取了水稻原生质体总蛋白,并分别用GFP与RFP抗体进行检测,结果如图4所示,Input中对照组与试验组所检测出的蛋白组分均与试验设置相符,表明共转化水稻原生质体后相关蛋白表达正常;IP中当OsDjA9-GFP与RFP共表达时,无法检测到RFP条带,表明单一的RFP蛋白不会与OsDjA9-GFP发生相互作用;只有当OsDjA9-GFP与AvrPikDNS-RFP共表达时,才能同时检测到两个待测融合蛋白的条带。以上结果表明,Avr-PikD与OsDjA9能在水稻细胞内发生相互作用。
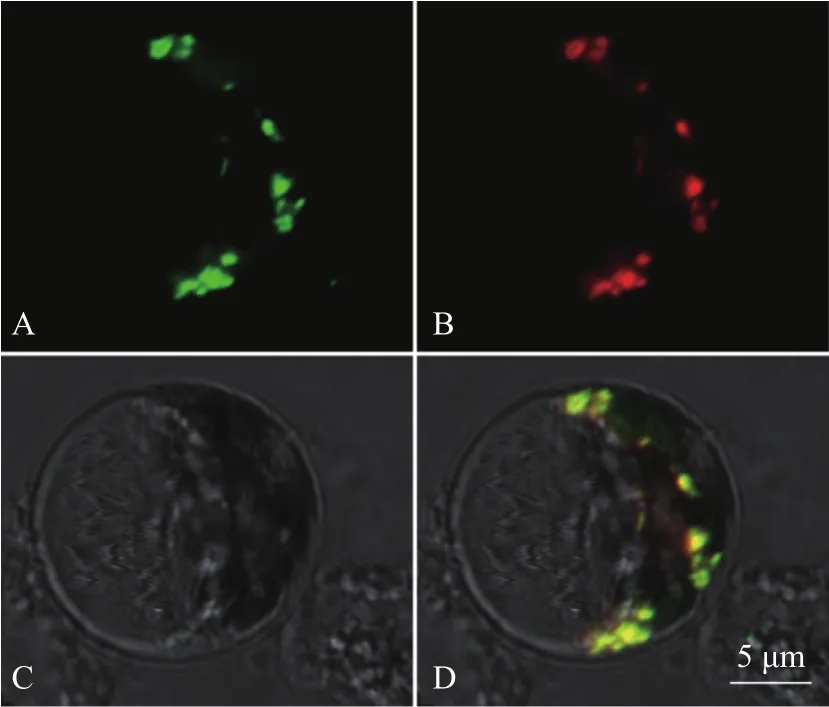
图3 Avr-PikD与OsDjA9在水稻原生质体中的共定位分析Fig.3 Co-localization analysis between Avr-PikD and OsDjA9 in rice protoplasts
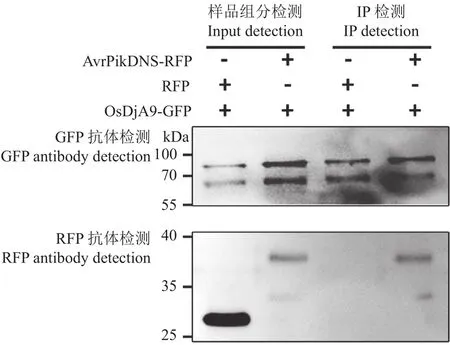
图4 Co-IP验证Avr-PikD与OsDjA9的互作关系Fig.4 Interaction between Avr-PikD and OsDjA9 verified by Co-IP assay
2.4 荧光素酶互补成像试验验证 Avr-PikD 与 OsDjA9的互作
荧光素酶互补成像(Luciferase complementation imaging,LCI)试验近年来在蛋白互作研究中被广泛使用,具有高灵敏度、可量化等特点,因此,我们也通过LCI试验对Avr-PikD与OsDjA9的互作进行了鉴定。结果如图5所示,所有与含空载体的农杆菌转化子共注射的阴性对照组均未检测到荧光信号,只有共表达NLuc-AvrPikDNS与CLuc-OsDjA9的试验组能检测到明显的荧光信号,且荧光强度与共表达NLuc-AvrPiz-t与CLuc-APIP5的阳性对照组相当,表明Avr-PikD与OsDjA9也能在烟草细胞内发生相互作用。
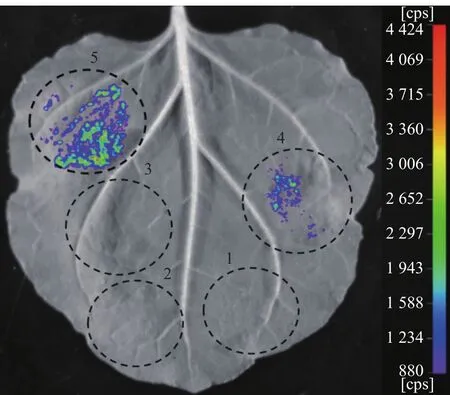
图5 荧光素酶互补成像试验验证Avr-PikD与OsDjA9的互作关系Fig.5 Interaction between Avr-PikD and OsDjA9 verified by LCI assay
2.5 OsDjA9 所 含 结 构 域 与 Avr-PikD 的 互 作验证
为了明确OsDjA9中参与Avr-PikD互作的结构域,首先通过Prosite数据库对OsDjA9所含结构域进行了预测分析,结果如图6-A所示,OsDjA9主要包含DnaJ结构域与CR型锌指结构域(ZF_CR)。根据结构域预测分析结果,分段进行酵母双杂交检测,结果如图6-B所示,只有DnaJ结构域所在试验组能在含有 10 mmol·L−13-AT 的 SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板上形成蓝色菌落,表明OsDjA9所含有的DnaJ结构域,即氨基酸第75-140位的部分,是其与Avr-PikD互作所必需的。

图6 酵母双杂交验证Avr-PikD与OsDjA9不同结构域之间的互作关系Fig.6 Interactions between AvrPikD and different domains of OsDjA9 identified by yeast two-hybrid assay
3 讨论与结论
稻瘟病菌无毒效应因子与稻瘟病菌致病性、水稻抗瘟持久性密切相关,是揭示稻瘟病菌致病机理及其与水稻互作机理的关键所在。本研究从筛选水稻cDNA文库获得的稻瘟病菌无毒效应因子Avr-PikD候选互作蛋白中挑选OsDjA9蛋白,通过酵母双杂交、pull-down、Co-IP、LCI等一系列试验分析,证实了OsDjA9在体外、体内条件下均能与Avr-PikD发生相互作用,是Avr-PikD的一个作用靶标。后续通过对OsDjA9的生物学功能及其与Avr-PikD的互作机理进行系统研究,有望揭示Avr-PikD在稻瘟病菌致病过程中的作用机理。
OsDjA9是水稻DnaJ热激蛋白家族中的一员,DnaJ家族蛋白广泛存在于各类植物中,在植物响应生物及非生物胁迫过程中发挥着重要作用。例如,在烟草中过量表达番茄的DnaJ蛋白LeXDJ2不仅能够增强烟草对干旱胁迫的抗性,同时转基因烟草对青枯假单胞菌(Pseudomonas solanacearum)的抗性也显著增强[19]。在水稻中,DnaJ蛋白OsDjA6在水稻与稻瘟病菌亲和互作过程中被诱导表达,是水稻PTI反应的负调控元件,其可能通过E3泛素连接酶OsZFP1来调节SA信号途径介导的免疫反应[20]。而在棉花中,WAK样激酶GhWAKL可通过与DnaJ蛋白GhDNAJ1互作调控棉花对大丽轮枝菌(Verticillium dahliae)的抗性,GhDNAJ1基因沉默突变体对大丽轮枝菌的感病性显著增强[21]。研究发现,稻瘟病菌一个能诱导细胞凋亡的效应因子MoCDIP4可通过靶向OsDjA9蛋白来调控水稻线粒体内稳态及免疫反应[22−23]。在正常生理条件下,OsDjA9可与线粒体动力蛋白相关蛋白OsDRP1E互作,并通过自噬降解途径来精细调控OsDRP1E的蛋白水平,进而维持线粒体内稳态;而在稻瘟病菌侵染水稻的过程中,稻瘟病菌分泌的效应因子MoCDIP4能通过与OsDRP1E竞争结合OsDjA9,阻碍OsDjA9对OsDRP1E的降解,致使OsDRP1E在线粒体中异常积累、线粒体过度分裂,最终引起水稻严重的免疫缺陷[23]。
在本研究中,水稻原生质体共定位分析显示Avr-PikD与OsDjA9在细胞质中呈现点状的共定位模式,但具体所在亚细胞结构尚无法确定,而依据OsDjA9与MoCDIP4在内质网中互作、与OsDRP1E在线粒体中共同调控线粒体内稳态[23],后续可分别借助水稻内质网及线粒体的定位Marker进行精细定位来判定Avr-PikD与OsDjA9互作所发生的具体亚细胞结构。本研究的酵母双杂交分段测试结果显示,DnaJ结构域是OsDjA9与Avr-PikD互作所必需的,而该结构域也在OsDjA9促进OsDRP1E降解的过程中发挥至关重要的作用[23],预示着Avr-PikD也很可能通过抑制OsDjA9对OsDRP1E的降解来干扰水稻的免疫反应,后续可在构建AVR-PikD转基因水稻的基础上通过检测转基因水稻中OsDRP1E的降解情况及线粒体的形态观察等加以验证。此外,作为水稻抗瘟性的正向调控元件,OsDjA9已被证实是稻瘟病菌两个效应因子的作用靶标,后续在水稻抗稻瘟病的分子育种中可能需要引起重视。
