兰州鲇性腺型芳香化酶cyp19a1a基因克隆及表达定位分析
2022-08-12李敏敏俞兆曦张利平刘彦斌赛清云田永华吴旭东连总强
李敏敏,俞兆曦,张利平,刘 凯,肖 伟,刘彦斌,赛清云,田永华,吴旭东,3,4 *,连总强 *
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.宁夏回族自治区水产研究所,宁夏 银川 750001;3.宁夏渔业工程技术研究中心,宁夏 银川 750001;4.宁夏渔业科技院士工作站,宁夏 银川 750001)
0 引言
【研究意义】大多数脊椎动物为雌雄异体,其子代主要通过两种方式决定性别:基因型性别决定(GSD)和环境性别决定(ESD)[1,2]。GSD通过具有性别差异的遗传因素驱动,可以分为3个系统:雄性染色体异配的XY型、雌性染色体异配的ZW型和染色体性别决定的多生型[2]。ESD由温度、缺氧、社会因素等环境因素影响触发。性别二态性通常被称为同一物种的雄性和雌性个体之间的差异,它与形态、解剖学、生理学、行为学和生活史等许多方面有关[3]。鱼类是脊椎动物中最丰富的类群,表现出多样化和多变的性别决定机制[3],许多鱼类已被证明在生长速度和体型等经济性状上表现出显著的性别二态性。例如,在鲤鱼(Cyprinus carpio)[4]、虹鳟(Oncorhynchus mykiss)[5]、南比目鱼(Paralichthys lethostigma)[6]和半滑舌鳎(Cynoglossus semilaevis)[7]中,雌性比雄性长得更快且体型更大,而在黄颡鱼(Pelteobagrus fulvidraco)[8]、 尼 罗 罗 非 鱼(Oreochromis niloticus)[9]、 乌 苏 里 拟 鲿(Pseudobagrus ussuriensis)[10]中,雄性比雌性长得更快且体型更大。因此,基于对性别决定与分化相关基因研究,在生长速度和体型性别二态性的鱼类中生产全雌性或全雄性种群对水产养殖具有重要的经济意义。【前人研究进展】芳香化酶(P450arom)是性类固醇激素代谢中的一种重要酶类,属于细胞色素P450家族,可催化雄激素转化为雌激素,是雌激素生物合成的关键酶和限速酶[11]。在大多数哺乳动物中,P450arom由CYP19单基因编码,但在鱼类中却发现了两种不同基因编码的P450arom,即性腺(卵巢)芳香化酶(cyp19a1a)和脑芳香化酶(cyp19a1b)。cyp19a1a作为雌激素合成的关键基因,广泛参与调控雌雄异体鱼类(如花鲈Lateolabrax maculatus[12]、鲫鲤[13]、泥鳅Misgurnus anguillicaudatus[14]等)以及雌雄同体鱼类(如斑马鱼[15]、黄鳝Monopterus albus[16]、斜带石斑鱼Epinephelus coioides[17]、青鳉Oryzias latipes[18]等)的性别分化和性腺发育过程。研究表明,雌雄异体和雌雄同体雌性先熟鱼类在卵巢分化过程中cyp19a1a表达水平显著升高,并在卵巢发育过程中持续高表达,而雌雄同体雌性先熟鱼类在性腺逆转为精巢过程中cyp19a1a表达水平显著降低,并在精巢发育期间一直保持低水平。cyp19a1a基因在鱼类性腺的表达水平很容易受到外源环境影响,如温度、性类固醇激素和芳香化酶抑制剂等。Ruksana等[19]对XX牙鲆进行芳香化酶抑制剂处理,使其卵巢逆转为精巢,并导致cyp19a1a表达水平显著降低。Vizziano等[20]研究表明通过外源雌激素(E2)处理可以将XY雄性虹鳟逆转为XY伪雌鱼,并导致cyp19a1a表达水平显著升高。Zhang等[21]对cyp19a1a功能研究表明,敲除XX罗非鱼cyp19a1a基因,使雌鱼性逆转为雄鱼,通过持续的E2处理罗非鱼cyp19a1a突变体的精巢表型成功逆转为卵巢,而在停止E2处理后又恢复精巢,因为cyp19a1a的敲除导致罗非鱼不能合成内源性雌激素。兰州鲇(Silurus lanzhouensis)又名黄河鲶,隶属于鲇形目(Siluriformes)鲇科(Siluridea)鲇属(Silurus),是我国黄河中上游特有土著经济鱼类[22],体型大、营养丰富,已成为我国重要的经济鱼类,市场需求量稳步增长[23]。与大多数鲇类相似,兰州鲇需要3年才能性成熟,且成熟雄性个体较雌性个体大1.5倍,在生长速度和体型上具有明显的性别二态性。有关兰州鲇国内已开展了种质繁育[24,25]、良种选育[26,27]与饲料营养[28,29]等相关领域研究。【本研究切入点】本项目组在兰州鲇性别决定系统研究中发现[30]其为雄性异配XX/XY性别决定系统,对偶然发现的XY基因型雌雄同体亲本进行自体精卵人工授精并成功获得了YY雄性。此基础上,需要进一步开展生长性状具有性别二态性兰州鲇cyp19a1a基因克隆及雌雄同体表达研究。【拟解决的关键问题】本研究通过同源克隆和RACE的方法获得了兰州鲇性腺型芳香化酶cyp19a1a基因的cDNA序列并进行生物信息学分析,采用qRT-PCR对cyp19a1a基因在兰州鲇雌、雄鱼和雌雄同体鱼不同组织以及兰州鲇雌、雄鱼不同发育阶段性腺表达情况进行比较分析,同时采用免疫组织化学方法对兰州鲇不同发育阶段性腺进行定位分析,以期为雌雄同体以及生长速度和体型性别二态性鱼类性别决定与分化、性腺发育与维持调控机制研究提供基础资料,为培育全雄兰州鲇良种新品种提供技术支持。
1 材料与方法
1.1 试验材料
试验所需兰州鲇于2021年8月份取自宁夏回族自治区水产研究所国家级兰州鲇原种场建设基地。取3龄的兰州鲇雌、雄鱼和雌雄同体鱼的脑、下丘脑、垂体、鳃、肌肉、胃、肠、心、肝、脾、肾、卵巢、精巢和3月龄、1龄兰州鲇卵巢和精巢组织,雌雄各两尾。取样后迅速置于液氮中速冻后−80 ℃保存用于后续RNA提取。采集3月龄、1龄和3龄兰州鲇雌、雄鱼卵巢、精巢部分组织4%多聚甲醛固定,用于免疫组织化学检测。
1.2 主要试剂
总RNA提取试剂盒和无内毒素质粒提取试剂盒均购自北京天根生化科技有限公司;DNA胶回收试剂盒购自爱思进生物技术有限公司;2×TaqPlus Master Mix(Dye Plus)购自南京诺唯赞生物科技有限公司;DH5α感受态细胞购自北京全式金生物技术有限公司;反转录试剂盒 Prime Script RT reagent Kit with gDNA Eraser(Perfect Real Time)、TB Green Premix ExTaqII、pMD18-T 克隆载体、SMARTer®RACE5′/3′Kit、DNAA-Tailing Kit试剂盒均购自大连宝生物工程有限公司;一抗购自Affinity,SP试剂盒、DAB试剂盒购自北京中杉金桥生物有限公司。
1.3 总 RNA 提取和 cDNA 合成
参照总RNA提取试剂盒用户手册,提取兰州鲇卵巢总RNA;使用1%琼脂糖凝胶电泳和微量分光光度计(ALLSHFNG,中国)检测RNA完整性和纯度;参照反转录试剂盒用户手册合成cDNA第一链,用于cyp19a1a中间序列克隆和荧光定量分析;参照 SMARTer ® RACE 5′/3′ Kit User Manual合成5′ - RACE Ready cDNA 和 3′ - RACE Ready cDNA,用于cyp19a1a5′/3′ 两端序列克隆。
1.4 cyp19a1a 全长 cDNA 克隆
首先参考斑点叉尾鮰cyp19a1a基因序列(GenBank登录号:NM_001329260.1),利用 Primer 6.0软件设计引物cyp19a1a-F和cyp19a1a-R,用于扩增cyp19a1a基因中间序列。RT-PCR反应体系总体积为25 μL,其 中 2×TaqPlus Master MixⅡ(Dye Plus)12.5 μL,cDNA 2 μL(经稀释 cDNA 的终浓度为 50 ng·μL−1),cyp19a1a-F(10 μmol·L−1)1 μL,cyp19a1a-R(10 μmol·L−1)1 μL,无菌水 8.5 μL。反应程序:94 ℃ 预变 性 3 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 2 min,34个循环;72 ℃ 再延伸 5 min。再根据已获得cyp19a1a中间序列,用Oligo7.0软件设计RACE引物,进行巢氏PCR扩增。以合成卵巢5′/3′RACE Ready cDNA为模板,使用引物cyp19a1a-5gsp1和cyp19a1a-3gsp1 与 10×Universal Primer A Mix(UPM)分别进行5′RACE和3′RACE第一次PCR扩增;取5 μL 第一次 PCR 产物稀释到 245 μL 的 Tricine-EDTA作为第二次PCR模板,相应引物为cyp19a1a-5gsp2和cyp19a1a-3gsp2 与 Universal Primer Short。琼脂糖凝胶电泳检测PCR产物,并用琼脂糖凝胶回收试剂盒回收目的产物,用DNA A-Tailing Kit试剂盒对回收目的产物进行末端加A处理,连接到pMD18-T克隆载体,转化感受态DH5α,菌落PCR筛选阳性克隆并由苏州金唯智生物科技有限公司进行测序。根据5′和3′端序列所包含重叠序列进行拼接,得到cyp19a1a基因全长cDNA序列。引物信息如表1。

表1 本研究所用引物Table 1 Primers applied
1.5 生物信息学分析
利用DNAMAN软件进行cyp19a1a序列拼接,NCBI中Blast工具进行拼接序列比对,NCBI的OFR Finder工具预测开放阅读框,Bio Edit分析核酸序列分子质量,ExPASy-ProtParam(http://www.expasy.org/)在线软件预测蛋白质理化性质,PSORTⅡPrediction(http://psort.hgc.jp/form.html)预测亚细胞定位,SignalIP(http://www.cbs.dtu.dk/services/SignalIP/)在线软件预测蛋白质信号肽,TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)、DeepTMHMM(https://services.healthtech.dtu.dk/service.php?DeepTMHMM)在线软件预 测 蛋 白 质 跨 膜 区 , Predict Protein(http://www.predictprotein.Org)在线软件预测蛋白二级结构,SWISS-MODEL(https://swissmodel.expasy.org/)预 测蛋白质的三级结构,SMART(http://smart.emblheidelberg.de/)预测蛋白质保守结构域。PROSITE(https://prosite.expasy.org/)预测蛋白质的功能域。在线软件ClustalW(https://www.ebi.ac.uk/Tools/msa/ciustalo/)将兰州鲇cyp19a1a基因编码的氨基酸序列与其他物种进行同源性比对。用MEGA11软件利用Neighbor-Joining法构建系统进化树。
1.6 组织表达分析
提取3龄兰州鲇雌、雄鱼和雌雄同体的脑、下丘脑、垂体、鳃、肌肉、胃、肠、心、肝、脾、肾、卵巢、精巢以及3月龄、1龄性未成熟兰州鲇卵巢和精巢组织总RNA,反转录合成cDNA(方法同1.3)。根据兰州鲇cyp19a1a基因序列设计荧光定量PCR引物(cyp19a1a-qF和cyp19a1a--qR,表1),将各组织 cDNA 稀释为 50 ng·μL−1,以卵巢为模板进行PCR扩增验证引物特异性及退火温度,反应条件同1.3。根据实验室前期对兰州鲇最适内参基因的分析,选取β-actin作为内参基因。采用SYBRGreenⅠ染料法,qPCR在qTOWER2.2型荧光定量扩增仪上进行,反应体系为 20.0 μL:cDNA 模板 2 μL,TB Green Premix ExTaqII 10 μL,10 μmol·L−1正反引物各 0.8 μL,ddH2O 6.4 μL;反应条件为:95 ℃ 预变性 30 s,95 ℃ 变性 5 s,60 ℃ 退火 20 s,72 ℃ 15 s,进行 40 个循环;95 ℃ 5 s,60 ℃ 15 s 反应条件绘制熔解曲线;每个样品均进行3次重复测定,每次设定一个无模板阴性对照以排除假阳性结果。采用2−ΔΔCT方法计算基因的相对表达量。
1.7 免疫组织化学检测
组织切片制备:将组织样品从4%多聚甲醛溶液取出,冲洗组织块、脱水、透明、浸蜡和包埋,制成4 μm厚石蜡切片,置于烤片机上,60 ℃烘烤6 h。免疫组织化学染色:(1)切片脱蜡至水,在pH 6.0的 0.01 mol·L−1柠檬酸盐缓冲液微波加热修复抗原15 min,自然冷却至室温。(2)滴加3%过氧化氢溶液,37 ℃作用15 min。(3)滴加正常山羊血清,室温封闭 15 min。(4)一抗孵育,4 ℃ 过夜。(5)复温 30 min,二抗孵育,37 ℃ 作用 15 min。(6)三抗孵育,37 ℃ 作用 15 min。(7)DAB 显色,在显微镜下观察并控制显色,自来水终止反应。(8)苏木精复染1.5 min,盐酸酒精分化,自来水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片。以上步骤除第三步外,其余各步骤间均用PBS洗3次,每次3 min。阴性对照用PBS代替一抗,其余步骤不变。照片均通过BA400 Digital数码三目摄像显微摄像系统进行拍摄。
1.8 数据分析
采用2−ΔΔCT法计算相对表达量,数据用“平均值±标准差(Mean±SD)”表示,以单因素方差分析ANOVA(SPSS 25.0)进行统计学分析。用GraphPadPrism8.0软件作图。
2 结果与分析
2.1 cyp19a1a 序列的分子特征
本研究采用同源克隆和RACE方法获得兰州鲇cyp19a1a全长 cDNA 序列 2168 bp,包含 4 个多聚腺苷酸化信号(AATAAA),其中 5′ 非编码区(Untranslated region,UTR)53 bp, 开 放 阅 读 框1707 bp,3′ UTR 408 bp。Cyp19a1a 编码 568 个氨基酸,包含20种标准氨基酸,其中亮氨酸(Leu,12.5%)最多,谷氨酸(Glu,7.7%)、缬氨酸(Val,7.7%)次之,色氨酸(Trp,1.1%)最少。使用ExPAsy在线软件预测Cyp19a1a蛋白分子质量为64951.89 kD,分子式为 C2 897H4 579N801O835S30,半衰期为 30 h,理论等电点6.60,不稳定系数为44.33,总平均亲水性为−0.192。Cyp19a1a亚细胞定位分析发现,该蛋白位于内质网的概率为33.3%,位于液泡、质膜的概率为22.2%,位于线粒体、高尔基体的概率均为11.1%。利用Signal IP对蛋白质信号肽分析,发现该蛋白没有信号肽。用TMHMM 2.0 Server预测结果显示,该蛋白质跨 膜螺旋数 量(Number of predicted TMHs)为0;1~568位氨基酸全部为膜外蛋白,无膜内蛋白,无跨膜结构。用DeepTMHMM对跨膜区结构进行预测,发现该蛋白质存在1个跨膜螺旋区,第47~56位氨基酸(图1)。利用 Predict Protein在线软件对兰州鲇Cyp19a1a蛋白二级结构分析,发现Cyp19a1a蛋白中α-螺旋、延伸链和无规卷曲所占的比例分别为40.49%、14.61%和44.89%。蛋白质保守结构域分析显示,兰州鲇cyp19a1a基因编码的氨基酸序列有2 个低复杂度区(Low complexity region),分别在 46~56位和513~537位。有1个P450蛋白结构域(Pfam domain),在68~508位。用PROSITE对其功能域预测发现,在450~459位存在细胞色素P450半胱氨酸血红素-铁配体识别结合位点。SWISS-MODEL在线软件对兰州鲇cyp19a1a基因编码蛋白质三级结构的预测结果如图2所示,发现其蛋白质三级结构主要由α-螺旋、无规则卷曲、β-转角以及延伸链构成。
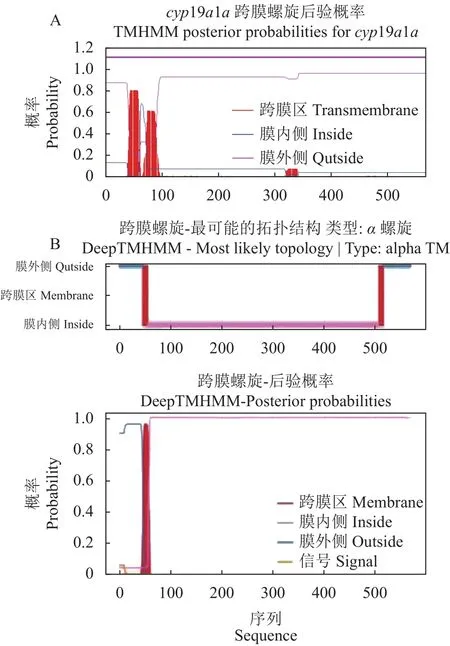
图1 兰州鲇卵巢芳香化酶的跨膜螺旋预测Fig.1 Predicted transmembrane helices of ovarian aromatase in S.lanzhouensis
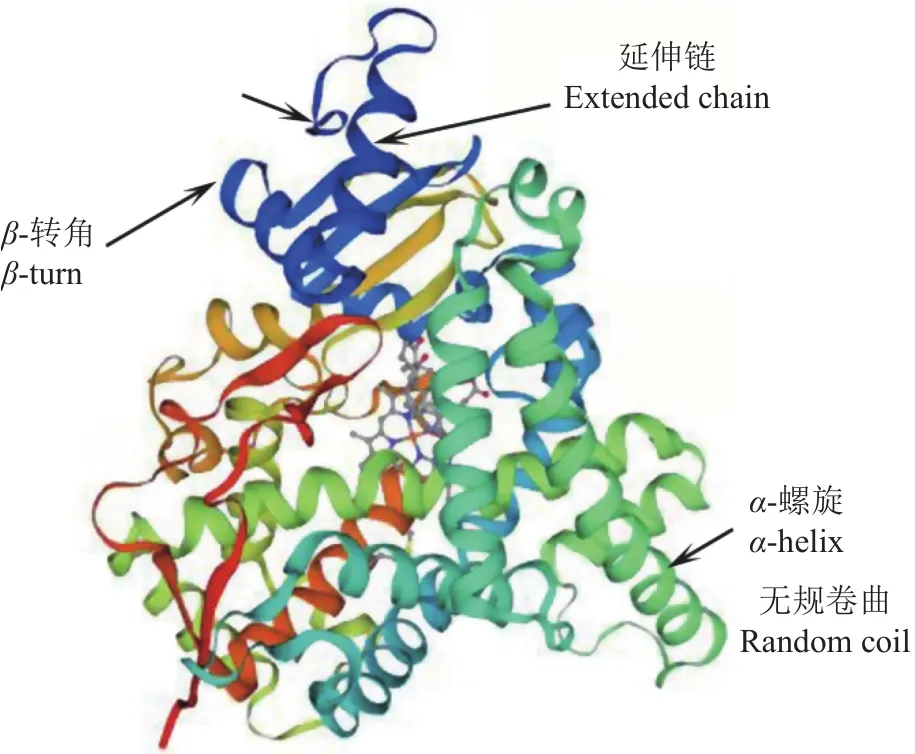
图2 预测的兰州鲇Cyp19a1a蛋白三级结构Fig.2 Tertiary structure of Cyp19a1a in S.lanzhouensis
2.2 Cyp19a1a 蛋白多序列比对和系统进化分析
从GenBank数据库中收集已发表的不同物种(两栖动物、哺乳动物、爬行动物、和硬骨鱼类)Cyp19a1a氨基酸序列,使用Clustal W与其他物种进行比较发现,在兰州鲇cyp19a1a基因中也存在芳香化酶的5个高度保守片段,分别为跨膜区、I-螺旋区(与类固醇物质结合有关)、Ozol’s肽区、芳香化酶特异保守区以及血红素结合区(图3),经Blastx在线软件分析发现Cyp19a1a氨基酸序列与南方大口鲇(Silurus meridionalis,AAP83133.1)的同源性最高(97.94%),与虎头鲨(Pangasianodon hypophthalmus,XP_034161197.1)、斑点叉尾鮰(Ictalurus punctatus,NP_001316189.1)、 黄 颡 鱼(Tachysurus fulvidraco,AKK31591.1)、印度囊鳃鲇(Heteropneustes fossilis,AID21725.1)、 蟾 胡 子 鲇(Clarias batrachus,AML79722.1)、塘鲺(Clarias fuscus,AFB77217.1)、尖齿胡鲇(Clarias gariepinus,ADH29765.1)等鲇形目鱼类的同源性分别为90.23%、89.21%、87.62%、84.7%、83.50%、64.68%、60.23%;与大盖巨脂鲤(Colossomamacropomum,XP_036420492.1)、红腹白鲳(Pygocentrus nattereri,XP_017574997.2)、电鳗(Electrophorus electricus,XP_026865672.2)的同源性分别为76.70%、76.15%、74.81%;与鲤鱼(Cyprinus carpio,XP_042599607.1)、 斑 马 鱼(Danio rerio,NP_571229.3) 、 稀 有 鮈 鲫(Gobiocypris rarus,ADB29065.1) 的 同 源 性为71.43%、70.66%、70.66%;与其他硬骨鱼类均在60%~70%。另外,Cyp19a1a氨基酸序列与人类(Homo sapiens,NP_000094.2)、小鼠(Mus musculus,NP_001335100.1)、 兔(Oryctolagus cuniculus,NP_001164392.1)、 非 洲 爪 蟾(Xenopus laevis,BAF48355.1)的同源性均为55%左右。在Cyp19a1a氨基酸序列分析的基础上,构建系统进化树(图4)。系统进化树表明兰州鲇cyp19a1a基因与鲇形目鱼类聚为一小支且与南方大口鲇同源性高,亲缘关系最近;与两栖动物、爬行动物、鸟类和哺乳动物同源性相对低。


图3 不同脊椎动物的Cyp19a1a氨基酸的同源性分析Fig.3 Homology of Cyp19a1a in different vertebrates
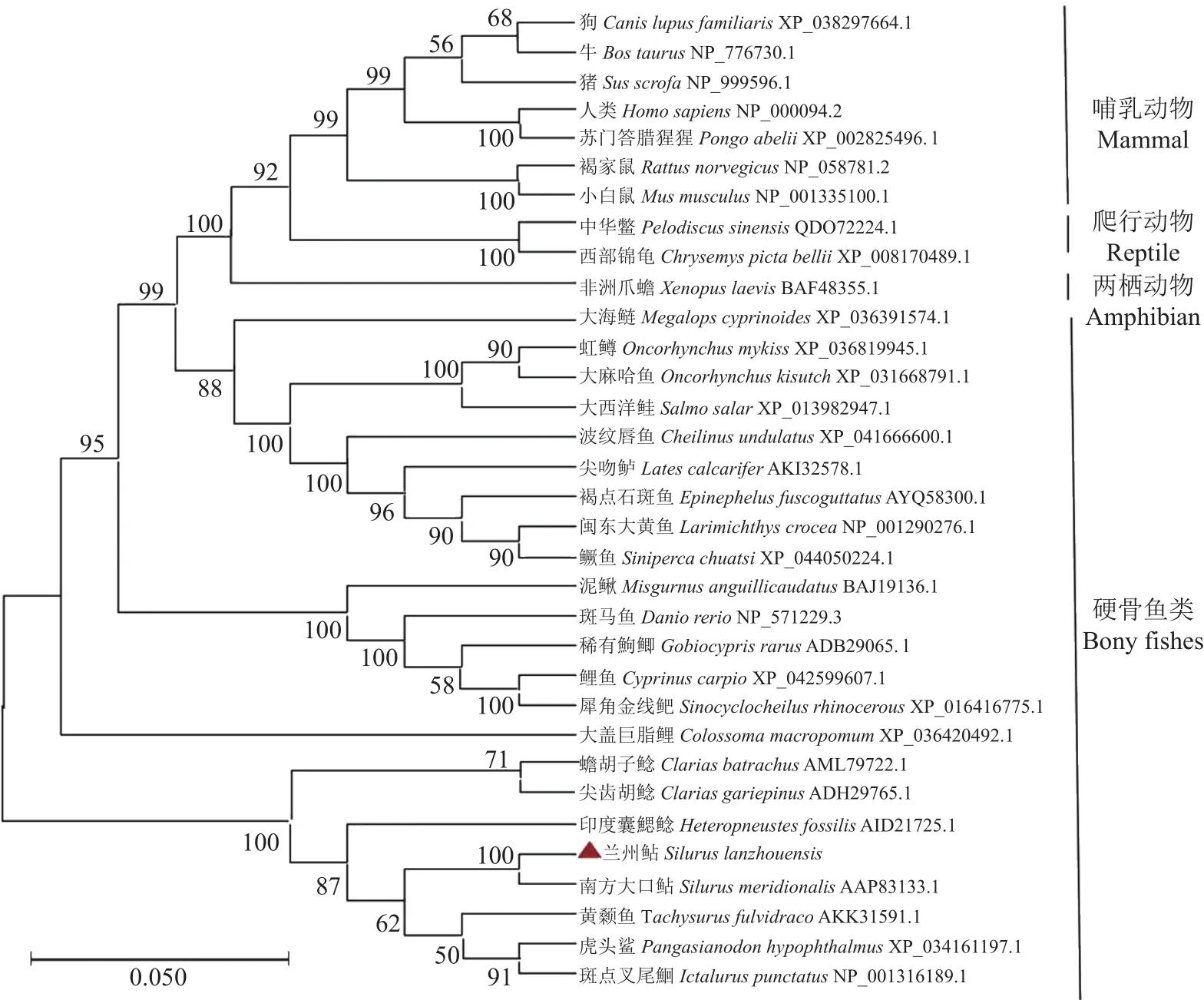
图4 cyp19a1a基因系统进化树(NJ)Fig.4 Phylogenetic trees of cyp19a1a (Neighbor-joining)
2.3 兰州鲇 cyp19a1a 基因组织表达分析
采用qRT-PCR方法检测cyp19a1amRNA在兰州鲇3龄雌鱼和雄鱼的脑、下丘脑、垂体、鳃、肌肉、胃、肠、心、肝、脾、肾、精巢、卵巢组织的表达。结果显示:cyp19a1amRNA在3龄兰州鲇雌、雄鱼性腺中的表达水平最高,且卵巢的表达水平远高于精巢(P< 0.05),而精巢的表达水平显著高于其他组织(P< 0.05),提示兰州鲇cyp19a1amRNA的表达具有组织特异性和性别二态性(图5)。对3月龄、1龄、3龄兰州鲇卵巢和精巢cyp19a1amRNA的表达分析结果表明,卵巢组织中3龄个体表达水平最高,1龄的表达水平次之,3月龄的表达水平最低,各个时期之间差异显著(P< 0.05);精巢组织中3龄兰州鲇表达水平最高且与3月龄和1龄差异显著(P< 0.05),表明cyp19a1amRNA 随着兰州鲇性腺发育表达逐渐增强(图6)。
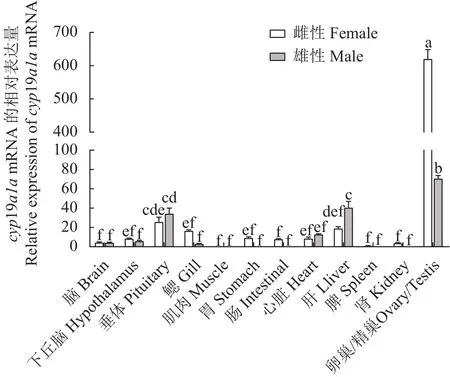
图5 cyp19a1a基因在3龄雌雄兰州鲇不同组织表达水平Fig.5 cyp19a1a expressions in different organs of 3-year-old female and male S.lanzhouensis
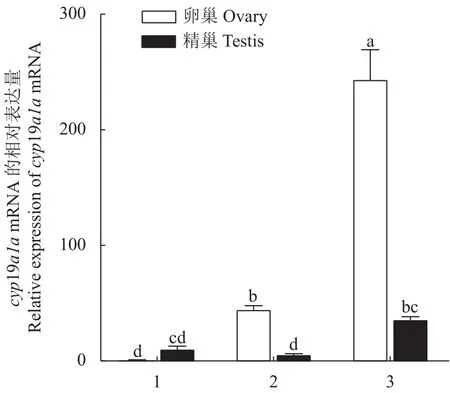
图6 兰州鲇cyp19a1a基因在不同年龄段性腺发育差异表达Fig.6 cyp19a1a expressions during gonad development of S.lanzhouensis at different ages
2.4 Cyp19a1a 蛋白在兰州鲇性腺中的细胞定位
通过石蜡切片确定3月龄、1龄、3龄兰州鲇性腺发育时期,3月龄卵巢处于Ⅱ期,由少量Ⅰ时相卵原细胞和Ⅱ时相初级卵母细胞组成;1龄卵巢处于Ⅱ期,由极少数卵原细胞和初级卵母细胞(小生长期)组成;3龄卵巢处于Ⅲ期,主要由Ⅲ时相卵母细胞组成(大生长期)。3月龄精巢处于Ⅱ期,主要由Ⅱ时相初级精母细胞组成;1龄精巢处于Ⅲ期,由少量初级精母细胞、次级精母细胞、精子细胞和精子组成;3龄精巢处于Ⅳ期,由少量次级精母细胞和精子组成。
利用免疫组织化学技术进行Cyp19a1a在3月龄、1龄、3龄兰州鲇卵巢、精巢组织中的细胞定位检测,结果显示,3月龄、1龄卵巢中的卵原细胞呈免疫阴性反应,而3月龄、1龄和3龄卵巢中卵母细胞都对Cyp19a1a显免疫阳性反应。3月龄~1龄的卵巢发育过程中初级卵母细胞免疫阳性信号逐渐增强,其主要分布于胞质。随着初级卵母细胞生长发育,在3龄兰州鲇卵巢中次级卵母细胞免疫阳性反应达到最强,其主要分布于胞质、滤泡膜以及放射膜和鞘膜细胞。Cyp19a1a在3月龄、1龄和3龄兰州鲇精巢中间质细胞呈弱阳性反应(图7)。
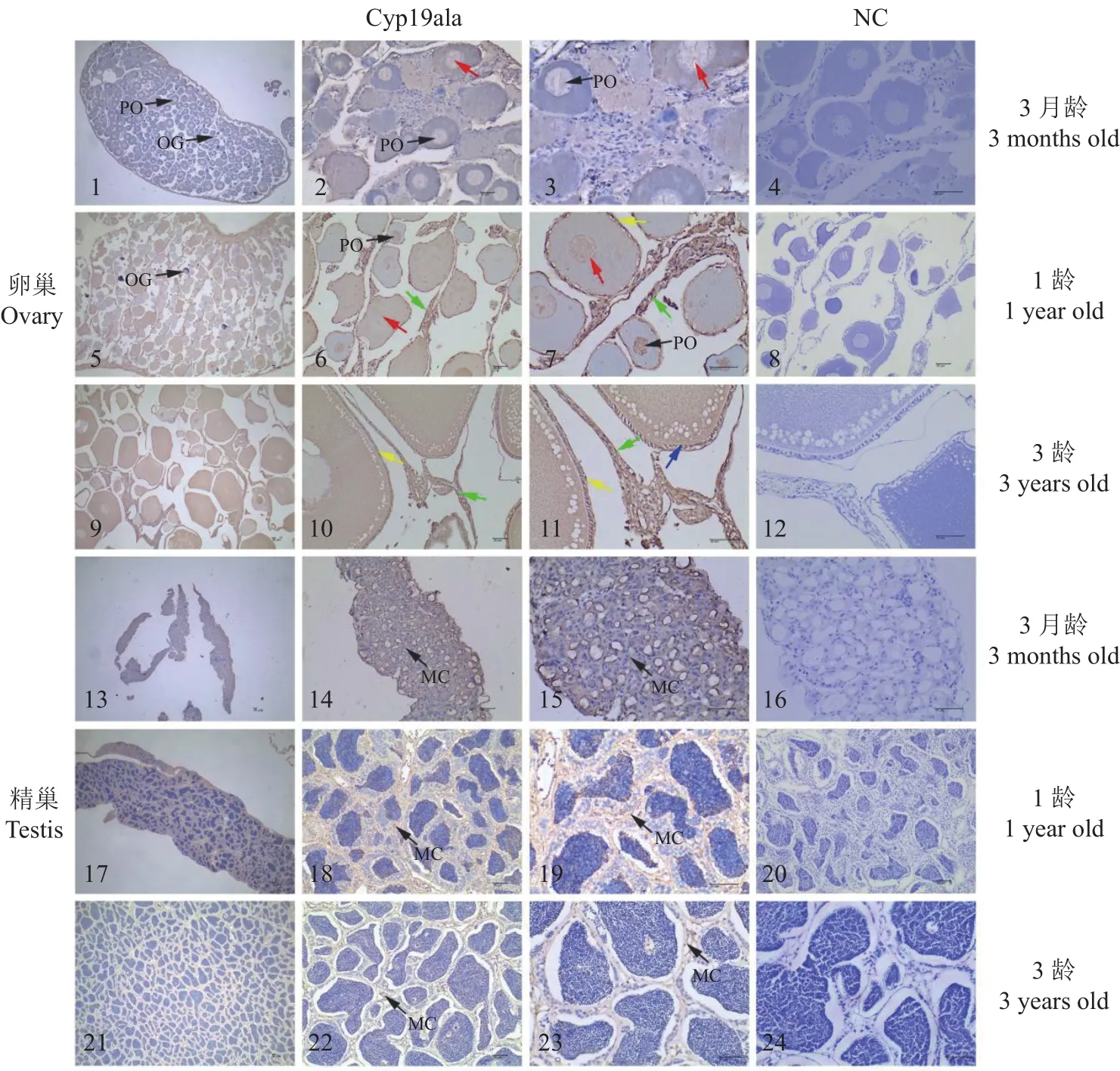
图7 Cyp19a1a在兰州鲇卵巢和精巢的细胞定位Fig.7 Cellular localizations of Cyp19a1a in ovary and testis of S.lanzhouensis
2.5 兰州鲇雌雄同体 cyp19a1a 基因组织表达分析
采用qRT-PCR方法检测cyp19a1amRNA在3龄兰州鲇雌雄同体的脑、下丘脑、垂体、鳃、肌肉、胃、肠、心、肝、脾、肾、卵巢的表达。结果显示:cyp19a1amRNA在3龄兰州鲇雌雄同体的性腺中表达水平最高,且卵巢的表达水平显著高于精巢(P< 0.05),而精巢的表达水平显著高于其他组织,在脑、下丘脑、垂体等组织仅检测到微量表达,提示兰州鲇雌雄同体cyp19a1amRNA的表达具有组织特异性(图8)。cyp19a1amRNA在3龄兰州鲇雌雄同体和雌雄鱼性腺的表达结果显示,雌雄同体和雌鱼在卵巢中高表达,且两者差异不显著(P >0.05),而在雌雄同体和雄鱼精巢的表达远低于卵巢(P< 0.05),且两者精巢组织差异不显著(P>0.05)(图9)。
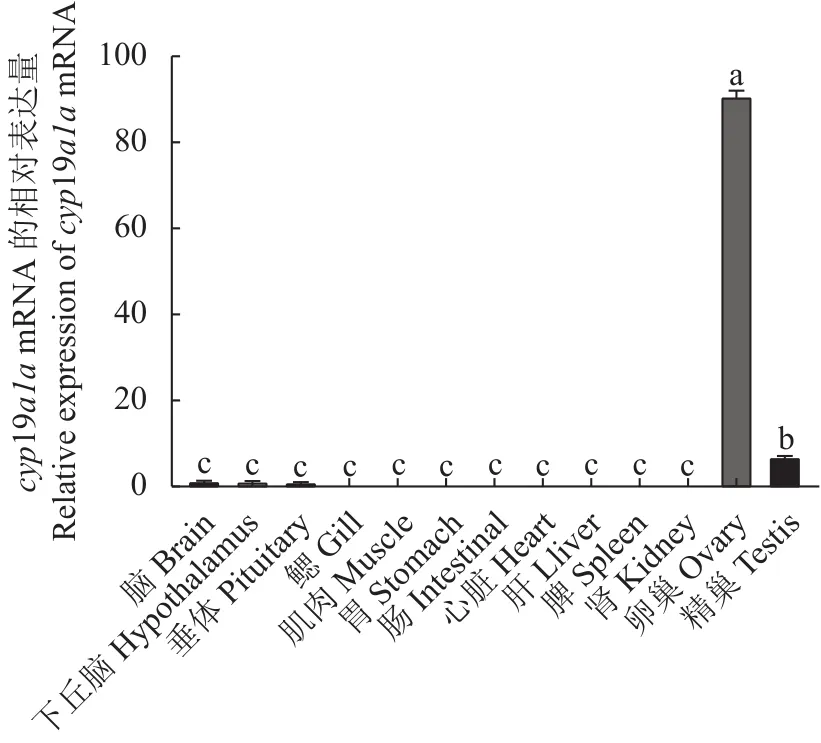
图8 cyp19a1a基因在3龄兰州鲇雌雄同体不同组织表达差异Fig.8 Expression of cyp19a1a in different organs of 3-year-old hermaphroditic S.lanzhouensis
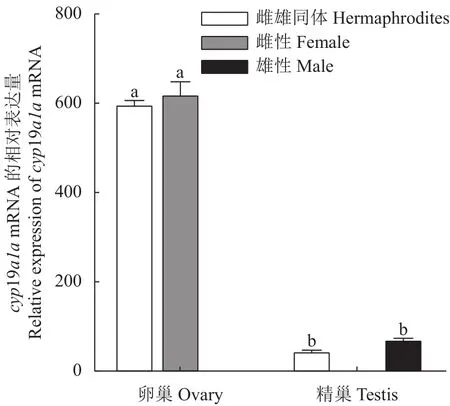
图9 cyp19a1a基因在3龄兰州鲇雌雄同体和雌雄异体性腺表达水平Fig.9 Expression of cyp19a1a in gonads of 3-year-old hermaphroditic and gonochoristic S.lanzhouensis
3 讨论
为研究兰州鲇性腺型芳香化酶cyp19a1a基因,从兰州鲇卵巢组织中分离出cyp19a1acDNA全长序列。对编码氨基酸序列进行亚细胞定位、信号肽、跨膜螺旋、疏水性/亲水性以及蛋白质一级、二级、三级结构、保守区域进行分析,与其他脊椎动物cyp19a1a基因进行序列比对、氨基酸序列同源性以及系统进化树分析,可确定所克隆基因全长是卵巢芳香化酶基因。该基因含有典型cyp19基因保守的跨膜区、Ⅰ-螺旋区(与类固醇物质结合有关)、Ozol's肽区、芳香化酶特异保守区以及血红素结合区。这些区域在大多数脊椎动物中高度保守,并负责CYP19的结合和催化活性。基于序列保守性,推测cyp19基因与其他物种具有相似的结合和催化活性并且发挥着极其重要的生理功能。系统发育树表明兰州鲇cyp19a1a与南方大口鲇亲缘关系最近,与其他鲇形目鱼类处于同一进化分支上,说明鲇形目鱼类中Cyp19a1a蛋白具有高度保守性;进化分析结果与传统的分类基保持一致,符合脊椎动物的进化规律。
在脊椎动物中,cyp19a1a基因的表达模式表现出明显的性别二型性。本研究通过qRT-PCR检测发现cyp19a1amRNA在3龄兰州鲇雌鱼卵巢中高表达,在精巢的表达量也远高于除卵巢外的其他组织。这与非洲爪蟾[31]、稀有鮈鲫[32]和黄鳝[18]等的研究结果相似。这是由于较高的cyp19a1a可以加速雌激素合成,而雌激素在鱼类卵巢分化与维持等方面起着至关重要的作用[33]。Kitano等[34]在对比目鱼性腺分化过程中发现,cyp19a1a在性腺中低表达是形成精巢的必要条件。因此推测cyp19a1a在兰州鲇精巢低表达很可能在精巢形成和维持方面发挥了促进作用。此外,cyp19a1a在兰州鲇脑、下丘脑、垂体、心脏、肝等组织中也有微量表达。尽管cyp19a1amRNA的主要表达部位是性腺,但其组织表达在不同鱼种之间并不总是一致的。例如,cyp19a1a在斑马鱼[17]的卵巢、脑和眼中表达,在裸盖鱼(Anoplopoma fimbria)[35]的卵巢、精巢和垂体中表达,而在泥鳅[16]脑、性腺、肝脏中表达。事实上cyp19a1a表达不仅在不同的组织中、雌雄之间表现出不同的特异性,而且在繁殖季节与非繁殖季节、不同发育阶段之间也表现出不同的特异性[36]。因此,本研究中cyp19a1a在兰州鲇性腺不同发育阶段的表达结果观察到3龄兰州鲇卵巢中cyp19a1amRNA的表达水平最高,其次是1龄,3月龄表达量最低,表明cyp19a1a可能在卵巢发育过程中发挥了重要作用。研究表明卵巢芳香化酶的表达量决定着硬骨鱼卵巢发育及其成熟[37]。而在兰州鲇精巢中,3龄兰州鲇精巢中cyp19a1amRNA的表达水平最高,1龄和3月龄表达量低,这一结果推测其和精巢发育过程中精子生成有关。Callard[38]在研究精子生成过程中类固醇激素的作用时发现,在精子生成末期,血清中雌激素早于雄激素先达到峰值或与雄激素同时达到峰值。
免疫组织化学定位分析发现,兰州鲇Cyp19a1a在3月龄卵巢中的卵原细胞呈免疫阴性反应,而在3月龄、1龄和3龄卵巢的卵母细胞显免疫阳性反应。Cyp19a1a在3月龄到1龄卵巢发育过程中,初级卵母细胞信号逐渐增强且主要分布在卵母细胞的胞质;随着初级卵母细胞的生长发育,在3龄卵巢中其信号达到最强且主要分布在初级卵母细胞的胞质、滤泡膜以及放射膜。相关研究表明,Cyp19a1a在鳉鱼(Fundulus heteroclitus)[39]、斑马鱼[40]和大西洋黄鱼[41]卵母细胞中高表达,而在卵黄发生前期和卵黄发生阶段的卵泡细胞层表达较少。同时,Dong等[39]发现Cyp19a1a的表达主要定位于鳉鱼发育过程中的初级生长阶段卵母细胞的卵浆中,随着卵母细胞的发育直至卵黄生成,Cyp19a1a的信号逐渐减弱。本试验中Cyp19a1a在不同发育阶段卵细胞的表达与上述卵黄发生前的卵母细胞中高表达的结果一致,表明在卵母细胞发育过程中,芳香化酶高活性能够加速催化雄激素转化为雌激素,雌激素可以促进卵母细胞发育,刺激卵母细胞中卵黄物质的积累,从而使卵子发育顺利进行,表明芳香化酶的活性对兰州鲇卵母细胞的生长发育有重要作用。在3月龄、1龄、3龄精巢组织中,发现Cyp19a1a在间质细胞有阳性反应,这与在斑点叉尾鮰[42]、虹鳟[43]和刺魟(Dasyatis akajei)[44]中的研究结果一致。间质细胞能够合成和分泌雄激素,同时也是雄激素作用的靶细胞,因此可以进一步推测cyp19a1a具有促进精巢的发育和精子发生的作用。
众所周知,在硬骨鱼类中,雌二醇和甲基睾酮是主要的雌激素和雄激素。调控这些性类固醇激素可以诱导许多雌雄同体发生性别转化[33]。Devlin[33]和Kroon[45]等认为芳香化酶(一种将雄激素转化为雌激素的类固醇生成酶)是调节雌雄同体、原性和双向物种性别分化的关键酶。本研究通过qRT-PCR检测cyp19a1a基因在兰州鲇雌雄同体不同组织的表达以及雌雄同体与雌、雄鱼性腺的表达对比分析,发现鲇雌雄同体兰州鲇和正常兰州鲇表达模式一致,两者主要在是性腺中表达,且在卵巢中的表达远高于精巢。而cyp19a1a基因在雌雄同体和正常雌雄兰州鲇性腺的表达差异均不显著。以上结果表明,cyp19a1a基因对兰州鲇雌雄鱼和雌雄同体鱼的调控作用是一致的。在硬骨鱼中,已经记录了1500多种雌雄同体的鱼类[46]。大多数雌雄同体鱼类主要有3种性别转变形式,即原雌体(雌鱼到雄鱼的性别变化)、原雄鱼(雄鱼到雌鱼的性别变化)以及一系列的双向性别变化[47]。相反,同时的两性现象只存在于以下两个鱼种中:红树林鱂鱼(Kyptolebias marmoratus)和 横 带 低 纹 鮨(Hypoplectrus nigricans)[46]。 而 Kuwamur 等[48]和Maxfield等[49]对雌雄同体雌雄同步成熟鱼类研究发现,这种类型鱼类同时具有功能性的卵巢和精巢组织,并且能够在雌雄两个性别间多次改变性别以应对其社会地位的变化。冲绳磨塘鳢(Trimma okinawae)是虾虎鱼科中第一种被报道的雌雄同体雌雄同步成熟鱼类。Kobayashi[50]等对冲绳磨塘鳢两种细胞色素P450芳香化酶的特性研究中发现,P450芳香化酶A特异地表达于卵巢组织,其转录水平随着卵母细胞的生长发育显著增高,而在卵黄发生后迅速下降。在成熟睾丸的间质细胞中可以检测到P450芳香化酶A转录本。睾丸中芳香酶的表达与斑点叉尾鮰、虹鳟等鱼的早期发现一致。然而,在性腺形成方式方面,这些物种与冲绳磨塘鳢的情况是不同的。冲绳磨塘鳢的独特之处在于,无论发育处于哪个阶段,其性腺中都有卵巢和精巢。Orlando等[51]对雌雄同体红树林鱂鱼和雄性红树林鱂鱼芳香酶基因差异表达研究中发现,芳香化酶A在雌雄同体红树林鱂鱼的性腺的表达远高于雄性红树林鱂鱼,证实其雌雄同体中存在卵巢组织。通过以上研究表明,cyp19a1a在雌雄同体鱼类性腺的表达谱证实了性腺芳香化酶cyp19a1a表达水平不受基因型控制,而主要受调控雌雄激素的芳香化酶的支配。由于芳香化酶对鱼类生殖调控和性腺发育的独特作用,因此可以采取人工手段(采用雌激素诱导XY基因型兰州鲇精巢逆转为卵巢或者采用雄激素或芳香化酶抑制剂诱导XX基因型兰州鲇卵巢转为精巢)改变鱼类体内的芳香化酶的水平,从而获得XY基因型的伪雌鱼和XX基因型的伪雄鱼,而XY基因型的伪雌鱼和XY正常雄鱼人工授精可产生YY雄鱼,其和XY基因型的雌雄同体兰州鲇一样(雌雄同体自体精卵人工授精获得YY雄性自我受精系)。YY雄性可直接作为父本与激素诱导性逆转的XY伪雌鱼或者YY伪雌鱼进行全雄性后代的生产。因此,此研究为雌雄同体以及生长速度和体型性别二态性鱼类在培育全雌或全雄种群提供了理论依据。
本研究首次克隆了兰州鲇cyp19a1a基因的cDNA全长序列及其表达模式,为探讨cyp19a1a基因对兰州鲇性别决定与分化、性腺发育和维持以及卵母细胞生长发育过程中的作用及机制奠定了基础,对深入了解兰州鲇性别决定与分化、性腺发育过程及其生殖调控积累资料,为后续通过基因编辑技术对性别决定与分化相关基因cyp19a1a在兰州鲇分子性别控制育种以及应用激素处理诱导性逆转的方式培育全雄兰州鲇提供理论依据和技术支持。
