基于SNP分子标记的221份荔枝品种(品系)的遗传多样性分析及核心种质库构建
2022-08-12黄小凤韦阳连余金昌袁志永王伟山
黄小凤,韦阳连,袁 叶,余金昌,袁志永,王伟山
(东莞植物园,广东 东莞 523086)
荔枝(LitchichinensisSonn.)起源于中国,属于特色农产品之一。目前,国内荔枝栽培面积约5.3×105hm2,形成了海南特早熟、粤桂西南早熟、粤桂中部中熟、粤东闽南晚熟、泸州特晚熟等特色优势产区[1,2]。荔枝品种众多,表型多样性丰富。1982年,傅玲娟等[3]在海南岛调查发现,野生荔枝的叶片、果实表型多样,根据果皮特征可分为3种类型;1986年,吴仁山以果皮特征为一级分类标准,果形为二级分类标准,其他性状为三级和四级分类标准,将广西的荔枝品种分为7大类[4];吴淑娴[5]在前人研究基础上,以成熟果实中部果皮上龟裂片和裂片峰的主要特征作为分类标准,将全国200余份荔枝品种分为果皮龟裂片尖突型、隆起型、平坦型3大类型,每个类型均包含多种形态的裂片峰。荔枝丰富的表型多样性是其遗传多样性在形态上的体现。
荔枝遗传多样性研究对其资源保护和开发利用具有重要意义。随着分子生物学技术的发展,DNA分子标记技术已成为遗传多样性研究的有效方法。目前,研究者已利用RAPD、AFLP、ISSR、EST-SSR、SNP、SRAP等分子标记[6-12]对荔枝品种资源进行了亲缘关系及遗传多样性研究,说明将分子标记方法用于荔枝种质资源研究具有较高的可行性和有效性。
栽培植物的核心种质库能以最小的品种数量和遗传重复,最大程度地代表整个物种资源的遗传多样性,核心种质库的构建能够提高种质资源的管理和利用效率,已成为国内外植物种质资源研究的重点[13]。目前,已经利用分子标记构建了水稻(OryzasativaLinn.)、核桃(JuglansregiaLinn.)、杏(ArmeniacavulgarisLinn.)、木荷(SchimasuperbaGardn.et Champ.)、杉木〔Cunninghamialanceolata(Lamb.)Hook.〕和建兰〔Cymbidiumensifolium(Linn.)Sw.〕等植物的核心种质库[14-19]。荔枝树体高、占地面积大,其活植物保存需要占用大量土地。为了能够在有限的土地上尽可能多地保存荔枝品种资源,维持其遗传多样性,宜利用分子标记构建荔枝核心种质库。
作者所在课题组现收集到荔枝品种(品系)221份,且大多数品种(品系)的遗传多样性和亲缘关系未知。为客观评价荔枝品种资源的遗传多样性,弄清品种间的遗传关系,作者利用SNP分子标记对收集的荔枝品种(品系)进行遗传多样性和遗传关系分析,并在此基础上构建荔枝核心种质库,以期高效保存荔枝种质资源的遗传多样性,有效提高其管理水平,为荔枝种质资源的管理与利用提供理论依据。
1 材料和方法
1.1 材料
供试样本为从广东、广西、福建、海南和四川收集的221份荔枝品种(品系),包括154份晚熟品种(品系)(编号1~154)、50份中熟品种(品系)(编号155~204)、11份早熟品种(品系)(编号205~215)、6份特早熟品种(品系)(编号216~221),各品种(品系)的名称和来源地见附录Ⅰ。
供试品种(品系)均种植于东莞植物园荔枝种质资源圃内。该种质圃地处南亚热带季风气候区,光照充足、热量丰富、雨量充沛,圃内土壤为赤壤土。
每份样本选择3株单株,株龄为4~14 a,在每株样株中上部的健康老熟枝条上各采集1枚老熟叶片,于-70 ℃保存、备用。
1.2 方法
1.2.1 DNA的提取与检测 采用CTAB小样法[20]提取叶片DNA并进行纯度检测,于-20 ℃保存、备用。
1.2.2 SNP分型 从Liu等[11]开发的155对SNP引物中筛选出分型稳定、多态性高的19对SNP引物进行PCR扩增反应,供试引物基本信息见表1。PCR扩增体系总体积10.0 μL,包括10 ng·μL-1基因组DNA 2.0 μL、5 U·μL-1rTaqDNA聚合酶〔宝生物工程(大连)有限公司〕0.6 μL、10×Buffer(含Mg2+)1.0 μL、10 mmol·L-1dNTPs 0.2 μL、10 mmol·L-1正向和反向引物各0.3 μL,灭菌超纯水补足剩余体积。PCR扩增程序为:95 ℃预变性3 min;95 ℃变性45 s、56 ℃退火30 s、72 ℃延伸1 min,共50个循环;最后72 ℃延伸5 min。PCR产物于4 ℃保存。SNP基因分型及数据分析参考孙清明等[21]。

表1 供试19对SNP引物的基本信息
1.2.3 遗传多样性和遗传结构分析 利用GenAlEx 6.5软件计算观测等位基因数、有效等位基因数、Shannon’s信息指数、观测杂合度、期望杂合度、遗传分化系数和遗传距离,并进行分子方差变异分析(AMOVA)。参照文献[22]划分群体遗传分化程度。
采用PowerMarker V3.25软件计算多态性信息含量;采用STRUCTURE 2.3.4软件对供试样本进行分组和群体遗传结构分析,根据ΔK值最大原则确定最佳分组数;最后,利用MEGA 5.2软件,基于遗传距离采用UPGMA法构建系统树。
1.2.4 核心种质库的构建与评价 按照供试荔枝品种(品系)的果实成熟期进行分组,参照文献[18]的方法筛选并构建核心种质库。运用PowerMarker V3.25 软件设置取样比例为10%、15%、20%、25%和30%,根据模拟退火算法(simulated annealing algorithm)以等位基因最大化(maximizing allelic richness)为标准构建核心种质库;利用GenAlEx 6.5软件计算核心品种(品系)、原有品种(品系)和保留品种(品系)的遗传多样性参数,并通过计算遗传多样性参数的保留率〔核心品种(品系)某一指标占原有品种(品系)同一指标的百分率〕以及t检验评价核心品种(品系)、保留品种(品系)和原有品种(品系)的遗传多样性,同时运用主坐标分析法(PCoA)对构建的核心种质库进行确认。
2 结果和分析
2.1 SNP引物和荔枝品种(品系)群体的遗传多样性分析
2.1.1 SNP引物的遗传多样性参数分析 利用19对SNP引物对供试的221份荔枝样本进行扩增,各引物的遗传多样性参数见表2。
由表2可见:每对SNP引物的观测等位基因数均为2,有效等位基因数为1.1~2.0,均值为1.5;Shannon’s信息指数为0.236~0.692,均值为0.482;观测杂合度为0.081~0.561,均值为0.282;期望杂合度为0.119~0.499,均值为0.314;多态性信息含量为0.112~0.374,均值为0.256。其中,引物SNP7的有效等位基因数、Shannon’s信息指数、期望杂合度和多态性信息含量均最高。
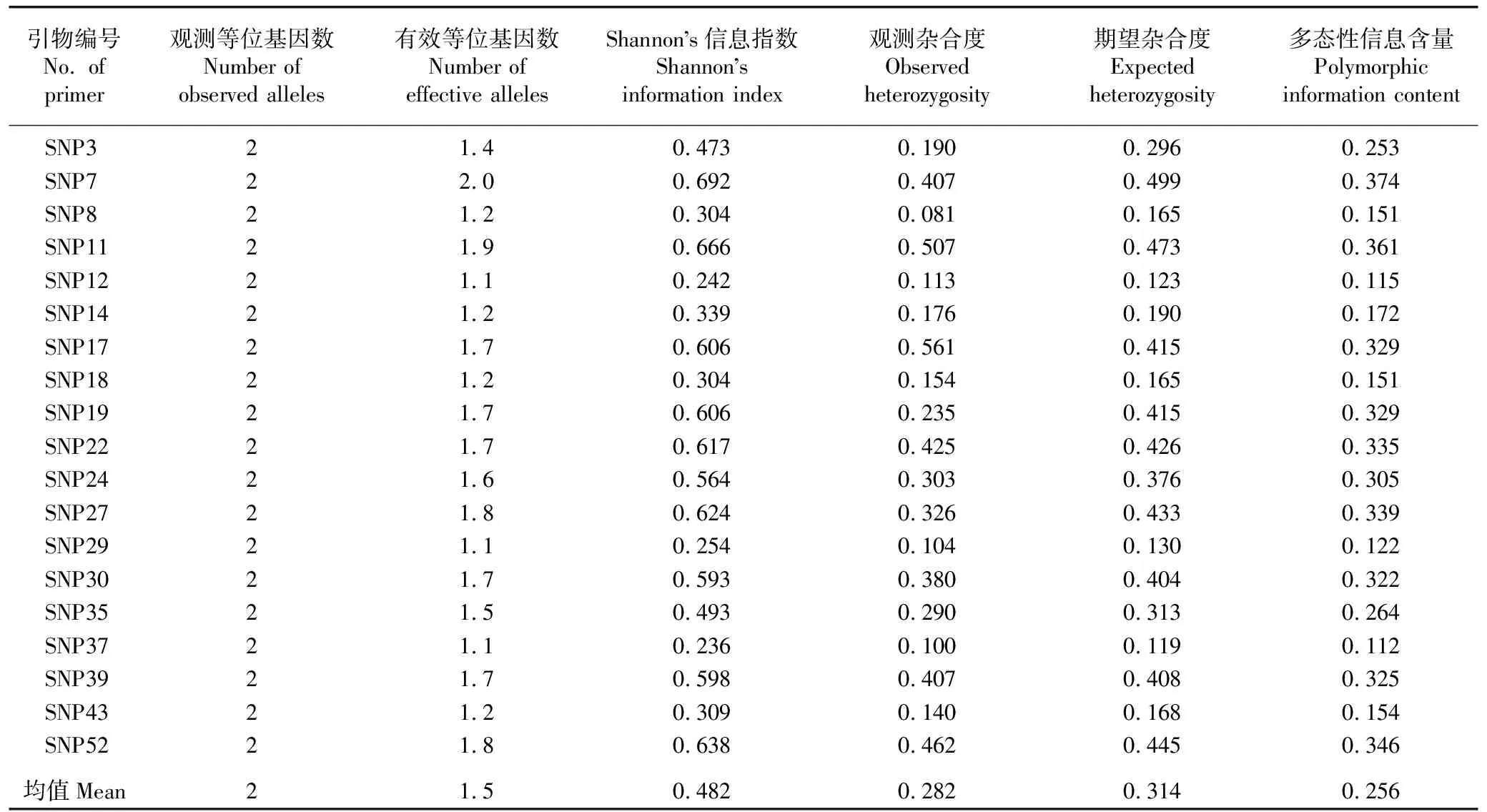
表2 用于221份荔枝样本SNP分子标记分析的19对引物的遗传多样性参数
2.1.2 荔枝品种(品系)群体的遗传多样性分析 基于SNP分子标记分析结果,对不同果实成熟期荔枝品种(品系)群体的遗传多样性参数进行分析,结果见表3。
由表3可见:供试荔枝品种(品系)群体的观测等位基因数、有效等位基因数、Shannon’s信息指数、观测杂合度和期望杂合度的均值分别为1.9、1.6、0.487、0.372和0.327。在4个荔枝品种(品系)群体中,荔枝晚熟品种(品系)群体的有效等位基因数、Shannon’s信息指数、观察杂合度和期望杂合度均最小,早熟品种(品系)群体的上述遗传多样性指标均最大,表明荔枝早熟品种(品系)群体的遗传多样性最高,荔枝晚熟品种(品系)群体的遗传多样性最低。

表3 基于SNP分子标记的不同果实成熟期荔枝品种(品系)群体的遗传多样性参数
2.2 荔枝品种(品系)群体的遗传分化和遗传结构
基于SNP分子标记分析结果,对不同果实成熟期荔枝品种(品系)群体的遗传分化和遗传结构进行分析,结果分别见表4、表5和图1。
2.2.1 荔枝品种(品系)群体的遗传分化 分子方差分析(AMOVA)结果(表4)显示:供试荔枝品种(品系)样本个体间的遗传变异贡献率为85%,群体间和群体内的遗传变异贡献率分别为10%和5%,表明供试荔枝品种(品系)群体的遗传变异主要发生在个体间,群体间遗传变异不明显。
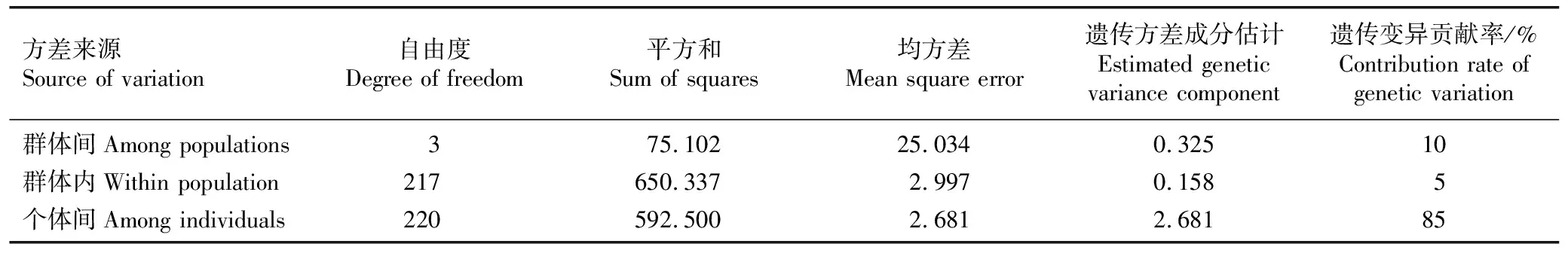
表4 荔枝品种(品系)群体的AMOVA分析结果
由表5可见:中熟品种(品系)群体与早熟和晚熟品种(品系)群体间的遗传分化程度很低,遗传分化系数分别为0.046和0.021;早熟品种(品系)群体与特早熟和晚熟品种(品系)群体间的遗传分化程度较低,遗传分化系数分别为0.081和0.096;特早熟品种(品系)群体与中熟和晚熟品种(品系)群体间的遗传分化程度中等,遗传分化系数分别为0.166和0.246。晚熟品种(品系)群体与中熟、早熟和特早熟品种(品系)群体间的遗传距离依次增大,遗传距离分别为0.014、0.091和0.352;特早熟品种(品系)群体与早熟、中熟和晚熟品种(品系)群体间的遗传距离也依次增大,遗传距离分别为0.109、0.240和0.352。表明供试荔枝品种(品系)群体的果实成熟时间相差越大,其遗传距离越大。
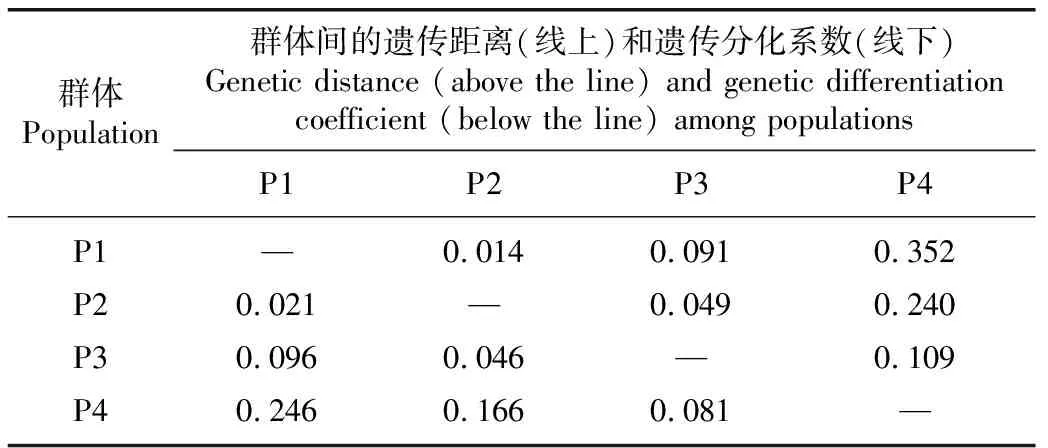
表5 基于SNP分子标记的不同果实成熟期荔枝品种(品系)群体间的遗传距离和遗传分化系数1)
总体上看,供试荔枝品种(品系)群体间的遗传分化系数和遗传距离均与果实成熟期相关,果实成熟期相距越远,遗传分化系数和遗传距离越大。
2.2.2 荔枝品种(品系)群体的遗传结构 基于SNP分子标记的不同果实成熟期荔枝品种(品系)群体的分组结果(图1-A)表明:在K=2时,ΔK达到最大值,说明供试荔枝品种(品系)群体在分成2组时遗传结构最明显。
遗传结构分析结果(图1-B)表明:供试的221份荔枝品种(品系)适合划分为2组。其中,a组Q值为0.501~0.995,包含181份荔枝品种(品系),主要为中熟和晚熟品种(品系),分别为32和145份品种(品系),另包含4份早熟品种(品系);b组的Q值为0.550~0.997,包含40份荔枝品种(品系),包括所有特早熟品种(品系)(6份)、大部分早熟品种(品系)(7份)、少部分中熟品种(品系)(18份)及极少部分晚熟品种(品系)(9份)。

K: 分组数Cluster number.: a组Group a; : b组Group b.P1: 晚熟品种(品系)Late-maturing cultivar(strain); P2: 中熟品种(品系)Mid-maturing cultivar(strain); P3: 早熟品种(品系)Early-maturing cultivar(strain); P4: 特早熟品种(品系)Extremely early-maturing cultivar(strain).
2.3 荔枝品种(品系)群体的聚类分析
根据SNP分子标记分析结果、基于遗传距离对221份荔枝品种(品系)进行UPGMA聚类分析,结果见图2。
由图2可见:在遗传距离0.18处,可将供试荔枝品种(品系)分为3组。特早熟品种(品系)‘荷包荔’(‘Hebaoli’)(编号216)和‘三月红’(‘Sanyuehong’)(编号219)与绝大多数品种(品系)的遗传距离较远,二者聚为Ⅰ组;另219份品种(品系)可划分为2组(Ⅱ组和Ⅲ组)。其中,Ⅱ组包含39份品种(品系),包括4份特早熟品种(品系)、10份晚熟品种(品系)、18份中熟品种(品系)和7份早熟品种(品系);Ⅲ组包含180份品种(品系),包括144份晚熟品种(品系)、32份中熟品种(品系)和4份早熟品种(品系)。
将图2中Ⅰ组、Ⅱ组和Ⅲ组包含的品种(品系)分别与图1中基于遗传结构的分组结果进行比对,结果显示:Ⅰ组和Ⅱ组包含的41份品种(品系)中,有36份品种(品系)出现在图1的b组中;Ⅲ组包含的180份品种(品系)中,有177份品种(品系)出现在图1的a组中。表明聚类分析和遗传结构分析结果基本一致。
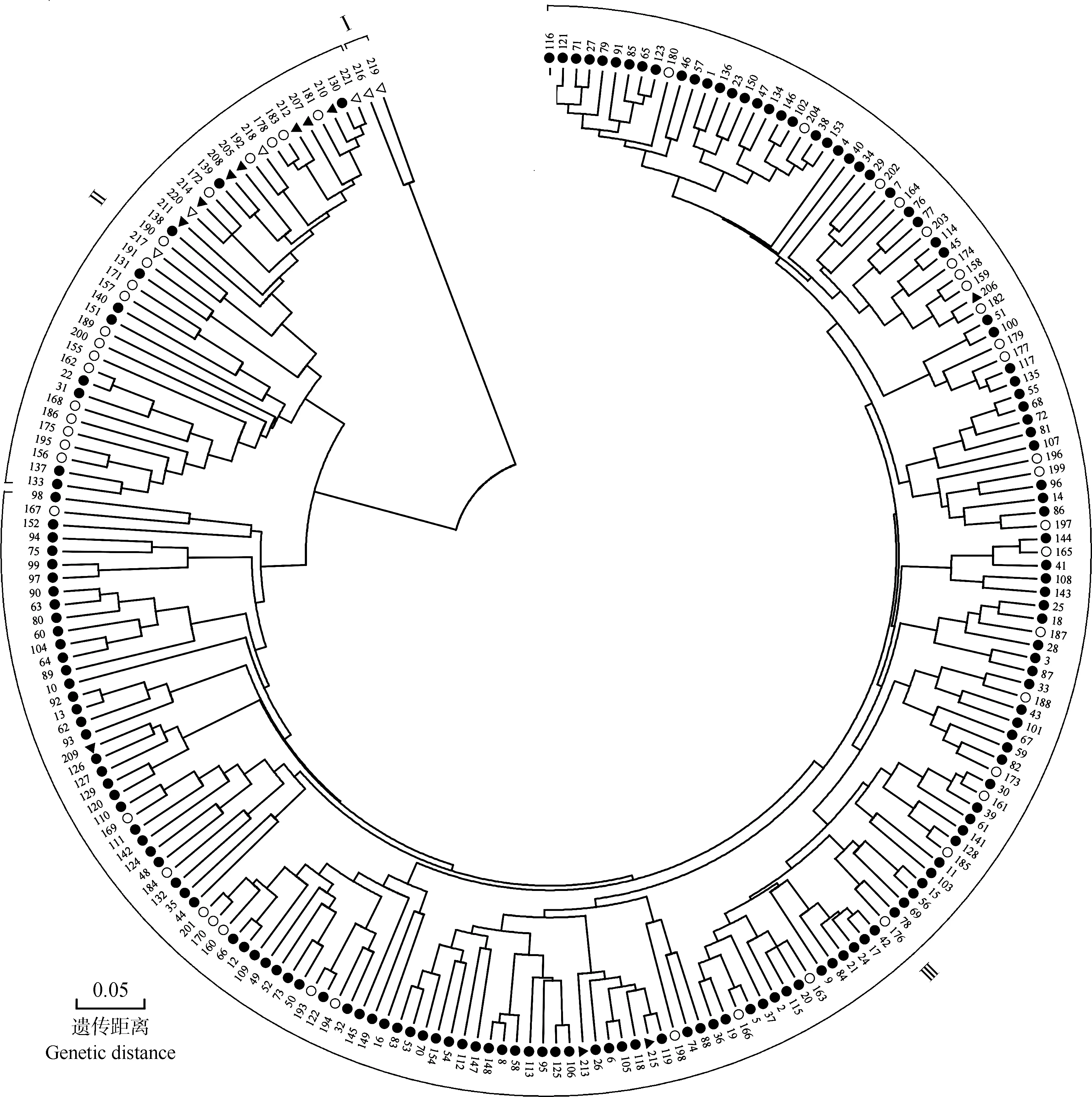
: 晚熟品种(品系)Late-maturing cultivars(strains); : 中熟品种(品系)Mid-maturing cultivars(strains); : 早熟品种(品系)Early-maturing cultivars(strains); : 特早熟品种(品系)Extremely early-maturing cultivars(strains).1-221:品种(品系)编号Nos.of cultivars(strains).
2.4 荔枝核心种质库的构建和评价
2.4.1 荔枝核心种质库构建 用PowerMarker V3.25软件设置不同的取样比例并构建核心种质库,其遗传多样性参数见表6。

表6 按照不同取样比例构建的荔枝核心种质库的遗传多样性参数1)
结果表明:取样比例为20%构建的核心品种(品系)群体能最大程度地保留原有品种(品系)群体的遗传多样性,其观测等位基因数、有效等位基因数、Shannon’s信息指数、观测杂合度、期望杂合度的保留率分别为100%、100%、106%、103%和107%,表明该取样比例筛选出来的荔枝核心品种(品系)群体能充分体现原有品种(品系)群体的遗传多样性,可确作为荔枝核心种质库。
核心种质库包含44份品种(品系)(详见附录Ⅰ),其中晚熟品种(品系)有31份,占晚熟品种(品系)总数的20.1%;主要为来源于海南的品种(品系)(18份),来源于福建和四川的品种(品系)分别有5和2份,来源于广东和广西的品种(品系)均有3份。中熟品种(品系)有8份,占中熟品种(品系)总数的16.0%;来源于广东、广西、福建和四川的品种(品系)各有2、3、1和2份。早熟品种(品系)有2份,分别来源于广东和福建,占早熟品种(品系)总数的18.2%;特早熟品种(品系)有3份,分别来源于广东、福建和四川,占特早熟品种(品系)总数的50.0%。总体上看,核心种质库包含的品种(品系)全面涵盖原有品种(品系)群体的果实成熟期和来源地,说明该核心种质库较全面地保留了供试荔枝品种(品系)的相关信息。
2.4.2 荔枝核心种质库评价 将荔枝核心种质库中包含的核心品种(品系)群体与原有品种(品系)群体和保留品种(品系)群体的遗传多样性参数进行对比,结果见表7;对荔枝核心品种(品系)群体与原有品种(品系)群体进行主坐标分析(PCoA),结果见图3。
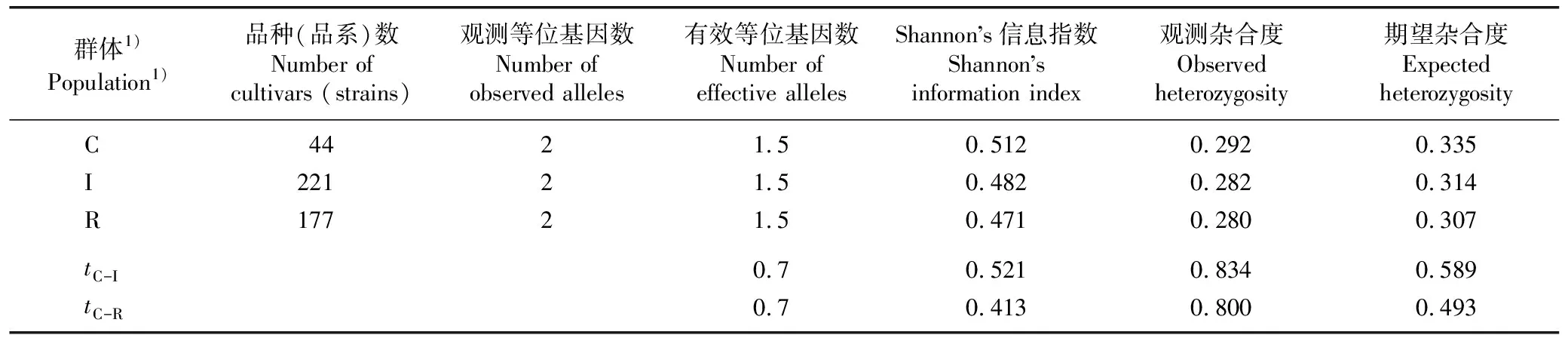
表7 荔枝核心品种(品系)群体与其他品种(品系)群体的遗传多样性参数对比
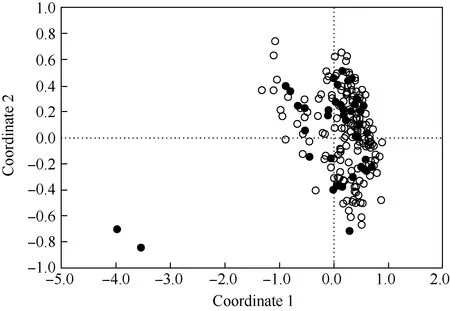
: 核心品种(品系)Core cultivar(strain); : 原有品种(品系)Initial cultivar(strain).
由表7可见:核心品种(品系)群体的Shannon’s信息指数、观测杂合度和期望杂合度均高于原有品种(品系)群体和保留品种(品系)群体,表明核心品种(品系)群体的遗传多样性相对较高。t检验结果显示:3个供试群体的遗传多样性参数均无显著差异,表明核心品种(品系)群体可以代表原有品种(品系)群体,且保留品种(品系)群体可作为核心种质库的备用资源。
由图3可见:核心品种(品系)均匀分布在整个供试群体中,且核心品种(品系)还包含特早熟品种(品系)‘荷包荔’和‘三月红’,表明该荔枝核心种质库的代表性较强。
3 讨论和结论
3.1 荔枝品种(品系)的遗传多样性及变异来源
遗传多样性研究对植物种质资源的利用、保护和进化具有重要意义。本研究利用19对SNP引物对221份荔枝品种(品系)进行了遗传多样性研究,Shannon’s信息指数为0.236~0.692,观测杂合度为0.081~0.561,表明供试的荔枝品种(品系)样本具有较高的遗传多样性。荔枝群体遗传多样性丰富可能与其品种(品系)间的自然杂交有关。荔枝起源于云南,后沿着西江传播至海南,并在云南和海南分别驯化为特早熟和晚熟品种(品系),这2类品种(品系)进一步杂交形成早熟和中熟品种(品系)[23];荔枝为异花授粉植物,遗传基础十分复杂,基因型为杂合型,荔枝品种(品系)间的自然杂交使其品种(品系)间的遗传物质交流频繁,引起遗传变异和遗传多样性的增加[24]。
在基于SNP分子标记数据构建的UPGMA聚类图中,供试的221份荔枝样本可分为3组,Ⅰ组的2份样本均属于特早熟品种(品系),Ⅲ组的绝大多数样本属于晚熟品种(品系);Ⅱ组中,靠近Ⅰ组的样本多属于特早熟或早熟品种(品系),靠近Ⅲ组的样本多属于中熟品种(品系)。在聚类图上,供试品种(品系)的分布整体呈现两端分别为特早熟和晚熟品种(品系)、中间为早熟和中熟品种(品系)的特点,基本符合“荔枝先独立驯化为特早熟和晚熟品种,这2类品种再进一步杂交形成早熟与中熟品种”[23]的研究结论。但在聚类图中也出现少数不同果实成熟期的品种(品系)聚在同组的现象,这可能与不同区域之间的相互引种以及品种(品系)间的自然杂交有关。引种和自然杂交过程均可促进品种(品系)间的基因交流,进而产生具有多种遗传特性的后代,但若品种(品系)之间具有亲缘关系,则无论其果实成熟期是否一致,都有可能聚在一起。
3.2 荔枝品种(品系)的分类标准
目前,多根据果皮特征将荔枝品种(品系)分为尖突型、隆起型和平坦型3大类型,但这一分类体系并不能准确反映品种(品系)间的亲缘关系。随着分子生物技术的广泛应用,有研究者发现依据分子标记获得的荔枝样本的分组结果同时表现出依果实成熟期分组的特点,因而提出将果实成熟期作为荔枝品种资源分类的首要标准[25]。Liu等[26]基于RAPD分子标记技术,将60份荔枝样本按果实成熟期分为极早熟、早中熟和晚熟至极晚熟3组;基于SSR分子标记技术,傅嘉欣[27]发现供试47份荔枝样本可分为3大组,分组结果与果实成熟期具有较好的一致性[25];Liu等[11]基于SNP技术,将96份荔枝样本按照果实成熟期聚为特早熟、早熟、中熟和晚熟4组。本研究中,供试221份荔枝品种(品系)的果实成熟期相差明显,且果实成熟期相差越大的荔枝群体,其遗传分化系数和遗传距离也越大,但在UPGMA聚类图中供试221份荔枝样本并未完全按照果实成熟期聚类,其中,Ⅲ组主要为晚熟和中熟品种(品系)并包含少量早熟品种(品系),而Ⅱ组中4个果实成熟期的品种(品系)均有。造成这一现象的原因可能与供试样本的数量有关,供试样本越多,携带的遗传信息越多,产生遗传变异的可能性越大,不确定的影响因子也更多。本研究中供试荔枝样本的期望杂合度(0.314)高于Liu等[11]的研究结果(0.305),可见研究对象的有效样本量越大,产生遗传变异的可能性越大,其期望杂合度越高。
2021年,国家荔枝种质资源圃在茂名建成,收集了国内外700多份荔枝种源,今后应以尽可能多的种质资源为供试材料,开展多个分子标记和多个表型性状的相关性研究,从整体上对荔枝种质的遗传背景和表型进行综合分析,以探讨将成熟期或其他性状作为荔枝种质分类新标准的科学性。
3.3 荔枝核心种质库的构建及其意义
保存大量的种质资源可为荔枝遗传改良和品种选育提供丰富的遗传基础,但荔枝为多年生乔木,树体高、占地面积大,这给荔枝种质资源的保存带来了一定的困难。构建荔枝核心种质库,可在有限的土地上保存更多的种质资源,实现遗传多样性保藏目标。
确定合理的取样比例是核心种质库构建面临的首要问题。目前,国内外不同植物核心种质库的取样比例为5%~30%,没有统一的标准。李自超等[28]认为,构建核心种质库时的取样比例要根据原有样本的数量而定,原有样本数量大时核心种质库的取样比例可相对较小,反之,取样比例应相应增大。李冬波等[29]对广西原产和引种的88份荔枝品种资源进行分析,构建了包含22份品种(品系)的核心种质库,占原有品种(品系)数的25%;Sun等[30]分析了不同果实成熟期的96份荔枝样本,并筛选出22份核心样本,占原有样本数的23%;而本研究在供试的221份荔枝品种(品系)中筛选出44份样本构建了核心种质库,占原有品种(品系)数的20%。由此可见,随原有种质库中荔枝品种(品系)数的逐渐增多,核心种质库的取样比例逐渐减小,这在一定程度上佐证了李自超等[28]的研究结论。
经PCoA主坐标分析和t检验,采用本研究方法构建的荔枝核心种质库包含的品种(品系)的遗传多样性参数与原有种质库无显著差异,且该核心种质库涵盖了原有种质库的所有品种(品系)的果实成熟期和来源地,说明构建的核心种质库具有很好的代表性,在实际育种工作中可优先考虑使用核心种质库的品种(品系)作为育种材料。当土地资源减少,无法保存所有供试品种(品系)的活植物时,应优先保存核心种质库的品种(品系),以维持其遗传多样性。
目前,早熟品种不优质是荔枝产业发展面临的主要问题之一,选育早熟优质荔枝品种(品系)是荔枝重要的育种目标。本研究结果显示:特早熟品种(品系)‘荷包荔’和‘三月红’与绝大多数品种(品系)的遗传距离较远,且为核心品种(品系),在早熟品种(品系)育种工作中可考虑选择‘荷包荔’和‘三月红’与优质荔枝品种(品系)进行杂交,以选育早熟优质荔枝品种(品系)。
