新型冠状病毒N蛋白的原核表达与纯化
2022-08-12樊志浩李玉林张恒王旭东王云龙
樊志浩,李玉林,张恒,王旭东,王云龙,4
1.郑州大学 生命科学学院,河南 郑州 450001;2.河南省生物工程技术研究中心,河南 郑州 450121;3.河南省职工医院,河南 郑州 450002;4.郑州职业技术学院 生物工程系,河南 郑州 450121
0 引言
冠状病毒是一大类病毒的总称,属巢病毒目(Nidovirales)冠状病毒科(Coronaviridae)正冠状病毒亚科(Orthocoronavirinae),分为α、β、γ和δ4个属[1]。α和β冠状病毒属主要为哺乳动物冠状病毒,γ冠状病毒属主要为禽类冠状病毒,而δ冠状病毒属既包括哺乳动物冠状病毒,也包括鸟类冠状病毒。冠状病毒已在禽类宿主(鸡、火鸡、鸭和鹅)和哺乳动物(骆驼、蝙蝠、果子狸、老鼠、狗和猫)中被鉴定出来[2]。人们喜食野味的习惯使冠状病毒由动物传播感染人类成为可能,目前已知的有α属229E、NL63,β属OC43、HKU1、MERS-CoV、SARS-CoV和SARS-CoV-2[3-4]。新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)是由新型冠状病毒(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)引起人发热、乏力、干咳和呼吸困难的传染病,部分患者甚至会出现急性呼吸窘迫综合征,并伴有呼吸衰竭及严重的低氧血症。新型冠状病毒变异性极强,已产生了多种变异株,目前新型冠状病毒的变异株奥密克戎系毒株传播速度比以往任何变种都快[5-7]。除核酸检测外,建立准确、快速的抗体检测方法对新型冠状病毒的防控具有重要意义[8]。
SARS-CoV-2有包膜,有约30 kb的单股正链RNA基因组,含4种主要结构蛋白。其中,核衣壳蛋白(Nucleocapsid Protein,N蛋白)作为新型冠状病毒中的一种重要结构蛋白,其结构域由3个互不相同但高度保守的部分组成:N末端RNA结合结构域(NTD)、C末端二聚结构域(CTD)和本质上无序的富含Ser/Arg(SR)的中心连接子。NTD负责RNA结合,CTD负责齐聚,中心连接子负责初级磷酸化[9-11]。N蛋白具有很强的免疫原性,可诱导机体产生特异的免疫反应,是针对野生动物和人诊断检测的主要靶标[12-13]。研究[14]发现,新型冠状病毒编码的N蛋白对宿主核因子κB(NF-κB)通路及炎症反应具有促进作用,揭示了N蛋白通过“液-液”相分离(LLPS)招募NF-κB转化生长因子激酶1(TAK1)及关键激酶IKKβ,并形成相分离复合体的分子机制,为新型冠状肺炎的治疗提出了靶向相分离的新型抑炎策略。
基于此,本研究拟采用生物信息学方法对SARS-CoV-2 N蛋白进行亲疏水性、抗原表位预测及多序列比对分析,构建含SARS-CoV-2 N蛋白基因的重组质粒,在大肠杆菌原核表达体系下,通过调整诱导温度和时间,实现蛋白的可溶性表达并使其表达量最高,建立蛋白纯化体系,以期得到浓度和纯度均较高的具有特异性的重组N蛋白,为快速诊断方法的建立、优化和单抗药物的研发提供参考。
1 材料与方法
1.1 材料与试剂
NdeⅠ、XhoⅠ核酸内切酶,宝日医生物技术(北京)有限公司产;质粒小提试剂盒、通用型纯化回收试剂盒,天根生化科技(北京)有限公司产;Ni-NTA亲和层析填料,通用电气(GE)公司产;异丙基-β-D-硫代半乳糖苷(IPTG)干粉、二硫苏糖醇(DTT)、二氨基联苯氨(DAB)显色液、牛血清白蛋白(BSA),上海索莱宝生物科技有限公司产;PageRuler蛋白Marker,赛默飞世尔科技公司产;PR1920蛋白Marker,北京索莱宝科技有限公司产;卡那霉素(Kana)、咪唑、含SARS-CoV-2 N蛋白基因全长序列的重组质粒,生工生物工程(上海)有限公司产;聚偏氟乙烯(PVDF)膜,杭州沃森生物技术有限公司产;脱脂奶粉,内蒙古伊利实业集团股份有限公司产;磷酸缓冲液(PB)、磷酸盐吐温缓冲液(PBST)、His-tag抗体,由河南省生物工程技术研究中心提供。
1.2 主要仪器与设备
XK26/20型层析柱、XK50型凝胶过滤层析柱,通用电气(GE)公司产;GL-21M型高速冷冻离心机,湖南湘仪实验室仪器开发有限公司产;LDZF-50KB-Ⅱ型高压灭菌锅,上海申安医疗器械厂产;Y1515X型蠕动泵,保定兰格恒流泵有限公司产;HD-9705型紫外检测仪,上海精科实业有限公司产;SPH-100B型恒温摇床,上海世平实验设备有限公司产;ChemiDolTMXRS+凝胶成像仪,伯乐(Bio-Rad)公司产。
1.3 实验方法
1.3.1SARS-CoV-2N蛋白结构分析与抗原表位预测利用ExPASy中的ProtScale模块(https:∥web.expasy.org/protscale/)分析SARS-CoV-2 N蛋白的疏水性,利用TMpred(https:∥embnet.vital-it.ch/software/TMPRED_form.html)分析蛋白序列的跨膜区间,利用DNAstar7.1软件中的Protean模块预测该蛋白的亲水性、抗原指数等参数[15]。通过EMBL-EBI数据库对 SARS-CoV-2(YP_009724397.2)、SARS冠状病毒(SARS-CoV,NP_828858.1)、蝙蝠冠状病毒(Bat coronavirus,AGC74169.1)和中东呼吸综合征冠状病毒(MERS-CoV,YP_009047211.1)的N蛋白进行氨基酸多序列比对。
1.3.2 基因及引物序列合成根据NCBI上的SARS-CoV-2/human/USA/UF-2/2020(GenBank:MT295465.1)序列,选择N蛋白基因全长序列,在N端和C端分别加入His-tag,通过密码子优化,由生工生物工程(上海)股份有限公司合成基因,目的基因序列连入载体pUC57。通过引物设计软件Primer premier 5设计引物序列,上游和下游引物分别加上NdeⅠ和XhoⅠ核酸内切酶的酶切位点,其序列如下:N-F(5′-GGAATTCCATATGAGCGATAATGGTCCG-3′);N-R(5′-CCGCTCGAGGGC-CTGGGTACTATC-3′)。
1.3.3 重组质粒构建与鉴定以pUC57/N为模板,N-F和N-R为引物,扩增SARS-CoV-2 N蛋白基因靶序列。用NdeⅠ和XhoⅠ核酸内切酶分别双酶切载体pET28a和PCR扩增的N蛋白基因靶序列,回收、连接并转化到大肠杆菌DH5α感受态细胞中。单克隆阳性鉴定后,通过双酶切和测序进行重组质粒的鉴定,结果正确的重组质粒命名为pET-28a/N。
1.3.4SARS-CoV-2N蛋白的表达条件筛选将重组质粒转化到大肠杆菌BL21(DE3)感受态细胞,培养过夜后,挑取单菌落加入Kana抗性的LB液体培养基中,在37 ℃、210 r/min摇床中恒温振荡培养4~5 h,至OD为1.0时,加入诱导剂IPTG使其终浓度为0.2 mmol/L,分别在37 ℃(5 h)、25 ℃(10 h)、16 ℃(20 h)这3种不同的温度和时间下诱导大肠杆菌表达N 蛋白。发酵结束后,离心收集菌体沉淀,加入适量的缓冲液A(20 mmol/L PB,300 mmol/L NaCl,5 mmol/L咪唑,pH 值8.0)重悬浮,冰浴超声破碎完全后,在4 ℃条件下高速离心,收集上清液和沉淀,进行还原性十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳鉴定。
1.3.5 目的蛋白亲和层析纯化将Ni-NTA亲和层析填料平衡至室温后,倒入层析柱中,静置。层析柱两端分别连接于蠕动泵和紫外检测仪,流速为2.5 mL/min,用缓冲液A平衡5个柱体,备用。
在上述最佳诱导条件下诱导N蛋白表达。收集的菌体用适量缓冲液A重悬浮,冰浴超声破碎完全后,高速冷冻离心并收集上清液。上清液经0.45 μm滤膜过滤后上样,流速为1 mL/min,用缓冲液A继续冲洗至基线左右。用缓冲液B(20 mmol/L PB,300 mmol/L NaCl,100 mmol/L 咪唑,pH 值8.0)洗涤除杂,至基线左右后,用缓冲液C(20 mmol/L PB,300 mmol/L NaCl,300 mmol/L 咪唑,pH 值8.0)洗脱目的蛋白。收集目的蛋白,进行还原性SDS-PAGE电泳检测。
1.3.6 目的蛋白凝胶过滤层析纯化用截留相对分子质量为30 000的浓缩管对亲和层析纯化后的目的蛋白进行浓缩,并使用低盐缓冲液D(20 mmol/L PB,150 mmol/L NaCl,1 mmol/LDTT,pH 值8.0)进行缓冲液置换,于4 ℃、6000 r/min条件下离心10 min,离心结束后用移液器轻轻吹打浓缩管壁,将蛋白液充分混匀后倒出。使用凝胶过滤层析柱对浓缩后的蛋白液进一步纯化,用缓冲液D平衡层析柱,流速为2.5 mL/min,平衡完成后进行上样,流速为1 mL/min。分别收集蛋白洗脱液,进行还原性SDS-PAGE电泳鉴定。
1.3.7 目的蛋白免疫印记检测将上述纯化后的目的蛋白和BSA(阴性对照)经还原性SDS-PAGE分离后转印至PVDF膜。转膜后用PBST清洗3次,每次5 min,再浸泡于封闭液(含0.05 g/mL脱脂奶粉的PBST溶液)中,于37 ℃条件下封闭2 h。在封闭液中加入按体积比1∶2000稀释的His-tag抗体,室温振荡孵育2 h;用PBST洗涤3次,每次5 min;最后使用DAB显色液闭光进行显色,观察显色结果。
2 结果与分析
2.1 SARS-CoV-2 N蛋白跨膜结构、抗原表位预测和多序列比对分析
SARS-CoV-2 N蛋白抗原表位预测和多序列比对结果如图1所示。由图1a)可知,SARS-CoV-2 N蛋白编码419个氨基酸,等电点(PI)为10.10,无跨膜区,无信号肽序列,局部亲水性较强,全长蛋白抗原指数较高,若进行全长表达,可引起良好的免疫。由图1b)可知,N蛋白编码区的遗传稳定性较高,SARS-CoV-2 N蛋白与其他典型的冠状病毒N蛋白比对,中间序列相似性高,N蛋白序列具有保守性;SARS-CoV-2 N蛋白与SARS-CoV同源性为90.5%,与Bat coronavirus同源性为91.0%,与MERS-CoV同源性为49.7%,且在N端和C端显示出明显差异。
2.2 重组质粒构建与鉴定分析
PCR扩增和重组质粒酶切鉴定结果如图2所示,其中,M为DNA Marker,图2a)中1为PCR扩增产物,图2b)中1为pET28a/N的双酶切产物。由图2a)可知,PCR扩增产物经1%琼脂糖凝胶电泳显示了单一条带,大小与预期相符(1257 bp)。由图2b)可知,将PCR产物回收,双酶切后的线性化载体pET28a 连接并转化大肠杆菌DH5α感受态细胞,挑取单菌落进行菌液PCR和双酶切鉴定,结果显示有两条较明显的条带,其中位于1257 bp的条带是双酶切后的目的基因,位于5369 bp左右的条带是双酶切后的线性化载体pET28a。
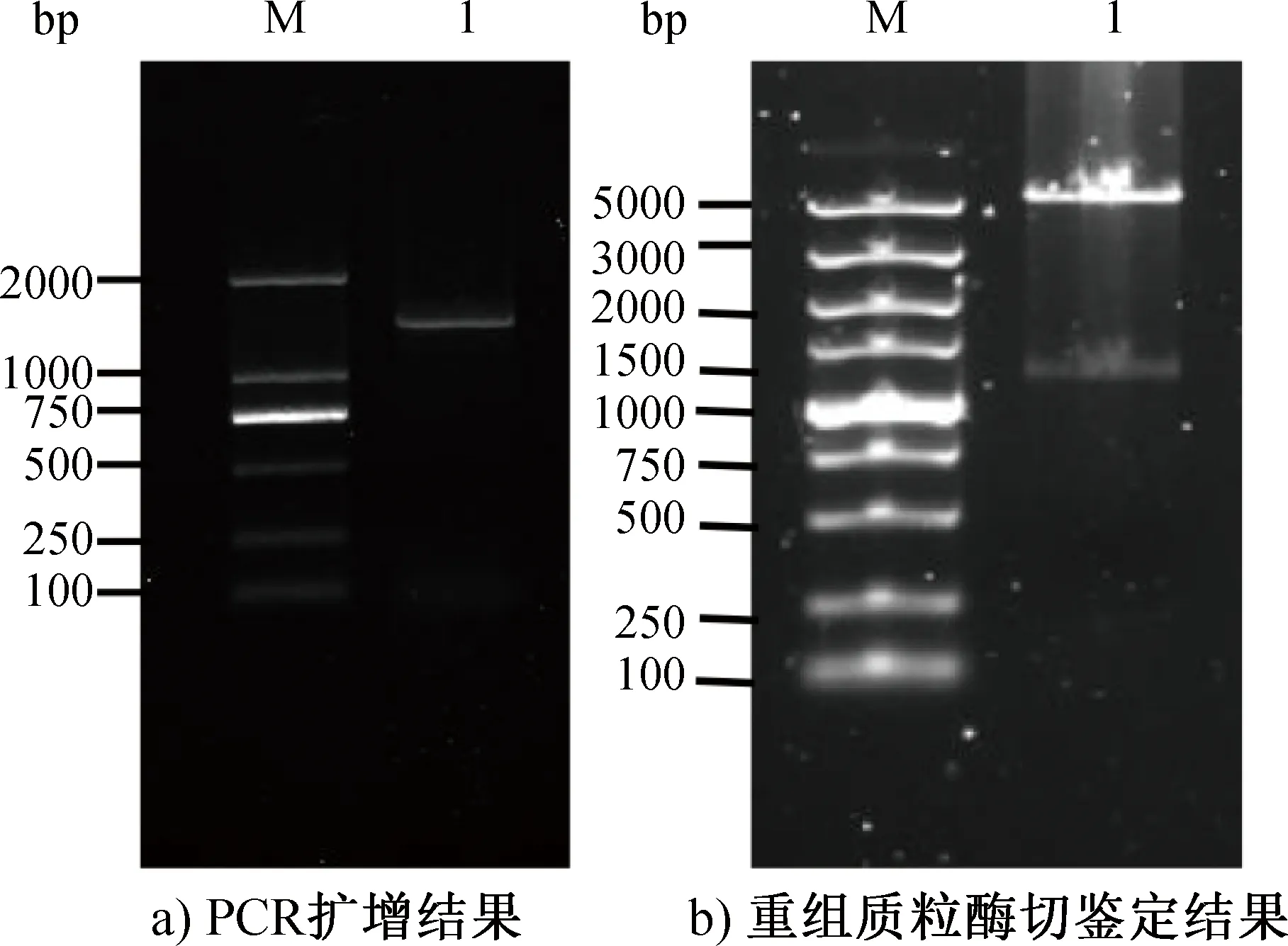
图2 PCR扩增和重组质粒酶切鉴定结果
2.3 SARS-CoV-2 N蛋白可溶性分析
SARS-CoV-2 N重组蛋白在3种不同温度诱导下的表达结果如图3所示,其中,M为蛋白Marker,1为37 ℃诱导后的上清液,2为37 ℃诱导后的沉淀,3为25 ℃诱导后的上清液,4为25 ℃诱导后的沉淀,5为16 ℃诱导后的上清液,6为16 ℃诱导后的沉淀。由图3可知,工程菌BL21(DE3)/pET28a/N在IPTG终浓度为0.2 mmol/L时,在25 ℃和16 ℃诱导下的上清液中均出现了一条明显目的条带,证明SARS-CoV-2 N蛋白为可溶性蛋白,且其在16 ℃诱导下的表达量最高。因此确定诱导条件为工程菌在IPTG终浓度为0.2 mmol/L、16 ℃诱导20 h,蛋白呈可溶性表达,且此时蛋白的表达量最高,占总蛋白表达量的70%。
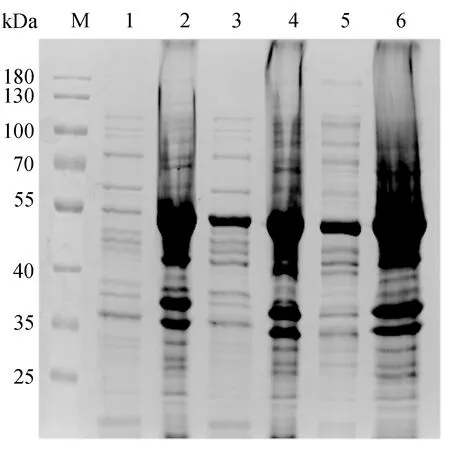
图3 SARS-CoV-2 N重组蛋白在3种不同温度诱导下的表达结果
2.4 目的蛋白Ni-NTA亲和层析纯化分析
SARS-CoV-2 N蛋白Ni-NTA亲和层析纯化结果如图4所示,其中,M为蛋白Marker,1为未诱导的菌液,2为在16 ℃条件下用0.2 mmol/L IPTG诱导后的菌液,3为纯化后的目的蛋白。由图4可知,目的蛋白在300 mmol/L咪唑时被洗脱,纯化后的蛋白条带明显,其下有一条细微条带,SDS-PAGE电泳检测分子质量约为55 kDa,相对分子质量的大小与预期目的蛋白大小一致,其浓度和纯度均较高。
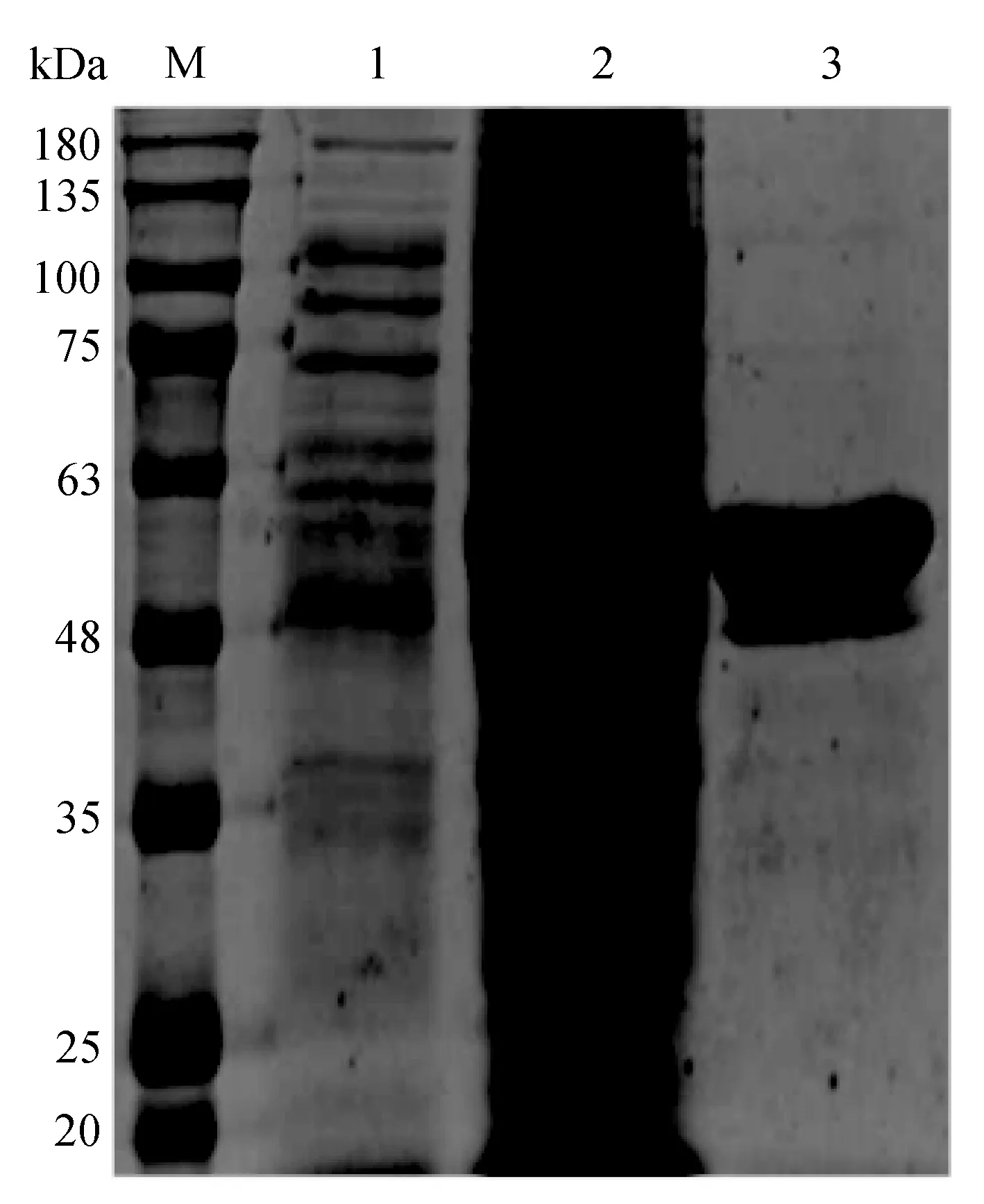
图4 SARS-CoV-2 N蛋白Ni-NTA亲和层析纯化结果
2.5 目的蛋白凝胶过滤层析纯化分析
SARS-CoV-2 N蛋白凝胶过滤层析纯化结果如图5所示,其中,M为蛋白Marker,1—8为纯化的蛋白。由图5可知,该目的蛋白在凝胶过滤层析后仍存在细微条带,经凝胶成像系统分析,其纯度可达90%以上。凝胶过滤层析纯化可将亲和层析纯化后蛋白液中的咪唑去除,方便后续检测方法的建立。
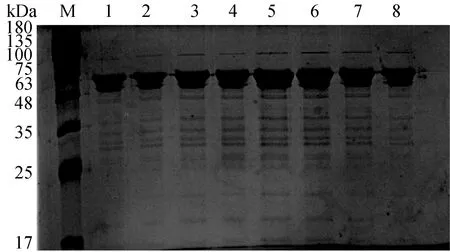
图5 SARS-CoV-2 N蛋白凝胶过滤层析纯化结果
2.6 目的蛋白免疫印记检测分析
SARS-CoV-2 N蛋白免疫印迹分析结果如图6所示,其中,1为纯化后的目的蛋白,2为阴性对照,M为蛋白Marker。由图6可知,重组蛋白与His-Tag抗体反应后,在55 kDa左右出现的特异性目标条带清晰,与预期蛋白分子质量大小相符,其下细微条带也发生了特异性反应,分析为蛋白本身产生的条带,而在阴性对照组中未见目标条带,证实特异性目标条带为目的蛋白。
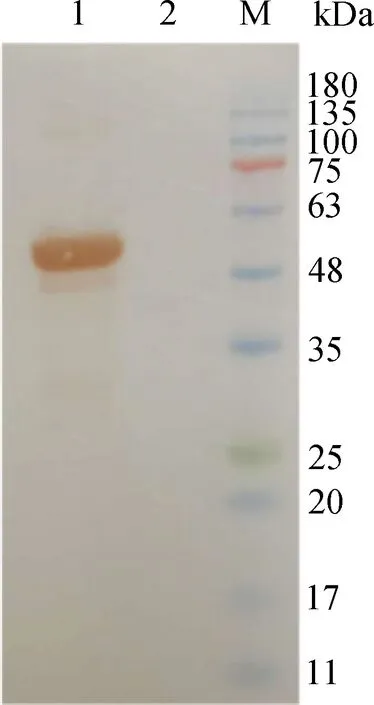
图6 SARS-CoV-2 N蛋白免疫印迹分析结果
3 结论
本文采用生物信息学手段对SARS-CoV-2 N蛋白进行亲疏水性、跨膜区、抗原表位预测及多序列比对分析发现,SARS-CoV-2 N蛋白等电点(PI)为10.10,无跨膜区,无信号肽序列,局部亲水性较强,全长蛋白抗原指数较高,全长表达可引起良好的免疫,序列具有保守性,与SARS-CoV同源性为90.5%,与Bat coronavirus同源性为91.0%,与MERS-CoV同源性为49.7%,且中间序列相似性较高,在N端和C端显示出明显差异,可成为诊断分析药物的合适候选靶点;本文选取SARS-CoV-2蛋白基因组中保守性强的N蛋白基因作为目的基因插入到pET28a载体中,成功构建了重组质粒,大肠杆菌原核表达蛋白在16 ℃低温诱导条件下以可溶性蛋白的形式存在,且其表达量占总蛋白表达量的70%;纯化得到的重组N蛋白的纯度达90%,通过该方法能够得到纯度和浓度均较高的目的蛋白。本研究所构建的重组N蛋白可作为诊断抗原,也可用于制备抗血清抗体或单克隆抗体,而建立酶联免疫吸附剂测定、免疫荧光技术、胶体金免疫层析等快速检测方法,有望协助新型冠状病毒的诊断和防控。
