替莫唑胺联合调强适形放疗对高级别脑胶质瘤术后患者血清指标与预后的影响
2022-08-11姚俊朝王垒垒金治宾
刘 晨,姚俊朝,张 祥,王垒垒,金治宾
(沧州市中心医院神经外科,河北 沧州 061000)
脑胶质瘤作为常见的一种颅内神经上皮恶性肿瘤,其病理分级为Ⅰ ~ Ⅳ,其中Ⅲ、Ⅳ级为高级别脑胶质瘤,与低级别相比,高级别脑胶质瘤恶性程度高,癌细胞增殖速度快。手术切除是高级别脑胶质瘤的主要治疗方式,但术后患者极易在短期内复发,因此术后辅助治疗尤为关键。调强适形放疗主要根据患者具体情况设定针对性治疗方案,术后杀伤残留肿瘤细胞,有效控制肿瘤细胞的增殖、转移,延长患者生存期,但不是所有肿瘤细胞对放射线都敏感,因此单纯放疗预防术后复发的效果有限[1]。替莫唑胺通过对脱氧核糖核酸(DNA)碱基的强甲基化产生抗癌作用,具有起效快、抗肿瘤活性广、生物利用度高等特点,在恶性肿瘤的治疗中应用广泛,可辅助放疗应用[2]。本研究旨在探讨高级别脑胶质瘤术后患者采用替莫唑胺联合调强适形放疗对其血管内皮生长因子(VEGF)、表皮生长因子(EGF)、肝细胞生长因子(HGF)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料按照随机数字表法将2020年1月至12月沧州市中心医院收治的110例高级别脑胶质瘤患者分为两组,各55例。对照组患者中男性30例,女性25例;年龄40~62岁,平均(47.46±3.02)岁;星形胶质细胞瘤27例,间变性少突胶质细胞瘤15例,混合性胶质瘤13例;肿瘤最大直径2~7 cm,平均(4.43±0.56) cm;病理分级[3]:Ⅲ级36例,Ⅳ级19例。观察组患者中男性32例,女性23例;年龄38~61岁,平均(46.89±2.78)岁;星形胶质细胞瘤29例,间变性少突胶质细胞瘤14例,混合性胶质瘤12例;肿瘤最大直径2~6 cm,平均(4.38±0.30) cm;病理分级:Ⅲ级34例,Ⅳ级21例。两组患者一般资料经比较,差异无统计学意义(P>0.05),组间可比。纳入标准:符合《中国中枢神经系统胶质瘤诊断与治疗指南(2015)》[4]中的相关诊断标准者;病理检查分级均为Ⅲ ~ Ⅳ级者;经检查生命体征平稳者等。排除标准:有既往脑出血病史者;有放化疗禁忌证者;患严重心血管疾病者等。沧州市中心医院医学伦理委员会批准本研究,且患者及其家属均签署知情同意书。
1.2 治疗方法术后2~4周手术切口愈合后,对照组患者接受调强适形放疗:患者保持仰卧位,使用热塑面罩将头部固定,并进行磁共振成像系统[西门子(深圳)磁共振有限公司,型号:MAGNETOM Altea]扫描(头顶至上颈部层距、层厚各3 mm),勾画固定靶向治疗区域(靶区、危险器官)后制定具体的治疗计划,肿瘤靶区(GTV):手术残余病灶及术后残腔;临床靶区(CTV):在GTV边界外扩2.0~2.5 cm及周边水肿带;计划靶区(PTV):CTV外扩0.4 cm。通过剂量体积直方图对治疗计划进行优化评价,勾画脑干、脊髓、垂体及晶体等正常危及器官,95%等计量曲线覆盖PTV,经复位验证后实施放疗,使用医用电子直线加速器(苏州雷泰医疗科技有限公司,型号:VenusX)进行X线分割照射,第一阶段CTV外扩2.0~2.5,2 Gy/次,5次/周,待达50 Gy后修改CTV至GTV外扩1.0~1.5,2 Gy/次,5次/周,共治疗6周后结束治疗,放疗的总量固定为60 Gy。
在此基础上,观察组患者联合替莫唑胺治疗,放疗前1~2 h口服替莫唑胺胶囊(江苏天士力帝益药业有限公司,国药准字H20060880,规格:100 mg/粒),75 mg/(m2·d),服用6周,放疗周期结束4周后,再使用替莫唑胺辅助化疗6个周期,以28 d为1个治疗周期(连续服用5 d,停药23 d),第1周期的服用剂量为150 mg/(m2·d);从第2周期开始可根据患者的耐受程度调整为200 mg/(m2·d),若患者治疗过程中血小板计数<100×109/L、中性粒细胞<1.5×109/L,则下1个周期减少50 mg/m2剂量,但不得低于100 mg/m2。两组患者均于治疗结束后3个月回院复查。
1.3 观察指标①临床疗效:根据入院放疗时的MRI报告与治疗结束出院3个月后复查的MRI报告对比,统计患者的临床疗效,其中治疗后患者所有的病灶较治疗前均完全消失且连续4周以上未出现新的病灶判定为完全缓解;治疗后患者病灶的两径之和较治疗前减小>50%判定为部分缓解;治疗后患者病灶两径之和较治疗前减小≤ 50%或增大≤ 25%,且无新病灶出现为疾病稳定;治疗后患者出现新的病灶或者病灶的长径增大>25%判定为疾病进展[5]。临床客观缓解率=完全缓解率+部分缓解率;疾病控制率=完全缓解率+部分缓解率+疾病稳定率。②血清VEGF、EGF、HGF水平:采集两组患者治疗前后的空腹静脉血3 mL,制备血清(通过离心机以3 000 r/min转速离心15 min),采用酶联免疫吸附实验法检测血清VEGF、EGF、HGF水平。③免疫功能:采血方法同②,依据流式细胞仪检测外周血CD3+、CD4+、CD8+百分比,并计算CD4+/CD8+比值。④不良反应:统计两组患者治疗期间不良反应(恶心、呕吐、骨髓抑制、肝功能异常等)发生情况。
1.4 统计学方法应用SPSS 20.0统计学软件分析数据,计数资料以[ 例(%)]表示,采用χ2检验;本研究计量资料数据经S-W法检验证实服从正态分布,以(±s)表示,组内治疗前后比较采用配对t检验,两组间比较采用独立t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较治疗后3个月,观察组患者的客观缓解率与疾病控制率(47.27%、72.73%)均显著高于对照组(29.09%、52.73%),差异均有统计学意义(均P<0.05),见表1。
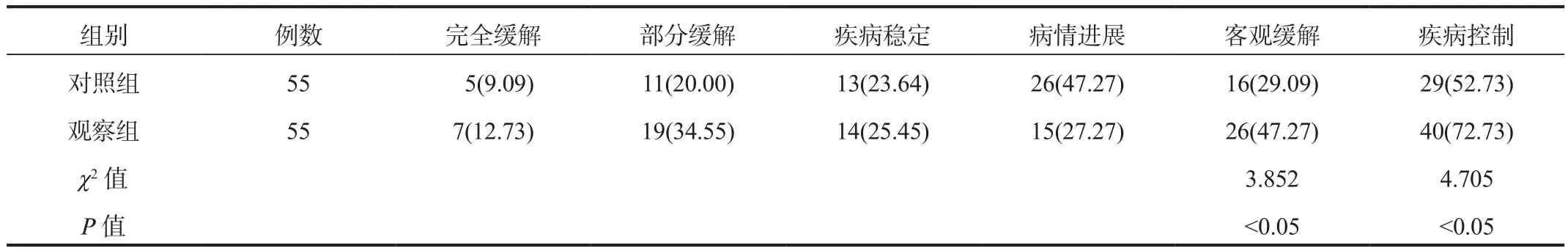
表1 两组患者临床疗效比较[ 例(%)]
2.2 两组患者血清VEGF、EGF、HGF水平比较与治疗前比,治疗后两组患者血清VEGF、EGF、HGF水平均显著降低,且观察组显著低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者血清VEGF、EGF、HGF水平比较( ±s)
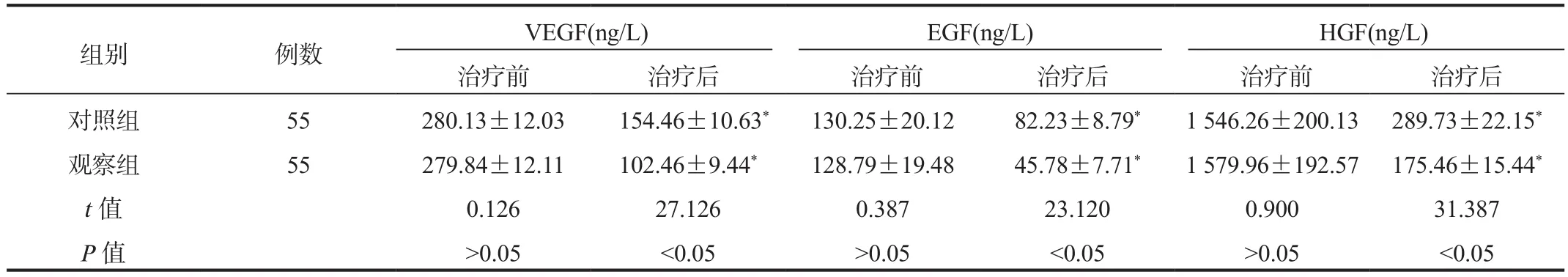
表2 两组患者血清VEGF、EGF、HGF水平比较( ±s)
注:与治疗前比,*P<0.05。VEGF:血管内皮生长因子;EGF:表皮生长因子;HGF:肝细胞生长因子。
组别 例数 VEGF(ng/L) EGF(ng/L) HGF(ng/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 55 280.13±12.03 154.46±10.63* 130.25±20.12 82.23±8.79* 1 546.26±200.13 289.73±22.15*观察组 55 279.84±12.11 102.46±9.44* 128.79±19.48 45.78±7.71* 1 579.96±192.57 175.46±15.44*t值 0.126 27.126 0.387 23.120 0.900 31.387 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者免疫功能指标比较治疗后两组患者外周血CD3+、CD4+百分比、CD4+/CD8+比值均显著低于治疗前,但观察组显著高于对照组;外周血CD8+百分比均显著高于治疗前,但观察组显著低于对照组,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者免疫功能指标比较( ±s)
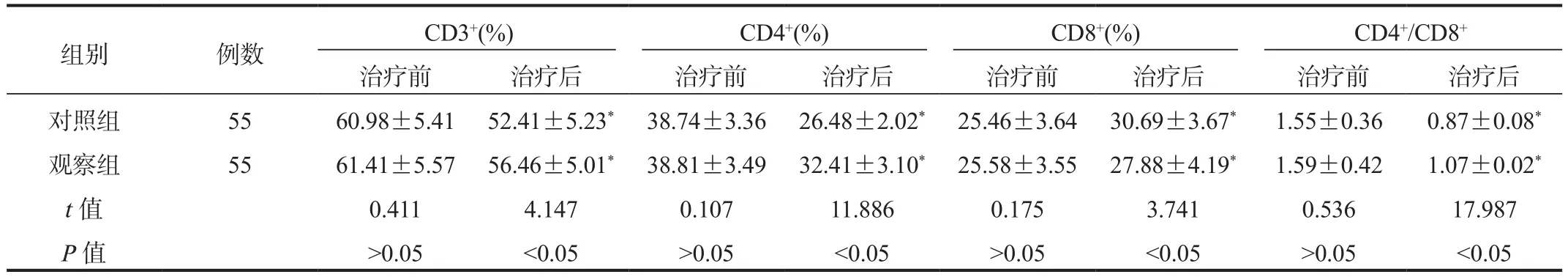
表3 两组患者免疫功能指标比较( ±s)
注:与治疗前比,*P<0.05。
组别 例数 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 55 60.98±5.41 52.41±5.23* 38.74±3.36 26.48±2.02* 25.46±3.64 30.69±3.67* 1.55±0.36 0.87±0.08*观察组 55 61.41±5.57 56.46±5.01* 38.81±3.49 32.41±3.10* 25.58±3.55 27.88±4.19* 1.59±0.42 1.07±0.02*t值 0.411 4.147 0.107 11.886 0.175 3.741 0.536 17.987 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 两组患者不良反应发生情况比较比较两组患者不良反应总发生率,差异无统计学意义(P>0.05),见表4。
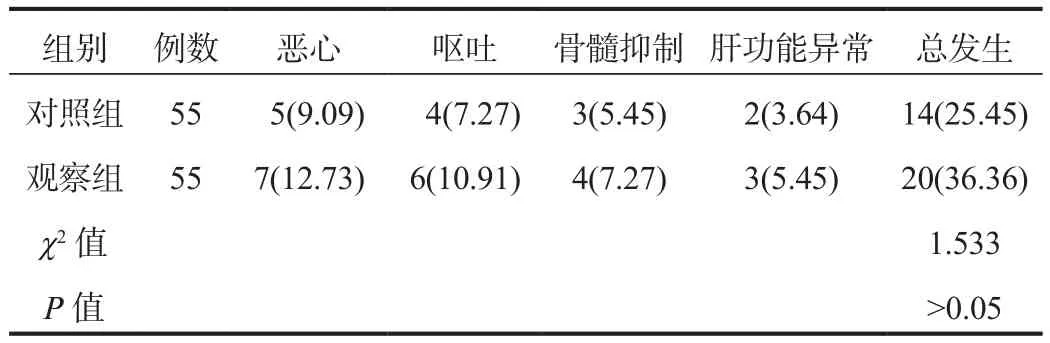
表4 两组患者不良反应发生情况比较[ 例(%)]
3 讨论
浸润性生长是高级别脑胶质瘤最为突出的生物学表现,肿瘤细胞向周围组织浸润使得肿瘤病灶界限消失,且神经系统解剖结构复杂,导致手术往往难以全部切除肿瘤病灶,残留肿瘤病灶易导致术后复发。术后临床常用调强适形放疗作为辅助手段,其采用多野分散照射技术,亦可精确定位病灶,减少正常组织与危及器官的照射剂量,从而在消除残留病灶的同时,尽量避免周围正常组织受到辐射损伤,从而减少术后肿瘤的复发。然而高级别脑胶质瘤对放疗的敏感性欠佳,且因血脑屏障的存在易对放疗的效果产生影响,进而不足以控制肿瘤的复发,单独应用效果受限[6]。
研究显示,肿瘤组织可释放多种免疫抑制因子,使患者机体处于免疫抑制状态,放疗在杀伤消灭肿瘤细胞的同时也可对机体正常的免疫机制造成损伤,加重机体的免疫抑制[7]。替莫唑胺为烷化剂 - 咪唑四嗪类衍生物,可透过血脑屏障进入脑脊液,在病灶部位形成有效的血药浓度,不经肝脏代谢便能够促使肿瘤细胞DNA甲基化,阻止细胞增殖,促使其凋亡,发挥显著的抗肿瘤效果,从而控制局部肿瘤进展,改善患者的免疫功能,且不易出现较为严重的不良反应,应用于术后患者治疗中具有较高的安全性[8]。本研究中,治疗后,相较于对照组,观察组患者的客观缓解率与疾病控制率、外周血CD3+、CD4+百分比,CD4+/CD8+比值均显著升高,外周血CD8+百分比显著降低,而两组患者不良反应总发生率比较,差异无统计学意义,表明替莫唑胺联合调强适形放疗辅助高级别脑胶质瘤术后治疗,相较于单独采用调强适形放疗,能够显著改善机体的免疫抑制状态,且不增加不良反应的发生,安全性良好。
高级别脑胶质瘤具有浸润性、弥漫性的特点,VEGF与受体结合后,可增强病灶内血管生长能力,进而驱动肿瘤细胞浸润性生长,加重恶性程度;HGF过表达可提高细胞外基质的降解速度,提高脑胶质瘤细胞的增殖、侵袭能力,加重患者病情;EGF与表皮生长因子受体(EGFR)结合后,可引起细胞膜或胞内酪氨酸残基特异蛋白激酶从失活转变为活性形式,从而激活下游多种细胞信号传导通路而促进脑胶质瘤细胞的生长[9]。替莫唑胺可攻击肿瘤细胞的DNA,损害DNA烷化基,阻止鸟嘌呤上第6位氧原子寻找到行配对的碱基,阻碍DNA复制,从而阻止肿瘤细胞增殖,诱导肿瘤细胞凋亡或自噬,有效改善VEGF、EGF、HGF水平[10]。本研究中,治疗后观察组患者的血清VEGF、EGF、HGF水平均显著低于对照组,表明高级别脑胶质瘤患者术后应用替莫唑胺联合调强适形放疗能够降低血清VEGF、EGF、HGF水平,促进病情恢复。
综上,在调强适形放疗的基础上,联合替莫唑胺辅助化疗高级别脑胶质瘤术后患者,能够有效降低血清VEGF、EGF、HGF水平,改善机体的免疫抑制状态,且安全性高,疗效显著,临床应用前景广阔。
