细胞保护蛋白PTD-FNK生物信息学分析
2022-08-11纪伟霞胡传活马祺琦何芝凤汪燕玲
纪伟霞,胡传活,马祺琦,何芝凤,黄 芳,汪燕玲
(1.广西大学动物科学技术学院,广西南宁 530004;2.广西壮族自治区畜牧研究所,广西南宁 530001)
在医学临床上,有不少人工体外表达的融合蛋白被应用于疾病的治疗,起到了改善患者临床症状的作用。这些融合蛋白中,FNK蛋白是一种人工构建的细胞保护蛋白,来源于大鼠Bcl-xL蛋白;PTD是自身具有跨膜活性的蛋白转导结构域,能将与其通过化学交联或基因工程连接的外源物质包括大分子、药物等带进细胞。将PTD与FNK结合获得的PTD-FNK蛋白,其穿透细胞的能力很强,对各种异常刺激引起的凋亡与坏死细胞具有保护作用,对各种类型细胞受到的多种损害刺激具有良好的防御作用。这种组织细胞保护作用目前已经在人的临床治疗上被广泛应用,但关于 PTD-FNK 蛋白的作用机理尚不清楚。本试验通过生物信息学技术并结合互作蛋白方法,研究 PTD-FNK 蛋白在细胞凋亡、精子发生过程中的作用,以期为进一步探究PTD-FNK蛋白的功能提供基础依据。
1 材料与方法
1.1 试验材料
PTD-FNK蛋白基因序列由广西大学动物解剖实验室重组构建并测序。
1.2 试验方法
1.2.1 蛋白质的理化性质分析 利用Expasy中Protparam(https://web.expasy.org/protparam)分析PTD-FNK蛋白质的相对分子质量、理论等电点、不稳定指数等理化性质。
1.2.2 蛋白亲疏性分析 利用ProtScale(https://web.expasy.org/protscale/)在线工具Kyte & Doolittle进行分析。
1.2.3 蛋白二级结构预测 利用SOPMA(https://prabi.ibcp.fr/htm/site/web/login/SOPMA)进行预测,分析无规律卷曲、α-螺旋、β-转角和延伸链的比例。
1.2.4 蛋白三级结构建模 利用SWISS-MODEL(http://www.swissmodel.expasy.org/)在线软件进行分析。
1.2.5 蛋白亚细胞定位 利用WoLF PSORT(http://wolfpsort.hgc.jp/)在线软件进行定位。
1.2.6 蛋白的跨膜区分析 利用TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM)在线软件进行分析。
1.2.7 蛋白的信号肽分析 利用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)分析。
1.2.8 蛋白翻译后修饰位点 利用NetGlyc(http://www.cbs.dtu.dk/services/NetGlyc/)在线软件分析-糖基化位点;利用YingOYang(http://www.cbs.dtu.dk/services/YingOYang)在线软件分析-糖基化位点;利用NetPhos 3.1 Server(http:www.cbs.dtu./dk/services/NetPhos/)在线软件预测磷酸化位点(阈值都为0.5)。
1.2.9 蛋白抗原表位分析 利用Predicting Antigenic Peptides(http://imed.med.ucm.es/Tools/antigenic.p-l)预测分析抗原决定簇(阈值为0.5);利用IEDB(http://tools.im-muneepitope.org/bcell/)预测分析B细胞抗原表位(阈值为0.5)。
1.2.10 功能结构域分析 利用NCBI的保守域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行预测。
1.2.11 蛋白的互作蛋白分析 为了研究PTD-FNK蛋白在猪睾丸支持细胞中的互作蛋白质,于2020年6—10月选取广西省南宁市各猪场2周龄左右仔猪,无菌操作摘取其睾丸,用生理盐水冲洗,低温送至实验室后,立即分离培养支持细胞;送往武汉金开瑞生物工程有限公司,利用HIS Pulldown技术拉取PTD-FNK蛋白未知的互作蛋白,得到的蛋白序列号利用UniProt数据库分析排名靠前蛋白的结构、功能和序列。
2 结果与分析
2.1 PTD-FNK蛋白理化性质
利用在线软件ProtParam分析了PTD-FNK蛋白氨基酸序列组成和理化性质。由表1可知,该蛋白质共含有295个氨基酸,蛋白质分子质量为 33.195 ku,理论等电点为6.63,为酸性蛋白质,分子式为CHNOS,包含20种氨基酸。其中,占比最高的是丝氨酸,占比为10.2%;最低的是半胱氨酸,占比为0.3%。带负电荷数(天冬氨酸+谷氨酸)为35个,带正电荷数(精氨酸+赖氨酸)32个。软件分析结果显示,PTD-FNK蛋白消光系数为47 440,蛋白质不稳定指数为42.33(>40),为不稳定蛋白,脂肪系数为64.81,预计蛋白在体外哺乳动物类网状红细胞中的半衰期为30 h,在酵母体内的半衰期>20 h,在大肠杆菌体内的半衰期>10 h。PTD-FNK蛋白亲疏性分析结果显示,亲水性平均值(grand average of hydropathicity,简称GRAVY)是-0.589(<0),为亲水性蛋白质。
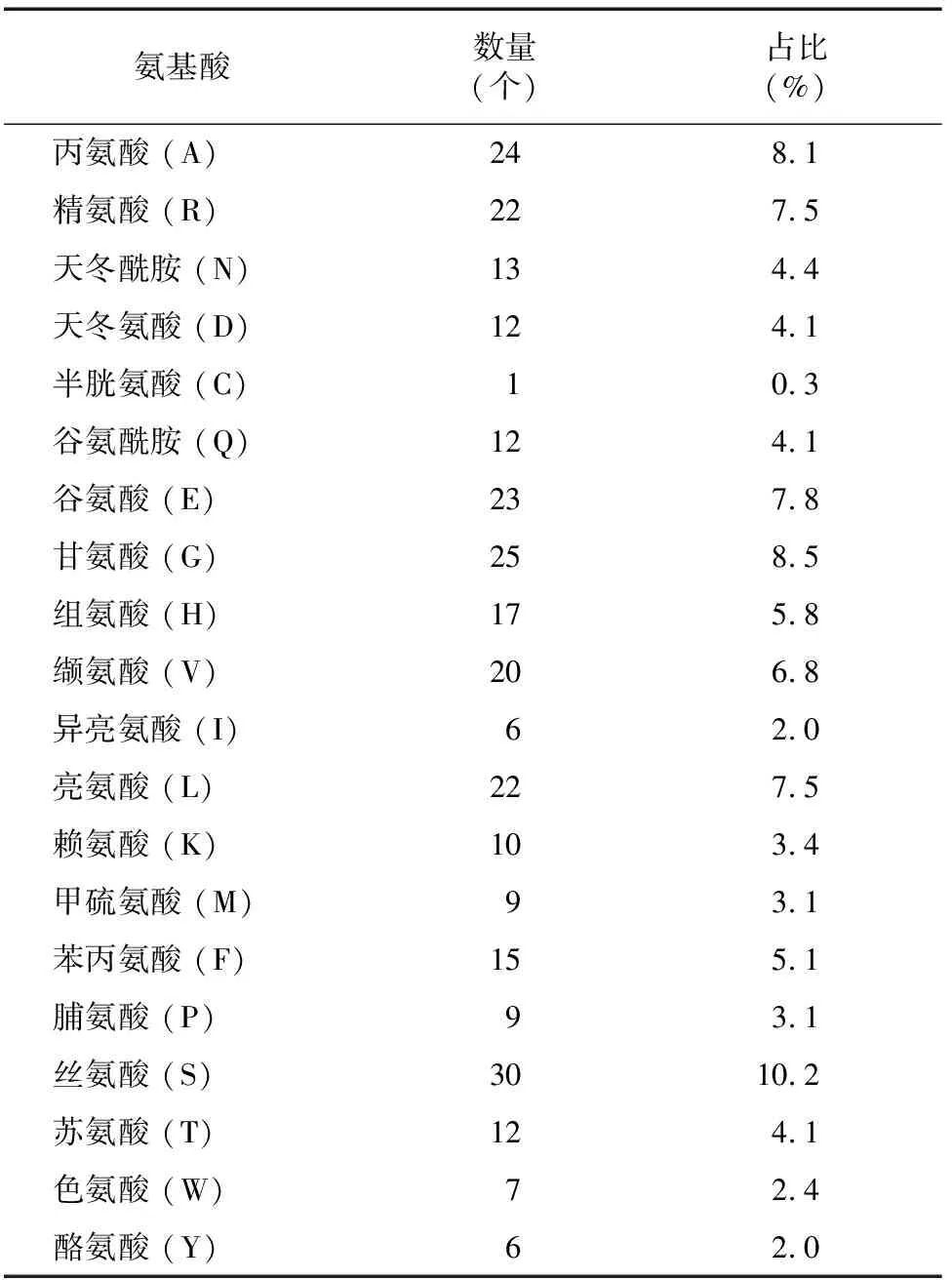
表1 PTD-FNK蛋白的氨基酸组成
2.2 PTD-FNK蛋白亲水、疏水性
利用ProtScale在线预测PTD-FNK蛋白的亲、疏水性,结果见图1。疏水区最大值为第269位氨基酸,为2.533,亲水区最小值为第43位氨基酸,值为-4.256,平均疏水性(GRAVY)值为-0.589,为亲水性蛋白质,此结果与ProtParam预测结果相一致。
2.3 PTD-FNK蛋白二级结构
由图2可知,PTD-FNK蛋白有116个氨基酸参与无规则卷曲,占比为39.32%,有132个氨基酸参与α-螺旋,占比44.75%,有28个氨基酸参与延伸链的构成,占比为9.49%,有19个氨基酸参与 β-转角,占比为6.44%。

2.4 PTD-FNK的三级结构
由图3可知,PTD-FNK蛋白三维模型主要由无规卷曲和α-螺旋组成,QMEAN(qualitative model energy analysis)值为-1.27,与Bcl-2同源性为98.71%,与参考蛋白模板匹配性较高,肽段覆盖性相似度较高。
2.5 PTD-FNK蛋白亚细胞定位
PTD-FNK的亚细胞定位分数分别为细胞核21,线粒体5,细胞质膜4,过氢物酶体 2。定位分数显示PTD-FNK定位在动物细胞细胞核中。
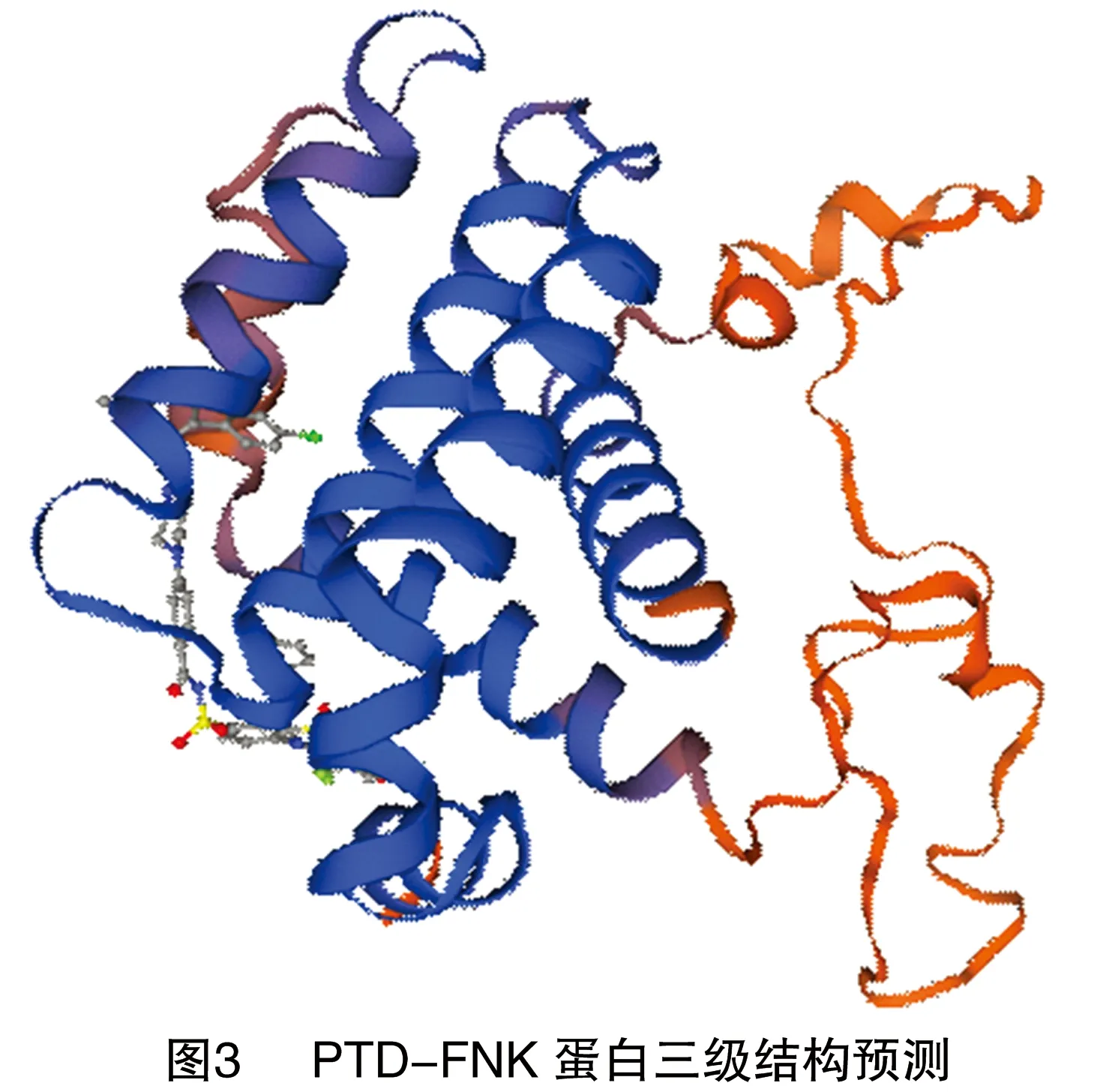
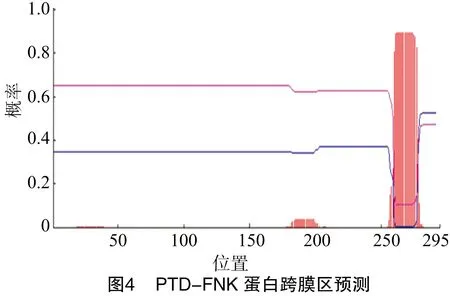
2.6 PTD-FNK蛋白的跨膜区
由图4可知,PTD-FNK蛋白有1条跨膜螺旋区,位于260~277位。
2.7 PTD-FNK蛋白的信号肽
利用SignalP-5.0软件实现的PTD-FNK蛋白信号肽分析方法,利用综合剪切点分值的最大值来估计信号肽的正确剪切位置,并通过信号肽分值(值>0.5)来确定蛋白质是否为分泌蛋白质。由图 5可知,第28位氨基酸值最大值为0.113,值第1~16位氨基酸的平均值为0.139(<0.5),说明PTD-FNK蛋白不具有分泌信号肽的特征,因此进行蛋白原核表达前不需要对该蛋白进行修饰。值与值均小于阈值0.5,预测该蛋白没有信号肽结构。
2.8 PTD-FNK蛋白的翻译后修饰位点
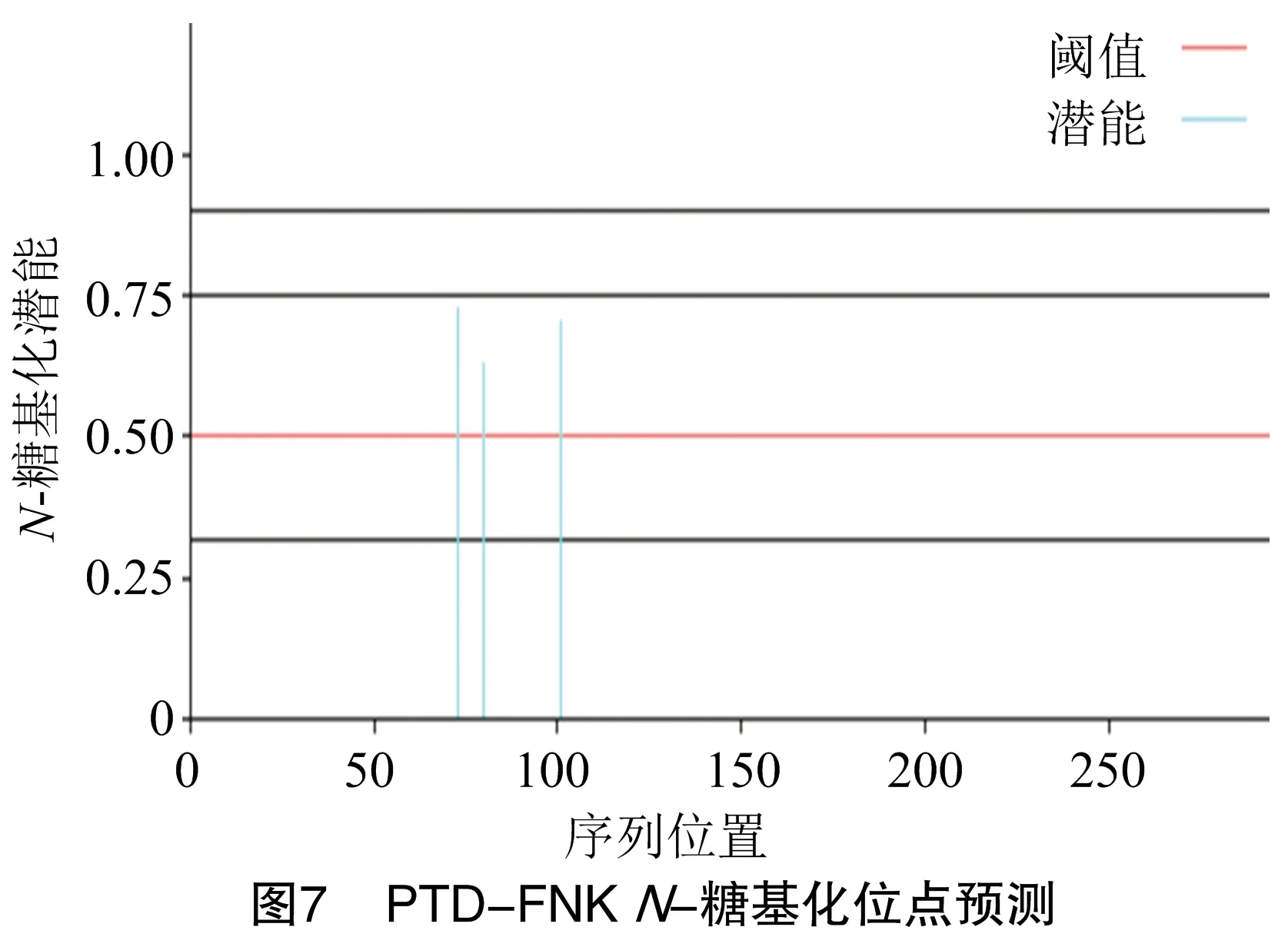
由图6可知,PTD-FNK蛋白有7个潜在的-糖基化位点,分别位于第3、4、11、119、153、165、211氨基酸。由图7可知,PTD-FNK蛋白有3个潜在的N-糖基化修饰位点,分别位于第73位、80位、101位氨基酸。由图8可知,PTD-FNK蛋白含有23个丝氨酸磷酸化修饰位点、2个酪氨酸磷酸化修饰位点、8个苏氨酸磷酸化修饰位点,包含有PKC、PKA、PKG、UNSP、P38MAPK、RSK、ATM、CKI、CKII、CDC2、GSK3、DNAPK、INSR总共13类蛋白质激酶结合位点。


2.9 PTD-FNK蛋白抗原表位
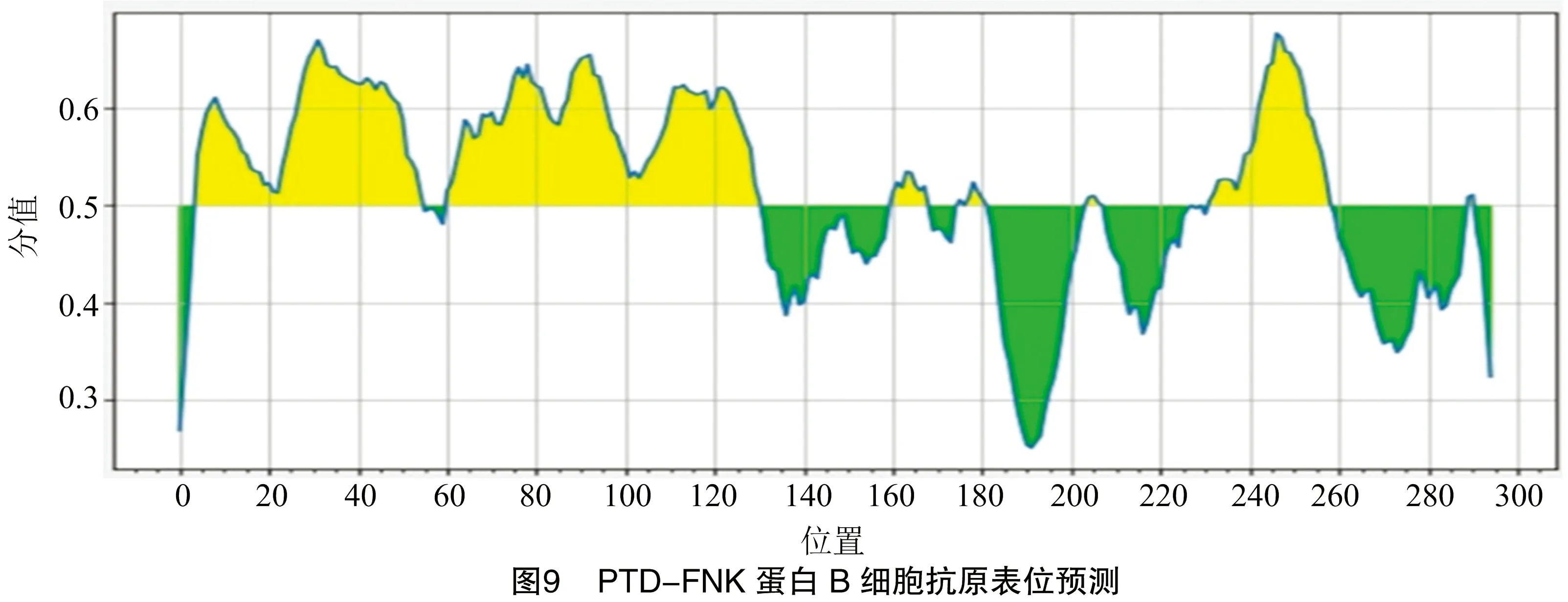
由图9可知,利用Predicting Anti-genic Peptides软件分析发现,PTD-FNK蛋白有8个潜在的抗原决定簇;利用IEDB软件分析B细胞抗原表位发现,连续氨基酸数量超过10个的B细胞抗原表位有3个,分别是:5~55、61~131、232~259位氨基酸。
2.10 功能结构域分析
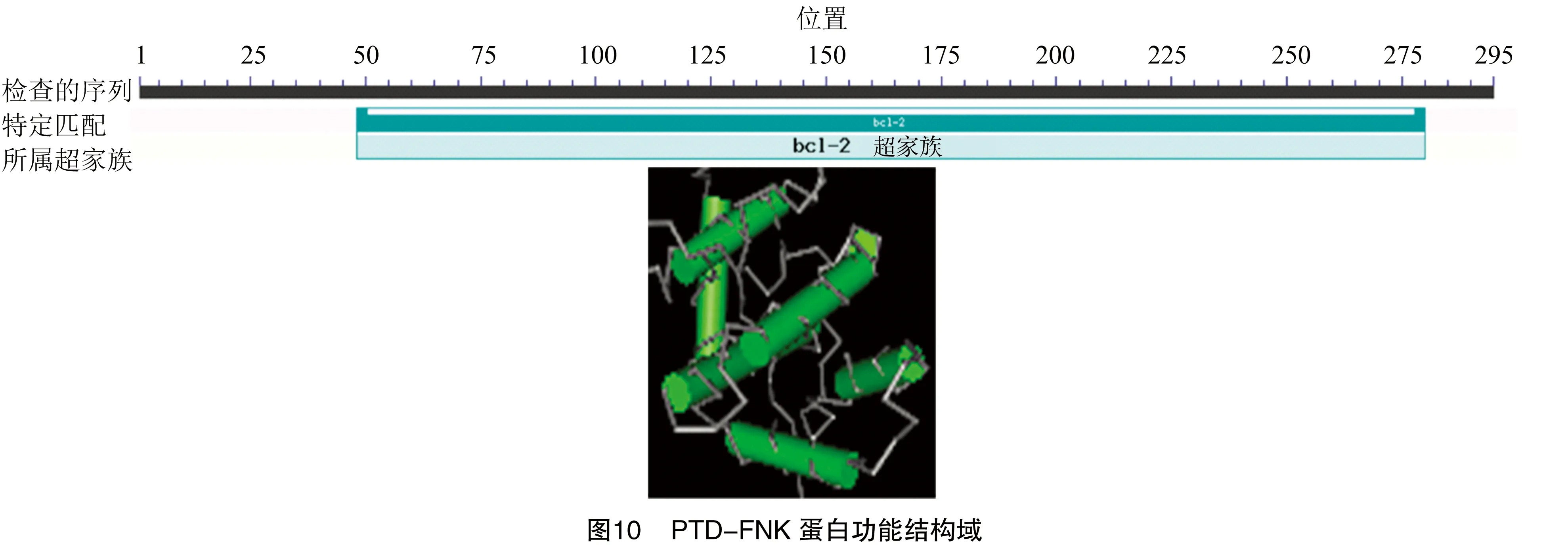
利用NCBI的数据库进行功能结构域分析,结果显示,PTD-FNK参与了细胞程序化死亡。由图10可见,PTD-FNK在第48~280位氨基酸处含有保守结构域Bcl-2,该结构域属于Bcl-2超家族,因此PTD-FNK蛋白通过Bcl-2保守结构域起到抑制细胞凋亡的作用。
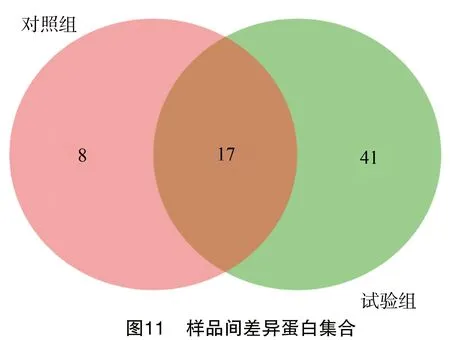
2.11 PTD-FNK蛋白的互作蛋白
通过HIS pull-down技术拉取PTD-FNK未知互作蛋白,由图11可知,对照组识别到了25个蛋白,加入PTD-FNK蛋白的试验组识别到了58个蛋白,其中2个组别共同检测到了17个蛋白。排名靠前的有78 ku葡萄糖调节蛋白、波形蛋白、组蛋白、肌球蛋白、肌动蛋白、绒毛蛋白-1、角蛋白、微管蛋白β链等,见表2。

表2 PTD-FNK蛋白的互作蛋白信息
3 讨论与结论
Bcl-xL属于Bcl-2家族中的抗凋亡蛋白成员之一,在细胞凋亡途径中起着极大的作用。它是从禽类的DNA互补文库中被发现的,具有降低细胞凋亡和坏死过程的功能。然而Bcl-xL一旦被磷酸化,将促进细胞凋亡活性,抑制其治疗功效。因此,超级抗凋亡因子FNK是Asoh等通过定点突变大鼠Bcl-xL蛋白的3个氨基酸(22酪氨酸Y→苯丙氨酸 F、26谷氨酰胺Q→天冬酰胺N和165精氨酸R→赖氨酸K)构建。PTD是蛋白转导结构域,它的特点是转导速度极快、在转运的过程中不需要消耗能量和具有广谱性等。将PTD与FNK二者结合获得的PTD-FNK蛋白,能快速转入细胞。现已证明,PTD-FNK蛋白可以提高冷冻猪、水牛精子的活性,可能是通过抑制内源性线粒体途径介导的凋亡发挥对猪精子冷冻解冻的保护作用。大多试验是关于PTD-FNK蛋白功能方面的研究,关于其作用机制的研究及PTD-FNK蛋白与其他蛋白之间的联系鲜有研究,本试验旨在探讨PTD-FNK是否可能通过自身机理或与其他蛋白结合调控细胞凋亡、细胞损伤和应急过程。
预测结果显示,PTD-FNK蛋白是一类化学性质不稳定、酸性强的小分子结构亲水性蛋白质。PTD-FNK蛋白的二级分子结构中无规则卷曲含量较高,因此易于研发抗体;此外,在无规则卷曲的蛋白质肽链中,形成了配体和受体结合的部位,其结构易受侧链影响而发生改变,表明PTD-FNK可能存在着较多的抗原表位,针对疫苗问题相关有待进一步研究。PTD-FNK可能具有跨膜区域和多个翻译后的修饰位点,推断该蛋白质是具有不同修饰表型的跨膜蛋白。而PTD-FNK蛋白存在与激酶磷酸化相关的PKA、PKC、P38MAPK 等特异性位点,影响线粒体凋亡途径释放出CytC,激活Caspase级联反应抑制细胞凋亡。
互作蛋白鉴定结果显示,排名靠前的有波形蛋白、肌动蛋白、葡萄糖调节蛋白78、组蛋白、肌球蛋白、绒毛蛋白-1、角蛋白等。肌球蛋白介入细胞的吞噬、运动、受精和物质运输等生理过程;可以推测在睾丸支持细胞中,PTD-FNK蛋白可与该功能的蛋白结合,迅速进入细胞内,参与细胞运动、受精等过程。葡萄糖调节蛋白78(78-ku glucose-regulated protein,GRP 78)是热休克蛋白70家族的成员之一,也被称为免疫球蛋白重链结合蛋白,是内质网中重要的一种分子伴侣,主要定位和表达于内质网等细胞器,具有抑制细胞调亡的作用。大量表达的GRP78可在低糖、低氧、低Ca等刺激环境下起到维持内质网的稳定进而保护细胞的作用,GRP78过表达使内质网未折叠蛋白叠加,导致氧糖失衡、钙超载、氧化应激和低氧环境等,最终引起内质网应激。可以推断PTD-FNK蛋白与GRP78结合通过调控内质网应激,减少睾丸支持细胞非正常凋亡。组蛋白在DNA损害过程有重要的调节作用。DNA损伤后组蛋白被释放至细胞质,并转位于线粒体,通过激活BAK蛋白,促进CytC释放并启动线粒体途径的细胞凋亡,推测PTD-FNK蛋白可抑制线粒体释放CytC等凋亡相关蛋白,抑制凋亡发生。绒毛蛋白-1是一种细胞骨架蛋白,参与肌动蛋白成核、肌动蛋白丝束组装等过程,参与细胞侵袭和细胞凋亡等过程。研究表明,波形蛋白是睾丸支持细胞的骨架成分,在维持支持细胞的不对称型形态、生精细胞的排列整齐、支持细胞和生精细胞间的信息沟通、精子成熟和释放、血睾屏障的完整性等方面具有重要作用,主要参与脂多糖的细胞反应,任何影响波形蛋白表达、分布、结构、降解的因素都将影响支持细胞的结构和功能,进而干预精子的发生,证明PTD-FNK蛋白会保护新生睾丸的生精细胞脱落,减少少精子症。
PTD-FNK蛋白通过PKA、PKC特异性蛋白激酶结合位点参与蛋白酪氨酸磷酸化,介导线粒体细胞凋亡途径;PTD-FNK蛋白通过蛋白间的结合,调控内质网应激、线粒体凋亡途径抑制细胞凋亡并减少少精子症。本试验为PTD-FNK蛋白在细胞凋亡过程、精子发生过程的作用机制提供了依据。
