蜈蚣草根际及内生微生物群落对砷污染胁迫的响应机制研究
2022-08-10高鹏高品孙蔚旻孔天乐黄端仪刘华清孙晓旭
高鹏,高品,孙蔚旻,孔天乐, ,黄端仪,刘华清,孙晓旭*
1.东华大学环境科学与工程学院,上海 201620;2.广东省科学院生态环境与土壤研究所,广东 广州 510650
砷(arsenic,As)是一种在自然界普遍存在的有毒类金属(Sun et al.,2019),往往以伴生或共生形式赋存于多种(类)金属矿藏中,是开采(类)金属矿产资源过程中常见的类金属污染物(仇荣亮等,2009)。金属矿物提取过程中,砷以废渣、废水和废气的形式被释放到矿区周边环境,对周边土壤、水、植物和人类健康造成严重威胁。土壤是地球之肤,也是农作物生长的载体,土壤砷污染会导致农作物砷积累,进而危害人体健康(焦常峰等,2020)。有研究报道,亚洲最大的湖南石门雄黄矿周边农用土壤砷质量分数达1300 mg·kg-1,超出中国土壤环境质量标准(GB 15618—2008)中二级标准值的29倍以上(Tang et al.,2016),而与之毗邻的锡矿山矿区周边土壤中砷质量分数(2431.81 mg·kg-1)同样远超当地土壤背景值(莫昌琍等,2013)。研究表明,无机态砷(三价砷和五价砷)是砷污染土壤的主要赋存形式,其化合物均属剧毒性物质(Sun et al.,2020)。砷暴露无处不在,当摄入砷过多时会对人体皮肤和神经系统造成危害,增加人类慢性和急性疾病风险,甚至导致癌变(韩永和等,2017)。因此,对砷污染土壤进行修复亟待开展。
砷污染土壤修复技术主要包括物理、化学和植物修复技术(熊金波,2010)。传统物理和化学修复技术成本高,会产生二次污染,从而使得成本低、效果理想、环境友好的植物修复技术备受关注(许飞飞,2017)。植物修复是利用植物及其根际微生物原位修复污染土壤的技术。砷的植物修复技术主要通过砷超富集植物对砷实现超累积(Chen et al.,2002),从而达到修复砷污染土壤的目的(陈同斌等,2010)。蜈蚣草(PterisvittataL.)是世界上第一种被发现具有砷超累积能力的植物(Ma et al.,2001),其对砷具有高耐受性、超强吸收能力和转运能力等特点(叶文玲等,2014),因此被认为是一种砷污染土壤修复理想的植物(Cantamessa et al.,2020)。
蜈蚣草对土壤中砷的超累积作用主要是通过其根部对砷酸盐的吸收和转化作用,使砷酸盐还原成亚砷酸盐,而亚砷酸盐通过木质部导管介导的长距离运输到达地上部分,最后通过液泡区隔化作用在羽叶液泡中聚集而富集(Han et al.,2016)。目前,关于蜈蚣草富集砷的研究主要针对植物砷还原酶和砷转运机制,而对微生物促进砷在土壤-蜈蚣草系统中的转运作用机制研究较少。据报道,接种微生物不仅可增强蜈蚣草对砷的富集能力,还能提高其生物量(赵根成等,2010)。Han et al.(2017a)在无菌条件下,向培养蜈蚣草的含砷培养基中接种砷还原菌,结果发现蜈蚣草对砷的吸收增加了47%,且生物量提高了20%—74%。Yang et al.(2020)对接种微生物的蜈蚣草进行为期3年的田间试验,发现接种微生物后提高了蜈蚣草的生物量和砷积累量。有研究表明,微生物对砷的解毒机制是通过砷的还原、氧化以及甲基化等转化过程实现(陈焱山等,2018),但目前对土壤-蜈蚣草系统内微生物群落对砷污染的响应机制研究还鲜有报道。因此,本研究以蜈蚣草作为供试植物,通过不同砷添加量梯度胁迫进行盆栽试验,结合理化分析、高通量测序和生物信息学等手段,对蜈蚣草根际土、根和茎叶中砷含量及微生物群落结构进行表征和分析,以揭示砷污染对蜈蚣草根际及内生微生物群落结构的影响,探讨土壤-蜈蚣草系统中微生物对砷污染的响应机制,旨在为蜈蚣草相关微生物群落潜在功能研究提供一些新的见解,有助于提高对植物-功能微生物联合修复砷污染土壤的实践指导。
1 材料与方法
1.1 土壤采集及老化
实验所用土壤采自广东省生态环境与土壤研究所(23°18′68.19″N,113°36′23.73″E)内无污染土壤,为了防止表面植物对土壤中微生物群落的影响,在采集土壤时去除了表层5 cm的土壤。土壤采集完后,经自然晒干、磨碎、过0.147 mm筛,放置备用。称取备用土壤2 kg于PV花盆中,并向其中加入不同添加量砷酸钠(Na3AsO4)溶液,使土壤最终砷质量分数分别为0、250、500 mg·kg-1,最后将处理后的花盆置于黑暗处进行一个月的老化。
1.2 盆栽试验
供试蜈蚣草采自广东省韶关市新丘屋的砷污染场地(24°31′10.92″N,113°43′14.45″E),为了避免蜈蚣草成熟茎叶的影响,在移植前去掉成熟的茎叶,仅保留刚发芽的嫩芽,并在移至盆栽前用去离子水冲洗掉附着在根表面的土,以防对盆栽土壤中砷含量的干扰。
盆栽试验中,不同砷添加量处理各设置3个平行,共9盆。该试验于广东省科学院生态环境与土壤研究所人工大棚中进行,自然采光,蜈蚣草种植期间通过质量法补给水分,控制盆栽土壤含水量为最大持水量的80%。
1.3 根际土及植物样品采集
待蜈蚣草成熟后,分别采集蜈蚣草根际土、根和茎叶。在采集蜈蚣草时,用手轻轻抖动蜈蚣草根部,将蜈蚣草根部的土抖落后收集其根部附着土至自封袋内,即为根际土样品。采集完根际土后,用剪刀将蜈蚣草根和茎叶分开,分别收集至自封袋中。
采集完的根际土分为两份,一部分样品置于60 ℃烘箱进行48 h烘干,随后经研磨和过0.147 mm筛后用于理化参数测定,另一份放入-20 ℃冰箱保存,用于微生物DNA的提取与鉴定。将收集的蜈蚣草根和茎叶样品均分别分为两份,一份经去离子水清洗后置于60 ℃烘箱进行48 h烘干,随后经研磨、过0.147 mm筛以待理化测定。为了防止植物样品表面的细菌影响后续DNA提取,另一份需要进行灭菌处理,灭菌方法参考(Sun et al.,2021),后将灭菌后的植物样品保存至-20 ℃,以待DNA提取。
1.4 总砷测定
土壤样品总砷测定:称取 0.1 g研磨过筛后的根际土样品于石墨炉消解管中,并向消解管中加入3 mL HCl、3 mL HF和9 mL HNO3,随后使用DS-360石墨消解炉(广州格丹纳仪器有限公司)消解8 h,消解后所有消解液使用超纯水定容至10 mL,并用0.22 μm滤膜过滤定容后的消解液。消解液的总砷添加量采用AFS-9710原子荧光光度计(北京海光仪器有限公司)测定。植物样品总砷测定:称取0.1 g研磨过筛后的植物样品于石墨炉消解管中,并向消解管中加入3 mL HCl和9 mL HNO3,随后使用 DS-360石墨消解炉(广州格丹纳仪器有限公司)消解5 h,消解后所有消解液使用超纯水定容至10 mL,并用0.22 μm滤膜过滤。消解液总砷质量分数采用AFS-9710原子荧光光度计(北京海光仪器有限公司)测定。
1.5 DNA提取和测序
将灭菌后的植物样品用液氮速冻后研磨,并采用 DNeasy PowerSoil试剂盒(德国德累斯顿的Qiagen)对研磨后的植物样品以及准备好的土壤样品进行 DNA提取。DNA浓度采用 Qubit® 3.0 Fluorometer(美国invitrogen公司)进行测定。
本研究采用Illumina高通量测序技术研究蜈蚣草根际土、根及茎叶中微生物群落结构多样性,并以16S rRNA基因V4高变区的515 F/806 R引物锚定总微生物群落(Caporaso et al.,2010),后将基因的扩增子进一步于Illumina MiSeq系统(上海派森诺生物技术公司)进行编码、汇集及测序,并将测序结果原始序列提交到NCBI数据库。
1.6 富集系数及转运系数
富集系数(BCF)是指植物不同组织中砷含量与土壤中砷含量之比,转运系数(TF)是指植物上部某元素的质量分数与植物下部某元素的质量分数之比。BCF和 TF的计算公式如下(Takarina et al.,2017):

式(1)中:
XBCF——富集系数(BCF);
ws,r——茎叶(S)或根(R)中砷的平均质量分数(mg·kg-1);
wso——土壤中砷的平均质量分数(mg·kg-1);
式(2)中:
XTF——转运系数(TF);
Cs——茎叶中砷的平均质量分数(mg·kg-1);
Cr——根中砷的平均质量分数(mg·kg-1)。
1.7 数据处理
本研究使用QIIME2中的DADA2方法对原始双端 Illumina reads进行分析(Bolyen et al.,2019)。使用R语言中“Vegan”软件包进行多变量分析。采用Observed指数、Chao1指数、Shannon指数和Simpson指数计算蜈蚣草根际及内生微生物群落的α多样性指数。基于Bray-curtis距离分别计算3种根际及内生微生物群落结构的β多样性(Schroeder et al.,2018)。并用“MicrobiomeSeq”软件包计算出的蜈蚣草根际及内生微生物群落的核心微生物,砷添加量与微生物群落之间的相关性和可视化是在“Corrplot”软件包中进行的(Jia et al.,2021)。
2 结果
2.1 蜈蚣草根际土、根及茎叶砷富集情况
蜈蚣草根际土、根及茎叶均有富集砷的作用,在0、250、500 mg·kg-1砷污染下,蜈蚣草根际土、根和茎叶内砷含量具有显著差异(图1)。蜈蚣草根际土、根和茎叶的砷含量表现为:茎叶>根际土>根。随着砷污染水平递增,蜈蚣草各个部位的砷积累量均明显提高。其中,在土壤中砷污染水平为 250 mg·kg-1时,蜈蚣草茎叶砷质量分数为 22816.04 mg·kg-1,远高于根和根际土的砷质量分数,其分别为 220.37 mg·kg-1和 228.18 mg·kg-1;与之类似,当砷污染水平500 mg·kg-1时,蜈蚣草茎叶、根及根际土砷质量分数分别为 31334.64、333.40、468.84 mg·kg-1。同时,基于BCF和TF计算,发现当土壤砷污染水平为 250 mg·kg-1和 500 mg·kg-1时,蜈蚣草茎叶中砷的富集系数分别为99.99和66.83,转运系数分别为103.53和93.98。这表明蜈蚣草具有很强的土壤砷修复潜力。

图1 不同As污染下蜈蚣草根际土、根及茎叶As吸收差异Figure 1 As concentration in rhizosphere, roots and stems of Pteris vittata L.contaminated with different concentration of As
2.2 微生物群落分析
2.2.1 α多样性和β多样性指数
蜈蚣草根际及内生微生物群落α多样性具有显著差异。如图2所示,Observed指数和Chao1指数在蜈蚣草根际土样品中最高,其次是根,最后是茎叶,这表明蜈蚣草根际土中微生物群落最丰富,茎叶中微生物群落丰富度最低。同样,蜈蚣草根际土Shannon指数和Simpson指数也最高,其次是根,最后是茎叶,说明蜈蚣草根际土中微生物群落均匀度也最高,最低是茎叶。蜈蚣草根际、根和茎叶微生物群落β多样性分析表明(图3),蜈蚣草根际及内生微生物群落结构间差异很大,而相比蜈蚣草根内及茎叶内微生物群落结构,蜈蚣草根际微生物群落结构随砷添加量提高而差异增大,说明砷添加量变化对蜈蚣草根际微生物群落的影响大于其对蜈蚣草根和茎叶内微生物群落的影响。
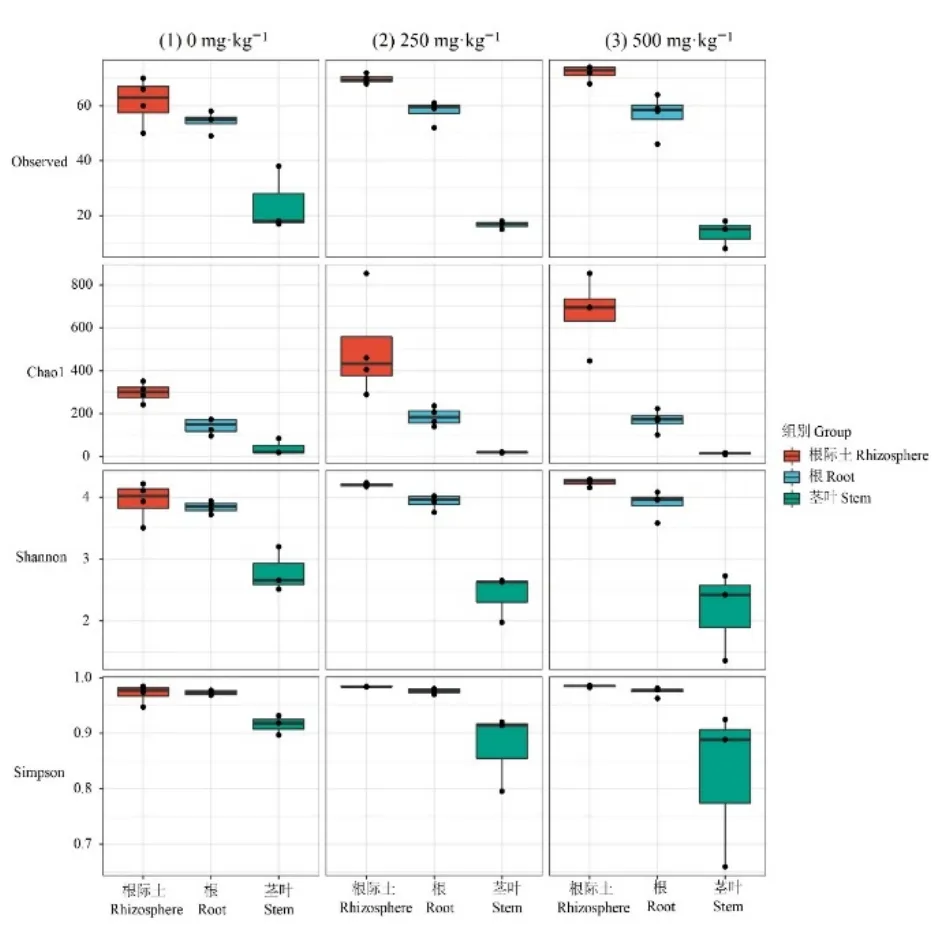
图2 蜈蚣草根际土、根及茎叶的α多样性指数Figure 2 α diversity metrics in rhizosphere, roots and stems of Pteris vittata L.

图3 蜈蚣草根际土、根和茎叶的微生物群落β多样性分析Figure 3 β diversity analysis of microbial community in rhizosphere, roots and stems of Pteris vittata L.
2.2.2 微生物群落相对丰度
基于 Illumina Miseq测序和数据分析得到了13742个可操作分类单元(OTU)。蜈蚣草根际土、根及茎叶样品中 OTU数量具有显著差异,表现为蜈蚣草根际土(11790个)高于根(3077个)和茎叶(258个)。尽管砷添加量处理不同中,但变形菌门(Proteobacteria)(4007个)在3个不同部位中均占主导地位(图 4),其在根际土样品中占47.61%—63.4%,在根样品中占30.5%—67.6%,在茎叶样品中占 12.4%—93.3%。其次是放线菌门(Actinobacteriota)(2342个)。此外,基于在属水平上不同砷添加量处理的不同部位样品中微生物种群相对丰度统计结果(图 5)发现,在根际土中相对丰度前 5的菌属分别是鞘氨醇单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)、Pseudolabrys、KD4_96、德沃斯氏菌属(Devosia);在根部位中,细菌相对丰度前 5的是链霉菌属(Streptomyces)、根瘤杆菌属(Rhizobacter)、Niastella、根瘤菌属(Rhizobium)、嗜酸铁还原杆菌属(Acidibacter);在蜈蚣草茎叶中相对丰度前5的菌属为Xylariaceae、寡营养单胞菌(Stenotrophomonas)、假单胞菌属(Pseudomonas)、短杆菌属(Brevibacterium)、Brechybacterium。
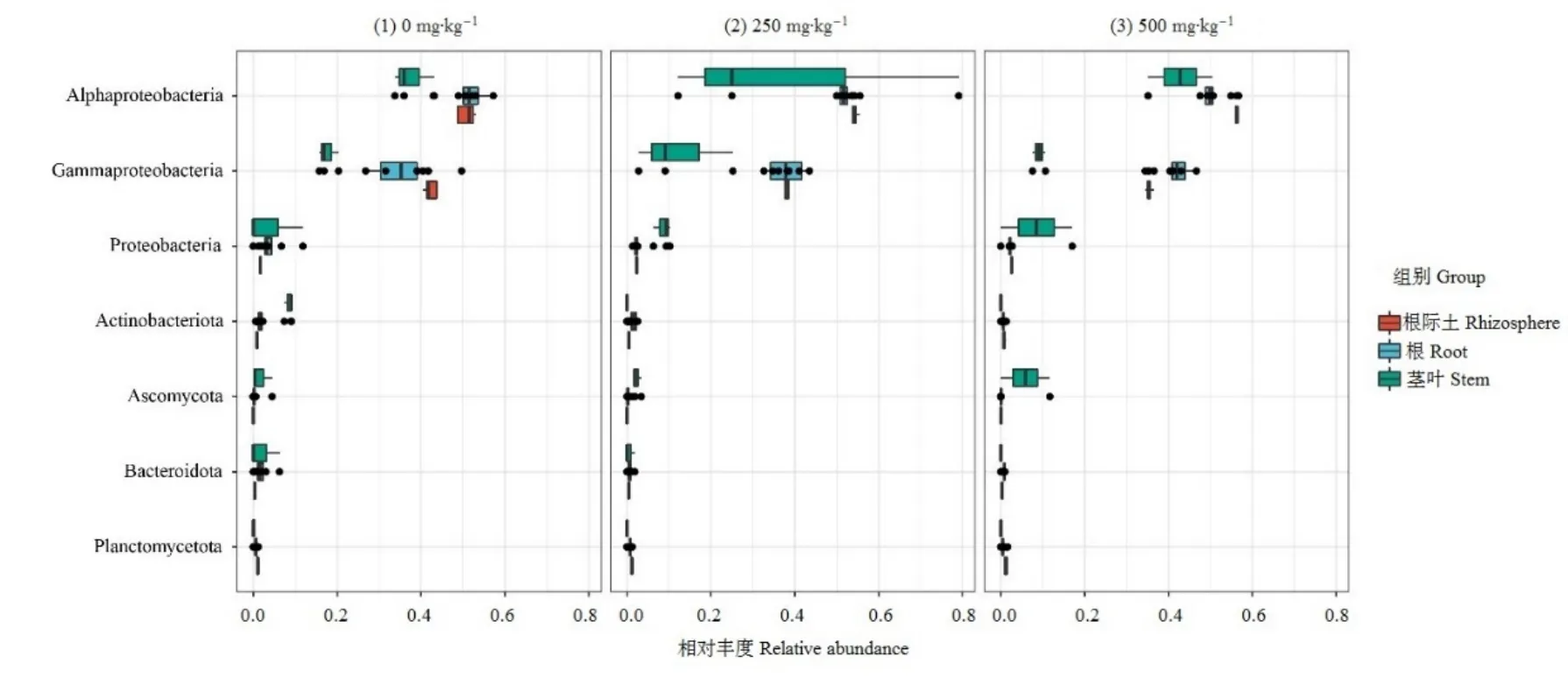
图4 门水平上蜈蚣草所有样品中微生物群落相对丰度位列前7的细菌Figure 4 Relative abundances of the top 7 most-abundant phylum within the microbial communities in all samples of Pteris vittata L.

图5 属水平上蜈蚣草根际土、根及茎叶中微生物群落相对丰度各位列前5的细菌Figure 5 Relative abundances of the top 5 most-abundant genera within the microbial communities in rhizosphere,roots and stems of Pteris vittata L.respectively
2.3 核心微生物
为了进一步探讨蜈蚣草根际、根内和茎叶中对砷响应最重要的微生物,本研究进行了核心微生物分析(图6)。结果表明,蜈蚣草根际土中核心微生物主要包括黄色杆菌科未确定菌属(Xanthobacteraceaeuncultured)(图6a),在蜈蚣草根际土所有样品中占 2%,以及 KD4-96和(Vicinamibacteralesuncultured),在蜈蚣草90%的样品中占到2%,其中黄色杆菌科(Xanthobacteraceae)属于根瘤菌目。此外,根瘤菌目的根瘤菌属(Rhizobium)和德沃斯氏菌属(Devosia)以及属于噬纤维菌目(Cytophagales)的Ohtaekwangia均在蜈蚣草根所有样品中占到接近约 2%,可被视为蜈蚣草根的核心微生物(图 6b)。寡营养单胞细菌属(Stenotrophomonas)在蜈蚣草80%的茎叶样品中占10%,是蜈蚣草茎叶核心微生物(图6c)。

图6 蜈蚣草根际土、根和茎叶中核心微生物群落(属水平)Figure 6 The core microbial community in the rhizosphere, roots and stems of Pteris vittata L.
2.4 微生物与砷添加量相关性分析
蜈蚣草根际及内生微生物群落受砷添加量的影响。本研究采用Pearson方法计算出蜈蚣草根际土、根及茎叶中在属水平上相对丰度位列前9的菌属与砷添加量的相关性(图7)。蜈蚣草根际土相对丰度位列前 9的细菌中,67_14、德沃斯氏菌属(Devosia)、MND1、SC_I_84、鞘氨醇单胞菌属(Sphingomonas)受砷添加量提高影响较大(P>0.6),其中德沃斯氏菌属(Devosia)和 MND1与砷添加量大小呈正相关,其他则为负相关。蜈蚣草根际中微生物相对丰度位列前9的菌属中受砷添加量影响较大的菌属主要是嗜酸铁还原杆菌属(Acidibacter)、Niastella和根瘤杆菌属(Rhizobacter),且均呈正相关关系。在蜈蚣草茎叶中,Actinospica、分支杆菌属(Mycobacterium)、Myroides、Stenotrophomonas这 4种菌受砷添加量提高的影响较大(P>0.6),但与砷添加量大小呈正相关的细菌只有寡营养单胞细菌属,表明砷添加量升高会促进对砷抗性微生物的特定选择。

图7 属水平上蜈蚣草根际土、根和茎叶样品中相对丰度位列前9的微生物与砷之间的相关性Figure 7 The correlation between microorganisms of the top 9 most-abundant genera and arsenic in the rhizosphere,roots, and stems of Pteris vittata L.
3 讨论
3.1 砷在蜈蚣草根际土、根及茎叶中的富集情况
蜈蚣草内生微生物对砷在蜈蚣草体内的累积起了关键作用。大量研究表明,在非超累积植物中,根对砷的吸收远远超过茎叶(张田等,2020)。在本研究中,蜈蚣草地上部分总砷含量显著高于蜈蚣草地下部分(根和根际土),这与韩永和等(2017)的研究结果一致。土壤中砷主要以无机态形式被植物吸收,而无机态的两种存在形式As(Ⅴ)和As(Ⅲ) 进入植物的通道不尽相同,它们分别通过磷酸转运蛋白和水通道蛋白进入植物根内(陈焱山等,2018)。植物根内As(Ⅴ) 通过微生物迅速被还原为As(Ⅲ),As(III) 可通过木质部导管介导的长距离运输到达地上部分(汪京超等,2015),这说明在蜈蚣草的根部可能富集了大量砷还原及砷抗性微生物群落。Gao et al.(2021)研究发现,与致病菌相比,患病植物根和茎会富集更多潜在有益细菌。由此可见,蜈蚣草内生微生物对砷在蜈蚣草的累积发挥关键作用。
3.2 微生物群落多样性
蜈蚣草根际、根内和茎叶内微生物群落多样性受砷污染情况影响。研究发现,随砷添加量升高,相较于蜈蚣草的根和茎叶,其根际土微生物群落Observed指数和Chao1指数增大,这可能是由于土壤中砷胁迫作用增强促使蜈蚣草根部分泌根际分泌物,如碳水化合物、氨基酸类和胺类碳源等,从而使根际抗性微生物得到富集(韩永和等,2017)。Nihorimbere et al.(2011)发现根系分泌物的组成和模式影响微生物活性和种群数量,植物种类、植物发育阶段和土壤类型被认为是决定根际微生物的主要因素(Broeckling et al.,2008)。此外,茎叶内微生物群落α多样性指数随着土壤砷添加量的升高而降低,这可能是因为蜈蚣草茎叶内超累积土壤中的砷所造成的,高添加量砷特异性选择了茎叶中具有砷抗性的微生物种群(Xiong et al.,2010),而β多样性表明砷添加量变化对蜈蚣草根际微生物群落的影响大于其对蜈蚣草根和茎叶内微生物群落的影响,这可能是由于土壤砷含量升高,砷胁迫作用增大,直接导致土壤中对砷敏感的微生物死亡或减缓生长,而具有砷抗性能力或砷代谢能力的微生物富集(Turpeinen et al.,1999)。
3.3 微生物群落对蜈蚣草抗砷的潜在贡献
蜈蚣草根际、根内和茎叶内微生物为蜈蚣草的定殖和砷富集起到重要作用。蜈蚣草对砷的累积主要涉及砷的吸收、砷的还原、砷的区隔化以及砷的运输4个机制作用,蜈蚣草内生微生物对砷的代谢过程也具有不可忽视的贡献(Han et al.,2017b)。本研究发现,Alphaproteobacteria菌门微生物在不同砷含量处理中均占主导地位,可能对砷在蜈蚣草内累积起到关键作用。Han et al.(2016)在高砷污染场地分离出多种砷还原菌,其均属于变形菌门,包括假单胞菌和不动杆菌(Acinetobacter)等,且均具有砷还原能力,表明蜈蚣草可选择性地富集砷还原菌(如 Alphaproteobacteria菌门微生物),实现将As(Ⅴ) 还原成As(Ⅲ),将蜈蚣草根内的砷大量转运至茎叶,并保存到液泡中,达到砷超累积效能。此外,蜈蚣草根际土核心微生物种群包括Xanthobacteraceae未确定菌属属于根瘤菌目,其在调节根-根内微生物群落-生物之间的相互作用过程中可能发挥重要作用。Ahmad et al.(2020)报道发现在Xanthobacteraceae的一些家族菌群携带编码As(Ⅲ) 氧化酶的aioA基因,具有将As(Ⅲ) 氧化为毒性更低的 As(Ⅴ) 的能力,具有降低砷对蜈蚣草毒害效应的潜能,使得蜈蚣草能够更好地定植于高砷污染环境中。
Devosia、Rhizobium和Ohtaekwangia是蜈蚣草根内核心微生物。其中,Rhizobium与植物之间的共生固氮作用,除对寄生植物具有固氮作用和提供植物必要的营养元素外,还可通过植物修复受重金属污染的土壤(Mahieu et al.,2011)。Ghnaya et al.(2015)研究发现,接种根瘤菌的苜蓿植物(MedicagosativaL.)可促进根部对重金属镉的吸收,并加强镉向地上部分转运的能力,从而达到修复场地镉污染。同样,Deepika et al.(2016)研究指出根瘤菌对砷具有很强的抗性,在土壤砷的生物地球化学过程中发挥重要作用。由此可见,根瘤菌对蜈蚣草超富集砷及其内生微生物对砷产生高抗性起着至关重要的作用。此外,Chhetri et al.(2022)研究报道Devosia在L-色氨酸存在下可产生铁载体和吲哚乙酸(IAA),促进植物生长。Ohtaekwangia是蜈蚣草根内微生物群落另一种核心微生物种群,虽然目前对Ohtaekwangia功能的报道知之甚少,但据报道Ohtaekwangia显著富集于淹水处理和交替淹水处理的水稻根际土中,且在淹水处理和交替淹水处理的水稻根际土中总砷含量减少(Das et al.,2016)。As(Ⅲ) 的迁移流动性相较于 As(Ⅴ) 更强(Dixit et al.,2003),说明Ohtaekwangia可能具有砷还原能力,导致根际土中的 As(Ⅴ)被还原成As(Ⅲ),进而被水稻吸收,降低根际土中的砷含量。Stenotrophomonas是蜈蚣草茎叶微生物群落中的核心微生物,Drewniak et al.(2015)在富含砷的岩石生物膜中分离出Stenotrophomonas,表明其对砷酸盐具有高度耐受性。同样,在Naidu et al.(2012)的研究中,第一次证明Stenotrophomonas是一株很强的亚砷酸盐氧化细菌,可在 12 h完全氧化 500 μmol·L-1亚砷酸盐生成砷酸盐。同时,基于相关性分析发现,Stenotrophomonas与砷含量呈现正相关关系,表明Stenotrophomonas可能在蜈蚣茎叶内调控着由根部转运上来的 As(Ⅲ) 转化为低毒性的As(Ⅴ),使其能在高砷环境中生存繁殖,同时也降低As对蜈蚣草植株的毒害,促进植物生长。
4 结论
(1)在 250 mg·kg-1和 500 mg·kg-1土壤 As污染下,蜈蚣草茎叶As的富集量远高于根的As富集量,且蜈蚣草的茎叶As富集系数分别为99.99和66.83。
(2)蜈蚣草根际土、根和茎叶之间的微生物群落多样性具有显著差异。
(3)在蜈蚣草根际土、根和茎叶内,均有砷抗性微生物大量富集。并且,与砷添加量呈正相关的优势菌群均可被富集在在蜈蚣草根际土、根和茎叶内,如在根际土中有德沃斯氏菌属(Devosia)和MND1;在根内有嗜酸铁还原杆菌属(Acidibacter)、Niastella和根瘤杆菌属(Rhizobacter);寡营养单胞细菌属(Stenotrophomonas)在茎叶中富集。
