CDCA8通过调控增殖促进前列腺癌发生的作用机制研究
2022-08-10任智星杨光华
任智星,杨光华
前列腺癌(PCa)是男性泌尿生殖系统中常见的恶性肿瘤。在世界范围内,PCa 发病率居男性所有恶性肿瘤的第2 位,仅次于肺癌[1]。在美国,PCa 的发病率居男性恶性肿瘤首位,病死率居第2位[2]。我国是前列腺癌发病率和病死率相对较低的国家之一,但近年来随着人均寿命的延长和疾病筛查手段的进步,PCa发病率呈持续快速增长趋势[3]。传统治疗手段如手术、雄激素剥夺疗法、放疗和化疗仅对早期PCa 有效,对进展期PCa 治疗效果较差。为改善进展期PCa 治疗效果,需不断探索新的治疗靶点。目前,采用免疫和靶向疗法治疗进展期肿瘤前景广阔。细胞分裂周期相关蛋白8(CDCA8)在人体组织中广泛表达,参与细胞分裂,为真核细胞内纺锤体和微管稳定所必需[4]。研究显示,CDCA8 过度表达于乳腺癌、肺癌和肝癌等恶性肿瘤中,且与肿瘤的生长及预后密切相关[5-7]。然而,分析CDCA8在PCa中作用的相关研究较少。本研究对PCa 中CDCA8 的表达和作用机制进行初步探讨,旨在为PCa 的治疗提供新靶标。
1 材料与方法
1.1 材料 选取2018年1月—2020年12月因PCa在山西白求恩医院行根治性前列腺切除术的56 例患者的术后标本。纳入标准:术前评估原发肿瘤临床分期为T1~T3a,排除伴有骨转移或其他脏器转移。患者年龄55~76 岁,平均(66.66±2.38)岁。前列腺术后标本的使用均取得患者或直系亲属知情同意,获得本院伦理委员会的批准。人PCa细胞株(PC3和DU145)购自美国ATCC 细胞库。胎牛血清及RPMI 1640 培养基购自美国Gibco公司,兔抗CDCA8抗体、Ki67抗体、增殖细胞核抗原(PCNA)抗体、蛋白激酶B(AKT)抗体、磷酸化蛋白激酶B(p-AKT)抗体、磷脂酰肌醇-3-激酶(PI3K)抗体、磷酸化磷脂酰肌醇-3-激酶(p-PI3K)抗体及鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自英国Abcam 公司,山羊抗兔或山羊抗鼠二抗购自武汉Proteintech 公司,lipofectamine 2000和TRIzol 试剂购自美国Invitrogen 公司,FastStart SYBR®Green Master 购自德国罗氏公司,非蛋白变性细胞裂解液购自中国索莱宝公司,实时荧光定量聚合酶链反应(qPCR)引物和小干扰RNA(siRNA)序列购自苏州吉玛公司。细胞培养箱购自美国THERMO公司,qPCR仪和Western blot设备购自美国Bio-Rad公司。
1.2 生物信息学数据挖掘 采用GEPIA 网站数据分析工具(http://gepia.cancer-pku.cn/detail.php?gene=CDCA8)比较癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中PCa组织和GTEx(Genotype-Tissue Expression)数据库中正常前列腺组织中CDCA8 mRNA水平差异。将TCGA数据库中PCa组织的CDCA8 mRNA 表达测序数据由小到大排列,前50%患者定义为CDCA8 mRNA低表达组(n=248),后50%患者定义为CDCA8 mRNA 高表达组(n=248),随访期间出现PCa 复发定义为事件发生,比较2组患者的无病生存期(DFS)。
1.3 免疫组化检测CDCA8蛋白表达 将前列腺术后石蜡块标本以4 μm厚度切片,经苏木精-伊红(HE)染色后由2名经验丰富的病理科医师再次予以明确PCa 组织和癌旁组织的病理学诊断。切片经抗原修复后,用2%的BSA封闭30 min,随后用兔抗CDCA8抗体(1∶400)孵育切片4 ℃过夜。室温下羊抗兔二抗(1∶500)孵育2 h,最后在显微镜观察下进行显色反应并适时终止,由2 名研究人员各自随机读取5 个高倍镜视野进行观察评分。细胞染色评分:0 分,<5%细胞染色;1分,5%~24%细胞染色;2分,25%~49%细胞染色;3分,≥50%细胞染色。染色强度评分:0分(无或轻度染色)、1分(中度染色)和2 分(重度染色)。CDCA8 的表达水平用染色指数表示。染色指数=染色细胞评分×染色强度评分。根据每例患者PCa组织和癌旁组织的CDCA8染色指数分析CDCA8蛋白的表达差异。PCa组织染色指数为0~2的患者定义为CDCA8蛋白低表达组(25 例),PCa 组织染色指数为3、4 和6 的患者定义为CDCA8 蛋白高表达组(31 例),分析PCa 患者CDCA8表达水平与临床特征的关系。
1.4 临床资料收集 收集患者总前列腺特异性抗原(tPSA)、Gleason 评分、T 分期、术后组织切缘情况。根据前列腺癌预后风险标准[8],将tPSA 以10 μg/L 分界,<10 μg/L 为低危,≥10 μg/L为中高危;Gleason评分以7分界,<7分为低危,≥7分为中高危。
1.5 PCa 细胞培养和转染 将PC3 和DU145 细胞于含10%胎牛血清的RPMI 1640培养基在5%CO2、37 ℃恒温培养箱中培养。通过Lipofectamine 2000将siRNA转染到PC3和DU145细胞中用于沉默CDCA8基因,将细胞分为沉默组(Si-CDCA8组)和对照组(Si-NC 组)。siRNA 目标序列:5′-GGUUUGACUCAAGGGUCUUTTAAGACCCUUGAGUCAAACCTT-3′。
1.6 qPCR检测CDCA8 mRNA表达水平 使用TRIzol试剂提取Si-CDCA8组及Si-NC组PCa细胞中总mRNA。通过UEIrisⅡRT-PCR系统将mRNA逆转录生成cDNA,然后进行qPCR反应,GAPDH 为内参。CDCA8 引物:上游5′-GAAGGGCAGTAGTCGGGTG-3′;下游5′-TCACGGTCGAAGTCTTTCAGA-3′。GAPDH引物:上游5′-CATCTCTGCCCCCTCTGCTGA-3′;下游5′-GGATGACCTTGCCCACAGCCT-3′。反应体系10 μL:cDNA 2 μL,上下游引物各0.5 μL,ddH2O 2 μL,FastStart SYBR®Green Master 5 μL。反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸15 s,45 个循环。实验重复3次。mRNA数据通过2-ΔΔCt法进行相对定量分析。
1.7 细胞克隆形成实验检测PCa细胞增殖能力 6孔板中每孔大约接种1 000个PCa细胞,置于37 ℃5%CO2恒温箱中孵育。其中3孔接种Si-CDCA8组细胞,另3孔接种Si-NC组细胞。培养2周后,4%多聚甲醛固定细胞,0.2%的结晶紫溶液染色2 min。去离子水多次洗涤后晾干,使用Image J 软件计算2组细胞集落数,实验重复3次。
1.8 Western blot 检测PCa 细胞中CDCA8、PCNA、Ki67、p-PI3K、PI3K、AKT、p-AKT蛋白表达水平 使用非蛋白变性细胞裂解液裂解PCa细胞,提取并测定总蛋白浓度。每泳道加入40 μg蛋白样品行SDS-PAGE电泳。电泳完毕后将已分离的蛋白质转移到聚乙烯氟化物(PVDF)膜上。用脱脂牛奶封闭PVDF 膜2 h,目标蛋白CDCA8(1∶800)、PCNA(1∶1 000)、Ki67(1∶1 000)、p-PI3K(1∶3 000)、PI3K(1∶1 000)、AKT(1∶2 000)、p-AKT(1∶5 000)一抗孵育PVDF 膜并在4 ℃冰箱中过夜,GAPDH(1∶5 000)作为内参。室温下用山羊抗兔或山羊抗鼠二抗(1∶3 000)孵育PVDF膜1 h。随后用ECL显影试剂曝光蛋白条带。Image J 软件用于定量分析蛋白相对表达量。蛋白相对表达量=目标蛋白条带灰度值/内参蛋白条带灰度值。
1.9 统计学方法 采用SPSS 18.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,2 组间比较采用独立样本t检验,癌旁组织和癌组织组间比较采用配对样本t检验,相关性分析采用Pearson法。非正态分布的计量资料以M(P25,P75)表示,组间比较使用Wilcoxon 秩和检验。计数资料以例(%)表示,组间比较采用Pearsonχ2检验或连续校正χ2检验,相关性分析采用Spearman法。生存期比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 PCa 组织和正常前列腺组织中CDCA8 mRNA水平比较 TCGA数据库中PCa组织(n=496)CDCA8 mRNA 水平较GTEx 数据库中正常前列腺组织(n=152)升高[1.446(1.124,1.841)vs.0.791(0.621,1.030),Z=13.330,P<0.01]。
2.2 PCa 患者CDCA8 mRNA 低表达组与高表达组DFS 比较 CDCA8 mRNA 高表达组患者预后更差,中位DFS为82.4个月,2组患者DFS差异有统计学意义(Log-rankχ2=16.830,P<0.01),见图1。
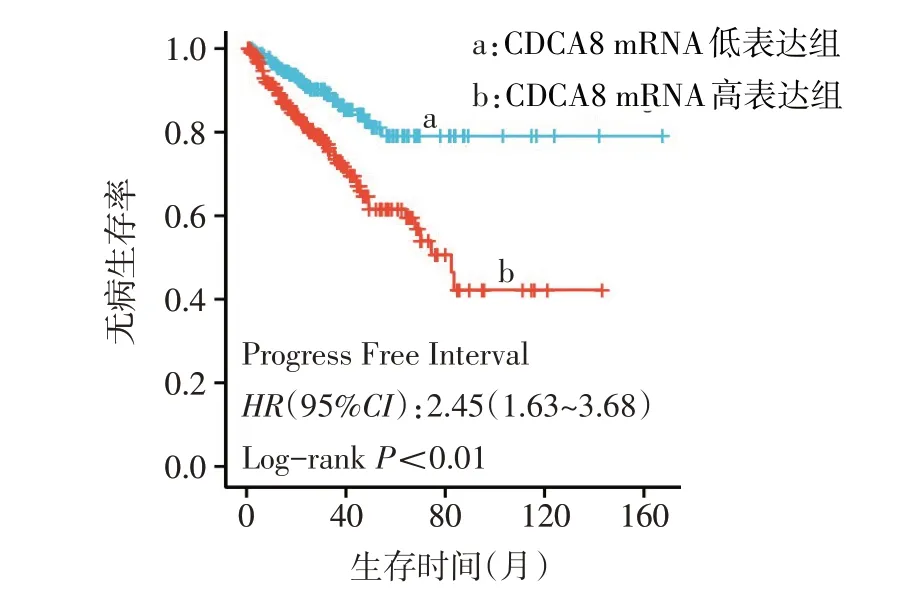
Fig.1 Comparison of DFS between the CDCA8 mRNA high expression group and the CDCA8 mRNA low expression group图1 CDCA8 mRNA高表达组和低表达组DFS比较
2.3 PCa组织和癌旁组织CDCA8表达水平比较 前列腺组织切片中,PCa 组织CDCA8 的蛋白表达水平明显高于癌旁组织[2.79±0.89vs.1.68±0.83,t=13.296,P<0.01],见图2、3。

Fig.2 The expression of CDCA8 in PCa tissues(immunohistochemical staining,left×100,right×200)图2 PCa组织中CDCA8的表达(免疫组化,左×100,右×200)
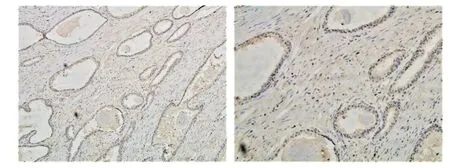
Fig.3 The expression of CDCA8 in paracancerous tissues(immunohistochemical staining,left×100,right×200)图3 前列腺癌旁组织中CDCA8的表达(免疫组化,左×100,右×200)
2.4 PCa 患者临床特征与CDCA8 蛋白表达相关性分析 患者tPSA、Gleason 评分、T 分期和术后切缘情况与CDCA8 蛋白表达呈正相关(r分别为0.481、0.627、0.281和0.467,P<0.01)。CDCA8蛋白高表达组tPSA≥10 μg/L、T3期、术后切缘阳性患者比例高于CDCA8蛋白低表达组(P<0.05)。见表1。
2.5 Si-CDCA8组和Si-NC组CDCA8 mRNA及蛋白比 较 qPCR 和Western blot 显 示Si-CDCA8 组CDCA8 mRNA 和蛋白水平均明显低于Si-NC 组(P<0.01),见表2,图4。
2.6 Si-CDCA8 组和Si-NC 组细胞增殖能力比较 Si-CDCA8 组细胞集落数减少,增殖能力减弱(P<0.01),见表3,图5。

Tab.1 Clinicopathological characteristics and CDCA8 expression of PCa patients between the two groups表1 2组前列腺癌患者的临床特征和CDCA8组织表达情况比较
Tab.2 Comparison of CDCA8 mRNA and protein expression between the Si-CDCA8 group and the Si-NC group表2 Si-CDCA8组和Si-NC组CDCA8 mRNA及蛋白表达水平比较 (n=3,±s)

Tab.2 Comparison of CDCA8 mRNA and protein expression between the Si-CDCA8 group and the Si-NC group表2 Si-CDCA8组和Si-NC组CDCA8 mRNA及蛋白表达水平比较 (n=3,±s)
**P<0.01。

Fig.4 Expression levels of CDCA8 proteins in the Si-CDCA8 group and the Si-NC group图4 Si-CDCA8组和Si-NC组CDCA8蛋白表达水平
Tab.3 Comparison of cell colony number between the Si-CDCA8 group and the Si-NC group表3 Si-CDCA8组和Si-NC组细胞集落数比较 (n=3,个/视野,±s)

Tab.3 Comparison of cell colony number between the Si-CDCA8 group and the Si-NC group表3 Si-CDCA8组和Si-NC组细胞集落数比较 (n=3,个/视野,±s)
**P<0.01。
2.7 Si-CDCA8 组和Si-NC 组Ki67 和PCNA 表达水平比较 Si-CDCA8 组Ki67 和PCNA 蛋白表达水平较Si-NC组明显降低(P<0.01),见表4,图6。
Tab.4 Comparison of Ki67 and PCNA expression levels between the Si-CDCA8 group and the Si-NC group表4 Si-CDCA8组和Si-NC组Ki67和PCNA表达水平比较 (n=3,±s)

Tab.4 Comparison of Ki67 and PCNA expression levels between the Si-CDCA8 group and the Si-NC group表4 Si-CDCA8组和Si-NC组Ki67和PCNA表达水平比较 (n=3,±s)
**P<0.01。

Fig.5 The number of cell colonies in the Si-CDCA8 group and the Si-NC group图5 Si-CDCA8组和Si-NC组细胞集落数

Fig.6 Expression levels of Ki67 and PCNA in the Si-CDCA8 group and the Si-NC group图6 Si-CDCA8组和Si-NC组Ki67和PCNA表达水平
2.8 Si-CDCA8组和Si-NC组PI3K/AKT通路蛋白表达水平比较 Si-CDCA8组PI3K、p-PI3K、p-AKT 表达水平较Si-NC组降低(P<0.01),见表5,图7。
3 讨论
CDCA8蛋白是染色体乘客复合物(CPC)成分之一,CPC 包含4 个成员:Aurora B、着丝粒中心蛋白、Survivin及CDCA8[9]。在胞质分裂过程中,CPC可以促进和调节中央纺锤体的形成,并决定细胞卵裂沟的位置[10],在肿瘤细胞过度增殖中起重要作用。而CPC 与核小体的结合主要涉及CDCA8 介导的复杂机制[11],因此CDCA8可能影响肿瘤发生。
Tab.5 Comparison of PI3K/Akt pathway protein expression between the Si-CDCA8 group and the Si-NC group表5 Si-CDCA8组和Si-NC组PI3K/AKT通路蛋白表达水平比较 (n=3,±s)

Tab.5 Comparison of PI3K/Akt pathway protein expression between the Si-CDCA8 group and the Si-NC group表5 Si-CDCA8组和Si-NC组PI3K/AKT通路蛋白表达水平比较 (n=3,±s)
*P<0.05,**P<0.01。

Fig.7 Expression levels of PI3K/AKT pathway protein in the Si-CDCA8 group and the Si-NC group图7 Si-CDCA8组和Si-NC组PI3K/AKT通路蛋白表达水平
本研究通过对56 例患者PCa 术后组织进行免疫组化分析发现,CDCA8 在PCa 组织中的表达水平较癌旁组织升高,且CDCA8 蛋白表达水平与tPSA、Gleason评分、T分期和术后切缘情况呈正相关,高表达CDCA8的PCa患者具有较高的tPSA、Gleason评分和临床分期,术后更有可能出现手术切缘阳性,预后较差。另外,TCGA 和GTEx 数据库中的测序数据也表明CDCA8 mRNA 水平在PCa 组织中较正常前列腺组织中更高,进一步证实CDCA8在PCa 发生及进展中的促癌作用。鉴于CDCA8 蛋白主要参与真核细胞有丝分裂,笔者推测CDCA8可能是PCa 发生的一个触发因素,并作为癌基因参与多种恶性肿瘤的进展。研究显示,CDCA8的过度表达与肝细胞癌患者的低生存率显著相关;在肝癌细胞中,沉默CDCA8 可抑制细胞周期蛋白B1 和磷酸化的细胞分裂周期蛋白2 的表达,并诱导G2/M 期细胞阻滞[5]。CDCA8是影响乳腺癌细胞增殖的关键因素[6]。另有研究表明,CDCA8的过度表达可促进黑色素瘤的进展,且与其不良预后相关[12]。与相对应的癌旁正常组织相比,CDCA8在肺癌组织中表达上调[7]。CDCA8显著促进骨肉瘤细胞的增殖[13],其在癌症组织中表达上调,而在正常组织中低表达[14-15]。因此,CDCA8基因在调节细胞生长、分化和凋亡等过程中起重要作用[9,16]。本研究结果显示CDCA8在前列腺癌细胞过度增殖中起促进作用,与上述各项研究基本一致。
PCNA蛋白主要定位于细胞核,在细胞周期S期大量表达,参与多种恶性肿瘤的发生和发展,其表达水平与细胞增殖水平一致,可用于评估细胞增殖和侵袭能力[17]。Ki67是一种细胞增殖核抗原,用来标记处于增殖周期中的细胞,常作为肿瘤细胞增殖活性的标记[18]。本研究中,沉默CDCA8 基因后,PCa细胞的增殖能力受到限制,且细胞内Ki67 和PCNA蛋白含量也随之下降,表明CDCA8 基因可以调控PCa 细胞增殖。周期蛋白依赖蛋白激酶抑制剂1(P21/CDKN1A)是细胞增殖的抑制因子,它可与PCNA 竞争结合抑制DNA 的合成,从而影响细胞增殖和分化;沉默CDCA8 后P21/CDKN1A 蛋白表达上调,PCNA 蛋白表达下调,细胞周期停滞于G2/M期[19]。P21主要受P53调控,参与DNA损伤修复、细胞增殖、凋亡和细胞周期等生物学过程,与PI3K/AKT 信号通路关系密切。PI3K/AKT 信号通路参与真核细胞多种生物学过程,如细胞增殖、分化、凋亡、周期、耐药等,是细胞内信号转导的一条重要通路[20]。本研究中,沉默CDCA8 基因后,PCa 细胞内p-PI3K、p-AKT 表达水平下调,表明CDCA8 基因可上调PI3K 和AKT 的磷酸化水平,激活PI3K/AKT 信号通路。E2F 转录因子1(E2F1)是细胞核内一类重要的转录因子,以细胞周期依赖的方式调节细胞增殖。Cui 等[21]研究发现沉默肝癌细胞CDCA8 基因后,PCNA 和E2F1 表达降低,肝癌细胞增殖力减弱。故推测CDCA8 可能通过调节细胞增殖而参与PCa的发生,但具体分子机制仍需进一步深入研究。
综上,本研究发现CDCA8 在人PCa 组织中表达上调,且CDCA8蛋白表达水平越高,PCa患者肿瘤分期越高,预后越差。此外,CDCA8 高表达能够促进PCa细胞增殖,CDCA8通过PI3K/AKT信号通路调控细胞增殖,参与前列腺肿瘤的发生,是PCa治疗的潜在靶基因。
