血清肿瘤特异性生长因子、巨噬细胞移动抑制因子水平对骨肉瘤患者免疫靶向治疗效果的预测价值
2022-08-10海啸王琦洪云飞
海啸,王琦,洪云飞
郑州市骨科医院创伤外科,郑州 450051
目前骨肉瘤(osteosarcoma,OS)的治疗主要以化疗、放疗、外科手术等综合治疗为主,有研究报道,治疗后OS患者的生存率可达50%~71%,但化疗药物相关不良反应会损伤正常组织,且患者可能出现化疗耐药,导致其临床疗效较难显著提高[1]。免疫治疗是通过刺激宿主的免疫反应,增加细胞杀伤毒性及机体的抗肿瘤免疫反应,从而促进肿瘤细胞凋亡,如干扰素、白细胞介素-2等可调节机体的免疫监视,放大特异性细胞的杀伤毒性。靶向治疗是在分子水平上通过抑制肿瘤生长所必需的重要通路,促进T细胞清除,加速细胞凋亡,如贝伐珠单抗可抑制肿瘤新生血管生成及细胞增殖,促进凋亡基因的表达。研究发现,在靶向治疗的基础上联合免疫抑制剂治疗OS患者,可激活宿主反应,增强免疫细胞对肿瘤细胞的杀伤效应,从而提高抗肿瘤免疫应答和患者的整体获益[2]。但免疫靶向治疗期间,仍有诸多因素可能会影响治疗效果,不利于OS患者预后[3]。现阶段临床评估恶性肿瘤疗效多依据病灶体积变化,此评估方法虽然可为后续调整治疗方案提供依据,但难以评估患者的治疗效果,其应用具有一定的局限性[4]。因此,寻找OS患者免疫靶向治疗效果的有效预测指标,对调整治疗方案、改善患者预后具有积极意义。肿瘤特异性生长因子(tumor specific growth factor,TSGF)是一种肿瘤细胞分泌的因子,具有促进肿瘤四周毛细血管增生、加速肿瘤细胞增殖的作用[5]。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)作为一种促炎因子,可参与免疫反应和炎症反应等多种病理过程,还可促进细胞增殖,且其在多种恶性肿瘤中表达[6]。结合TSGF、MIF的促肿瘤生长机制,猜测二者可能与OS患者的免疫靶向治疗效果有关,但目前相关研究较少。本研究通过检测OS患者的血清TSGF、MIF水平,分析其对OS患者免疫靶向治疗效果的预测价值,现报道如下。
1 对象与方法
1.1 研究对象
选取2018年3月至2020年3月于郑州市骨科医院接受免疫靶向治疗的72例OS患者。纳入标准:①符合《经典型骨肉瘤临床诊疗专家共识》[7]中OS的诊断标准,且经病理学检查确诊为OS;②预期生存期>3个月;③经规范性化疗后临床评估患者不再受益,首次接受免疫靶向治疗;④卡氏功能状态(Karnofsky performance status,KPS)评分[8]≥60分。排除标准:①合并肝癌、肺癌等其他恶性肿瘤;②合并心肌炎、肾衰竭等重要脏器疾病;③接受手术治疗,或既往有免疫靶向治疗史;④合并免疫系统疾病;⑤具有免疫治疗禁忌证;⑥合并认知功能障碍或精神障碍。72例患者中,男41例,女31例;年龄16~23岁,平均(19.42±1.12)岁;病程2~11个月,平均(6.35±1.07)个月;发病部位:胫骨17例,股骨26例,肱骨24例,其他5例;Enneking分期:ⅡA期29例,ⅡB期32例,Ⅲ期11例。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方法
所有患者均接受免疫靶向治疗,具体方法:皮下注射α-干扰素900 MIU,每3周1次;静脉滴注贝伐珠单抗10 mg/kg,每2周1次,共治疗12周。对于治疗期间因自然病程死亡提前或被迫中止治疗的患者,疗效评估、实验室指标检测等数据不纳入统计。
1.3 疗效评估
治疗结束后,采用修订的实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)[9]评估患者的疗效。完全缓解:全部病灶消失,各项肿瘤标志物水平恢复正常,至少维持4周;部分缓解:病灶最长径总和减少≥30%,至少维持4周;疾病稳定:病灶最长径总和减少<30%或增加<20%;疾病进展:病灶最长径总和增加≥20%,或出现新病灶。将完全缓解和部分缓解患者纳入有效组,疾病稳定和疾病进展患者纳入无效组。
1.4 血清TSGF、MIF检测
分别于治疗前、治疗12周结束时采集患者空腹肘静脉血5 ml,采用低速离心机3000 r/min离心10 min,离心半径为10 cm,取上层血清,采用免疫比浊法检测TSGF水平,采用酶联免疫吸附试验检测MIF水平。检测试剂盒均购自上海臻科生物科技有限公司,检验流程严格按照试剂盒说明书进行。
1.5 其他实验室指标检测
治疗前采集患者空腹肘静脉血5 ml,分别置于2支肝素抗凝管内,其中一支3000 r/min离心10 min,取上层血清,采用磷酸苯二钠比色法检测碱性磷酸酶(alkaline phosphatase,ALP)水平;另一支采用全自动细胞分析仪检测T淋巴细胞中CD3+、CD4+水平。
1.6 统计学方法
采用SPSS 23.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验;全部计量资料均经Shapiro-Wilk正态性检验,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验,偏态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,组间比较采用 Mann-WhitneyU检验,组内比较采用Wilcoxon符号秩检验;采用Logistic回归模型分析OS患者免疫靶向治疗效果的影响因素;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,并计算曲线下面积(area under the curve,AUC),分析血清TSGF、MIF对OS患者免疫靶向治疗效果的预测价值,AUC>0.90表示预测价值较高,0.71~0.90表示有一定的预测价值,0.50~0.70表示预测价值较低;以P<0.05为差异有统计学意义。
2 结果
2.1 血清TSGF、MIF水平的比较
治疗12周结束时,OS患者的血清TSGF、MIF水平均明显低于治疗前,差异均有统计学意义(P<0.01)。(表1)

表1 72例OS患者治疗前后血清TSGF、MIF水平的比较[M(P25,P75)]
2.2 治疗效果
治疗期间无死亡或终止治疗情况。72例患者中,治疗有效53例(73.61%),其中完全缓解17例(23.61%),部分缓解36例(50.00%);治疗无效19例(26.39%),其中疾病稳定16例(22.22%),疾病进展3例(4.17%)。
2.3 无效组和有效组OS患者基线特征的比较
无效组OS患者治疗前ALP、TSGF、MIF水平均明显高于有效组患者,差异均有统计学意义(P<0.01)。无效组和有效组OS患者的性别、年龄、病程、发病部位、Enneking分期及治疗前CD3+、CD4+水平比较,差异均无统计学意义(P>0.05)。(表2)
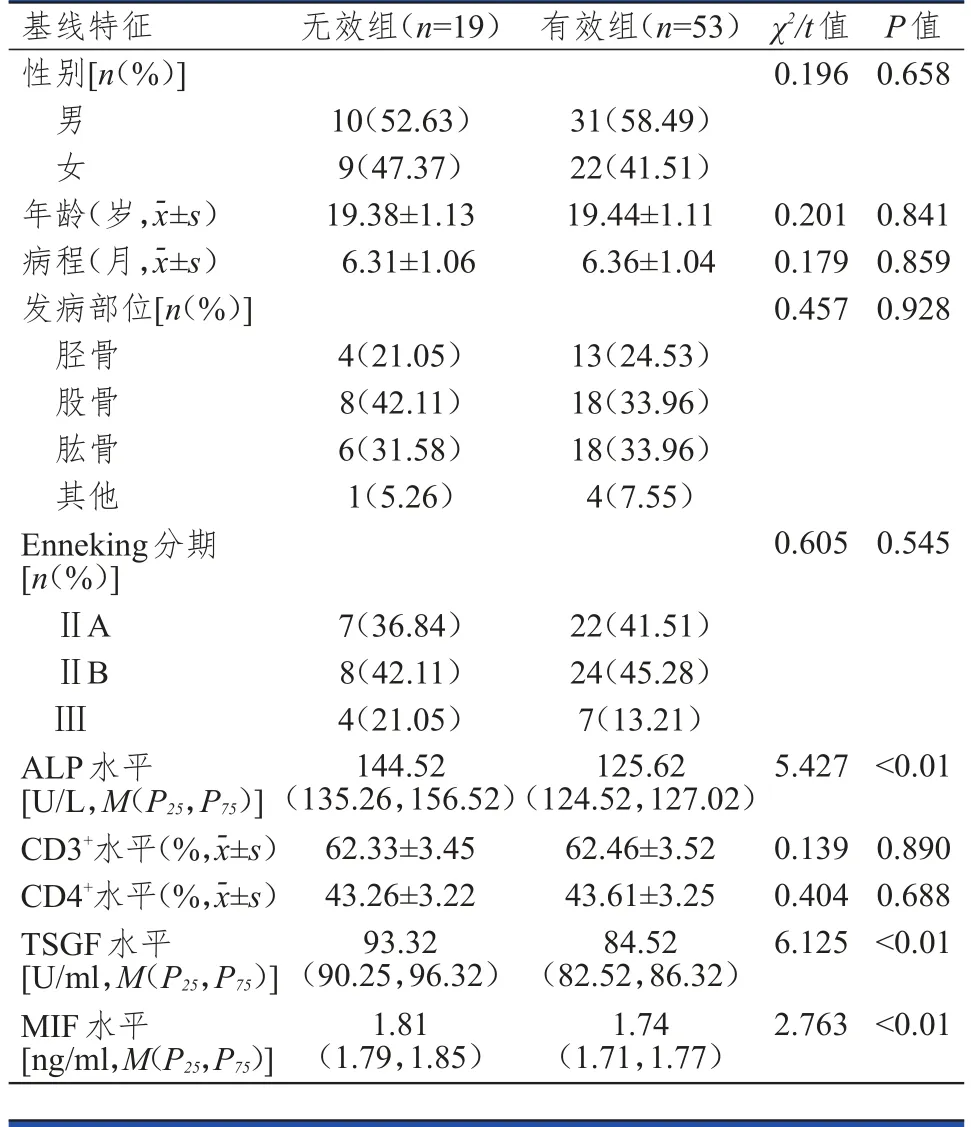
表2 无效组和有效组OS患者基线特征的比较
2.4 OS患者免疫靶向治疗效果影响因素的多因素分析
以2.3中差异有统计学意义的因素ALP、TSGF、MIF作为自变量,以OS患者免疫靶向治疗效果作为因变量(有效=0,无效=1),进行二元Logistic回归分析,结果显示,治疗前血清ALP、TSGF、MIF水平均是OS患者免疫靶向治疗效果的影响因素(P<0.01)。(表3)
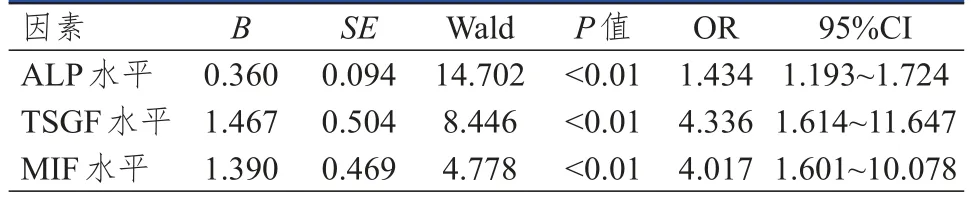
表3 OS患者免疫靶向治疗效果影响因素的多因素分析
2.5 血清TSGF、MIF对OS患者免疫靶向治疗效果的预测价值
血清TSGF、MIF单独及联合检测预测OS患者免疫靶向治疗效果的AUC分别为0.825、0.805、0.914,联合检测的预测价值高于单独检测。(图1、表4)

表4 血清TSGF、MIF对OS患者免疫靶向治疗效果的预测价值
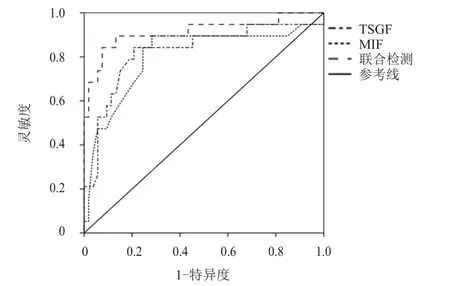
图1 血清TSGF、MIF单独及联合检测预测OS患者免疫靶向治疗效果的ROC曲线
3 讨论
OS多发于青少年群体,具有生长速度快、恶性程度高等特点,据报道,OS约占全身骨肿瘤的10%,且近年来发病率不断升高[10]。随着医疗技术的提升和免疫靶向治疗的应用,OS患者的5年生存率已从20%左右提高至60%以上,但仍有部分患者治疗效果不佳,预后不良[11]。因此,探索OS患者免疫靶向治疗效果的相关指标,有助于早期预测治疗效果,指导临床调整治疗方案,提高患者整体获益。
TSGF是肿瘤细胞分泌的一类特殊蛋白,该蛋白可为肿瘤细胞生长提供所需物质,而且可以促进肿瘤新生血管生成,加速肿瘤细胞增殖[12]。研究指出,TSGF表达水平越高,说明肿瘤细胞增殖速度越快,目前TSGF已在临床中作为评估恶性肿瘤生长的广谱指标之一[13]。另有研究显示,TSGF表达可能与恶性肿瘤的侵袭性有关,其过表达提示肿瘤侵袭性强,治疗难度高[14]。陈海华[15]的研究表明,膀胱癌患者的血清TSGF高表达,但术后TSGF水平显著降低,说明TSGF表达与临床治疗效果有关。MIF是一种T淋巴细胞活化因子,该因子可促进炎症介质释放,且研究发现,MIF在肿瘤发生、发展过程中也具有重要作用[16]。据报道,在肿瘤发展过程中,MIF可抑制p53蛋白,加速肿瘤细胞增殖,且可增强内皮细胞的分化功能,促进肿瘤新生血管生成,从而增加肿瘤转移风险[17]。目前,MIF已被证实在结肠癌、肝癌等多种恶性肿瘤中表达,且与肿瘤细胞的淋巴结转移情况及分化程度等有关[18]。蔡滕等[19]研究发现,OS组织中MIF阳性表达率高于癌旁组织,且MIF表达与OS患者肺转移有关,可评估患者预后。结合上述TSGF、MIF促肿瘤生长机制及评估恶性肿瘤患者预后的价值,猜测二者可用于预测OS患者的免疫靶向治疗效果。
本研究结果显示,治疗12周结束时,OS患者的血清TSGF、MIF水平均明显低于治疗前,说明TSGF、MIF可能参与了OS的发生发展,随着治疗的实施,患者TSGF、MIF水平发生变化。本研究比较免疫靶向治疗有效和无效OS患者的基线特征,然后进行二元Logistic回归分析,并建立多元回归模型,结果显示,治疗前血清ALP、TSGF、MIF水平均是OS患者免疫靶向治疗效果的影响因素,OS患者免疫靶向治疗无效可能与TSGF、MIF表达水平高有关;进一步绘制ROC曲线发现,治疗前血清TSGF、MIF水平均对OS患者免疫靶向治疗效果具有较好的预测价值,当二者的cut-off值分别为88.595 U/ml、1.785 ng/ml时,可获得最佳预测价值,随着二者表达水平的升高,治疗无效风险增加。根据此结果对未来OS患者的免疫靶向治疗给出建议,对于免疫靶向治疗前血清TSGF、MIF水平较高的OS患者,临床应增加其他治疗手段,如放射治疗、联合使用其他免疫抑制剂等,并定期检测血清TSGF、MIF水平,合理调整治疗方案。本研究发现,TSGF、MIF联合检测对OS患者免疫靶向治疗疗效的预测价值高于单独检测,考虑未来将两者结合,以提高患者获益。
本研究还发现,ALP表达水平也与OS患者免疫靶向治疗效果有关。ALP是由肝脏、骨骼组织分泌的糖蛋白,该蛋白在机体成骨过程中可水解磷酸酯及焦磷酸盐,为骨细胞增生提供条件[20]。但也有研究发现,OS患者肿瘤细胞增殖过程中会生成大量ALP,而ALP表达水平升高可能会促进肿瘤细胞生长和疾病进展,从而影响治疗效果,且ALP已被证实是反映OS病情的标志物之一[21]。经二元Logistic回归分析后建立多元回归模型,结果显示,ALP表达水平升高造成的影响不及TSGF、MIF,因此本研究并未将其作为主要分析指标,且未探讨ALP对OS患者免疫靶向治疗效果的预测价值,研究结果存在局限性;同时可能还有更多的指标与OS患者免疫靶向治疗效果存在关系,未来仍需加大样本量进行前瞻性研究加以验证。
综上所述,部分OS患者经免疫靶向治疗无效,可能与患者治疗前血清TSGF、MIF水平较高有关,考虑未来可将TSGF、MIF作为辅助评估OS患者免疫靶向治疗效果的重要指标。
