磁共振动态增强扫描及弥散加权成像在评估早期宫颈癌淋巴血管间隙侵犯中的应用价值
2022-08-10石洋洋付娟刘浩
石洋洋,付娟,刘浩
榆林市第二医院磁共振室,陕西 榆林 719000
宫颈癌的病死率及发病率均居全球女性恶性肿瘤第4位[1],对于早期宫颈癌患者,采用以手术为主的综合疗法可使多数患者获益。随着相关研究的不断深入,目前发现部分宫颈癌患者术后存在复发情况,且疾病复发极大地限制了患者的远期生存及生活质量[2]。学者认为,对宫颈癌复发的危险因素进行甄别,并以此为依据对治疗方案进行调整,具有重要临床意义[3]。相关研究显示,宫颈癌淋巴血管间隙侵犯(lymph-vascular space invasion,LVSI)与肿瘤浸润、细胞转移、疾病复发等具有密切联系,同时也是影响宫颈癌患者预后的独立危险因素[4]。有研究指出,LVSI对宫颈癌的临床治疗方案有重要临床意义[5]。目前临床上对于LVSI的判定主要依赖术中病理活检。随着影像学技术的发展,MRI技术在宫颈癌的诊断中发挥重要作用,可通过术前多阶纹理特征参数构建模型,能实现对多种肿瘤病灶的高分辨率扫描。目前关于MRI对LVSI的诊断尚缺乏足量文献,本研究探讨弥散加权成像(diffusion-weighted imaging,DWI)及磁共振动态增强扫描(dynamic contrast enhancedmagnetic resonance imaging,DCE-MRI)诊断宫颈癌LVSI的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年12月至2021年12月榆林市第二医院收治的早期宫颈癌患者的病历资料。纳入标准:①经病理检查确诊为早期宫颈癌;②已在榆林市第二医院接受手术;③影像学资料及临床资料完整;④在榆林市第二医院行DCE-MRI检查及DWI检查。排除标准:①合并肝肾功能障碍;②合并其他原发性肿瘤疾病;③确诊前进行过宫颈癌相关治疗。根据纳入、排除标准,共纳入80例早期宫颈癌患者,年龄41~72岁,平均(52.24±6.21)岁;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期[6]:Ⅰa期 34例,Ⅰb期25例,Ⅱa期21例。参考相关文献[6],根据早期宫颈癌患者是否出现LVSI分为观察组(合并LVSI,n=31)及对照组(未合并LVSI,n=49)。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 检查方法
所有患者做好常规MRI检查前准备,适当憋尿,仪器选择飞利浦Achieva 3.0T超导核磁共振扫描仪,腹部16通道相阵控线圈,扫描范围:矢状位为两侧髂骨翼内缘,轴位包括盆腔骨盆区。首先对患者矢状位进行扫描,参数设置:矢状位T2加权成像(T2 weighted imaging,T2WI)层间距1 mm,层厚4 mm,回波时间90 ms,重复时间3200 ms,矩阵256×320;轴位T2WI层间距1 mm,层厚4 mm,回波时间80 ms,重复时间3700 ms,矩阵256×256。完成常规扫描后注射动态增强扫描造影剂,注射速率 2.5~3.0 ml/s,剂量为 15 ml,设置扫描序列为 e-THRIVE,对患者行连续动态增强扫描,共扫描12期,层数为100层,每期扫描时间为12 s。
完成上述扫描后对患者进行轴位DWI扫描,序列选择单次激发平面回波成像(echo planar imaging,EPI)序列,参数设置:扩散系数 b为0、800 s/mm2,矩阵128×128,扫描方向为X、Y及Z,层厚4 mm,层间距1 mm,重复时间2960 ms,回波时间73 ms,激励次数(number of excitation,NEX)为2。
1.3 图像分析及病理学检查
扫描完成后,由两位经培训的影像科医师分析图像,获取DCE-MRI及DWI相关参数,当结果出现分歧时协商至统一结果。
对手术标本行病理学检查,病理切片后采用苏木精-伊红(hematoxylin-eosin,HE)染色,同时行D2-40及CD34免疫组化染色,LVSI参考FIGO标准[7]:淋巴管或血管内皮界限内存在肿瘤细胞,镜下可见D2-40及CD34棕色染色的淋巴管及小血管腔结构。病理学检查由2名资历丰富的医师进行判定,意见分歧时由病理科副主任进行协商并达成一致。
1.4 观察指标
①观察DCE-MRI及DWI图像。②比较两组患者DCE-MRI相关参数[血管外细胞外间隙容积比(Ve)、容量转移常数(Ktrans)、速率常数(Kep)]。③比较两组患者DWI相关参数[病灶平均表观扩散系数(apparent diffusion coefficient,ADC)值、病灶最小ADC值、病灶周围ADC值]。④以病理学检查结果为金标准,计算DCE-MRI、DWI及二者联合(联合诊断时任意1种方法诊断为阳性即判定为阳性)诊断LVSI的阳性预测值、阴性预测值、灵敏度、特异度及准确度。⑤构建ROC曲线,分析DCE-MRI及DWI诊断LVSI的效能。
1.5 统计学方法
采用SPSS 19.0软件处理数据,计数资料以例数及率(%)表示;计量资料以均数±标准差(±s)表示,组间比较采用t检验;构建受试者工作特征(receiver operating characteristic,ROC)曲线,对 DCEMRI及DWI的诊断效能进行分析;以P<0.05为差异有统计学意义。
2 结果
2.1 DCE-MRI及DWI图像结果
轴位T2WI可见宫颈后壁黏膜增厚,呈稍高信号(图1A);轴位DWI可见宫颈后壁呈高信号(图1B);轴位动态增强可见宫颈后壁黏膜明显强化,周围可见扭曲、增粗强化血管(图1C、图1D)。
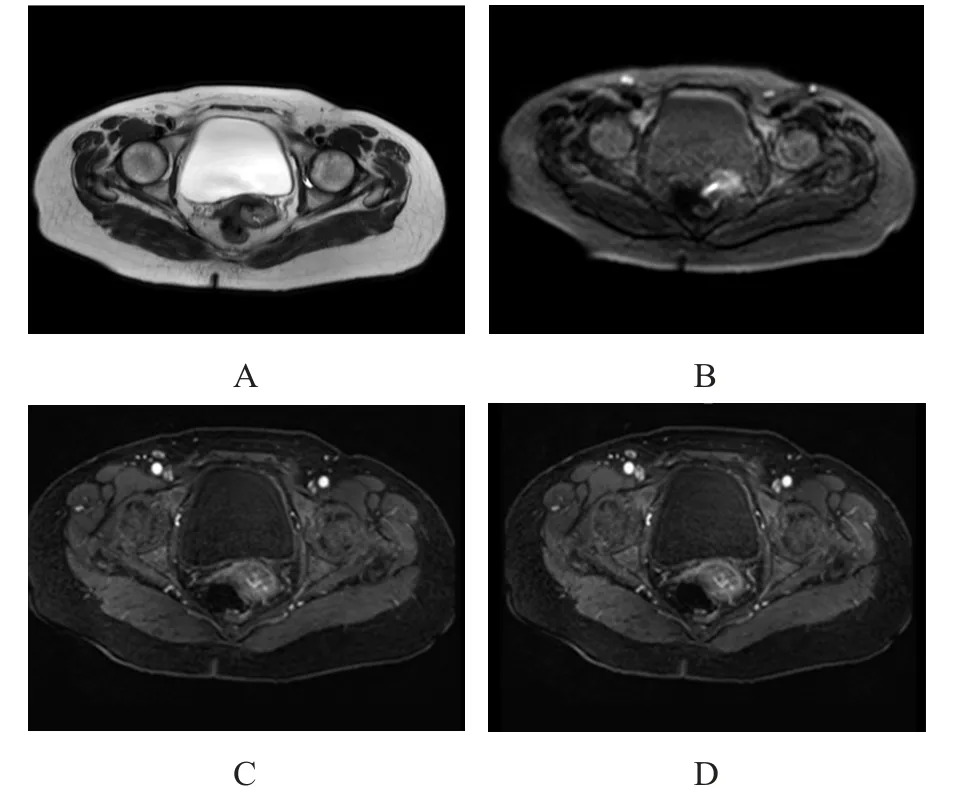
图1 早期宫颈癌患者DCE-MRI及DWI图像结果
2.2 DCE-MRI相关参数的比较
观察组患者的Kep、Ktrans及Ve均高于对照组,差异均有统计学意义(P<0.05)。(表1)
表1 两组患者DCE-MRI相关参数的比较(±s)
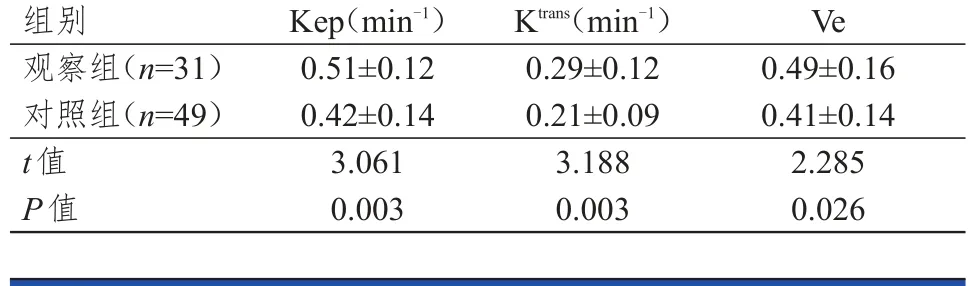
表1 两组患者DCE-MRI相关参数的比较(±s)
组别观察组(n=31)对照组(n=49)t值P值Kep(min-1)0.51±0.12 0.42±0.14 3.061 0.003 Ktrans(min-1)0.29±0.12 0.21±0.09 3.188 0.003 Ve 0.49±0.16 0.41±0.14 2.285 0.026
2.3 DWI相关参数的比较
观察组患者最小ADC值明显低于对照组,差异有统计学意义(P<0.01)。两组患者平均ADC值及周围ADC值比较,差异均无统计学意义(P>0.05)。(表2)
表2 两组患者DWI相关参数的比较(×10-3mm2/s,±s)

表2 两组患者DWI相关参数的比较(×10-3mm2/s,±s)
组别观察组(n=31)对照组(n=49)t值P值1.03±0.18 1.06±0.15 0.774 0.443 0.75±0.17 0.96±0.16 5.506<0.01 1.49±0.19 1.52±0.25 0.607 0.546平均ADC值 最小ADC值 周围ADC值
2.4 DCE-MRI、DWI单独及联合检查诊断宫颈癌LVSI的效能
80例患者中共检出LVSI 31例,DCE-MRI诊断LVSI的准确度为81.25%,特异度为77.55%,灵敏度为87.10%,阳性预测值为71.05%,阴性预测值为90.48%;DWI诊断LVSI的准确度为78.75%,特异度为73.47%,灵敏度为87.10%,阳性预测值为67.50%,阴性预测值为90.00%;二者联合诊断LVSI的准确度为96.25%,特异度为95.92%,灵敏度为96.77%,阳性预测值为93.75%,阴性预测值为97.92%。联合诊断的准确度高于DCE-MRI或DWI单独诊断,且联合诊断与金标准的Kappa值(0.63)高于 单 独 使 用 DCE-MRI(0.45)或 DWI(0.49)。(表 3)

表3 DCE-MRI、DWI单独及联合检查诊断宫颈癌LVSI与病理结果的对照
2.5 DCE-MRI及DWI诊断宫颈癌LVSI的ROC曲线
构建DCE-MRI及DWI诊断宫颈癌LVSI的ROC曲线,结果显示,DCE-MRI诊断宫颈癌LVSI的曲线下面积(area under the curve,AUC)为0.809,DWI诊断宫颈癌LVSI的AUC为0.784,二者联合诊断宫颈癌LVSI的AUC为0.921,联合诊断的AUC最大。(图2)
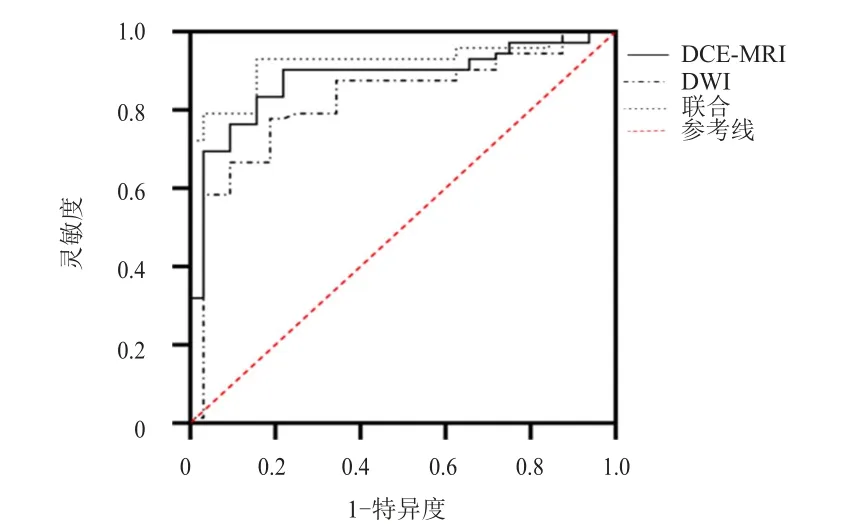
图2 DCE-MRI、DWI单独及联合诊断宫颈癌LVSI的ROC曲线
3 讨论
宫颈癌的治疗方法及预后与患者临床分期密切相关,指南指出对于早期宫颈癌(FIGO分期为Ⅰ~Ⅱa期)患者仅需进行宫颈癌根治术[7]。随着相关研究的不断深入,发现早期宫颈癌患者是否合并LVSI对早期宫颈癌的治疗方案及预后影响较大[8]。目前宫颈癌LVSI的诊断主要依赖病理学活检,但存在取材位置不当、标本组织难以反映病灶整体情况等问题,故利用影像学手段评估患者LVSI的情况具有重要临床意义。有研究显示,采用MRI能够较好诊断宫颈癌,同时在判断临床分期、治疗效果方面有积极意义[9],但目前关于MRI对早期宫颈癌LVSI评估价值的相关报道较少。
MRI能够实现对病灶的多参数、多角度成像,分辨率极高,能够清晰显示肿瘤病灶位置,判断肿瘤分期,但随着相关研究的不断开展,目前发现,MRI常规序列图像在分辨宫颈癌病灶组织合并炎症、水肿等病变时,存在一定难度[10]。此外有研究指出,MRI常规序列在诊断仅局限于黏膜内的早期病变及浸润深度较浅的病变方面,临床价值有限,需结合其他方法方能明确诊断[11]。病理学研究显示,宫颈癌病灶内存在大量的新生血管,在肿瘤病灶体积增大过程中,对新生血管的依赖程度逐渐升高,且恶性病灶通常合并血管壁发育未完全的微血管结构,通过恶性病灶与正常组织的差异能够实现临床诊断[12]。DCE-MRI通过在患者静脉内注射对比剂,改变MRI扫描过程中的部分参数,达到进一步提高分辨率、影像对比度的作用。相关研究显示,对比剂可在新生血管中聚集,通过新生血管壁向细胞间隙渗透,此过程中信号可达到峰值[13]。有研究显示,DCE-MRI检查过程中可通过造影剂血流动力学指标评估肿瘤病灶内新生血管数量、血管通透性及病灶内部微环境等,进而判断肿瘤内部乏氧情况,评估治疗效果[14]。DWI序列是临床应用广泛的功能成像序列之一[15],也是目前影像学检查手段中唯一可观察活体组织内水分子运动的检查方法,病灶组织出现病变时,引起正常组织中细胞结构、细胞密度及细胞代谢状态发生明显改变,此过程中显著改变了单位时间内水分子的扩散距离,通过对上述过程进行检测,可实现病灶的鉴别。本研究中采用了DCE-MRI及DWI对早期宫颈癌患者进行检查,结果显示对于合并LVSI的患者,DCE-MRI结果显示观察组的Kep、Ktrans及Ve均高于对照组。分析后认为,在临床分期越晚的肿瘤病灶中,Kep、Ktrans及Ve值越高,因临床分期越晚,患者新生血管数量越多,透过血管壁进入细胞间隙的对比剂越多,故能检测到Kep、Ktrans及Ve增加,而在合并LVSI的早期宫颈癌患者中,由于肿瘤细胞已侵犯淋巴及血管,并形成了管腔结构,故在DCE-MRI检查过程中Kep、Ktrans及Ve值更高[16]。本研究结果显示,观察组患者最小ADC值明显低于对照组。分析后认为,水分子的运动受布朗运动及人体血管灌注情况的影响,在肿瘤病灶组织中,恶性程度越高,其细胞密集性越好,导致水分子扩散受限,故其ADC值下降[17],对于合并LVSI的早期宫颈癌患者,由于肿瘤细胞侵袭至淋巴管及血管,导致新生血管灌注情况改变,进而引起ADC值下降。本研究中DCE-MRI及DWI诊断时存在漏诊及误诊情况,分析后认为,DCE-MRI检查过程中,由于不同患者疾病分期不同,导致肿瘤病灶血管通透性存在一定差异,故表现为DCE-MRI各项参数存在较大差异,引起漏诊及误诊;而DWI检查过程中,由于患者的血管灌注情况差异,引起ADC值存在较大差异,进而导致漏诊及误诊。本研究结果显示,在诊断效能方面,DCE-MRI联合DWI诊断早期宫颈癌合并LVSI的准确度高于单一诊断,提示在临床上可将两种方法联合,以提高诊断效能。
综上所述,早期宫颈癌合并LVSI患者的Kep、Ktrans及Ve值均升高,最小ADC值降低,临床上可通过结合DCE-MRI及DWI提高对早期宫颈癌合并LVSI的诊断准确度。
