朱顶红试管苗离体保存及恢复生长研究
2022-08-10陈敏敏张永春蔡友铭杨柳燕
陈敏敏,张永春,蔡友铭,苏 静,李 心,周 琳,杨柳燕
(上海市农业科学院 林木果树研究所/上海市设施园艺技术重点实验室,上海 201403)
朱顶红(Hippeastrumspp.)为石蒜科朱顶红属多年生球根花卉,原产于南美地区,花朵硕大,花姿优雅,近年来在庭院绿化、家庭园艺中被广泛应用[1]。朱顶红田间保存主要采用种球连续种植的方法,多年种植和无性繁殖容易导致病毒感染和积累,造成种球种性退化,因此建立朱顶红种质资源离体保存技术体系非常迫切。通过优化朱顶红离体离体保存期间培养基添加物的种类和浓度,减少继代频率,有效延长离体保存时间具有重要现实意义。
限制生长离体保存是一种确保培养物能维持存活与再生潜能的同时,通过显著减缓植物生理代谢过程以延长保存时间、降低维护成本的保存方法[2-3],其中添加渗透性化合物和生长抑制剂是两种常见的保存方式[4-5]。常用的生长延缓剂和抑制剂有脱落酸(ABA)[6-7]、矮壮素(CCC)[8]、甘露醇[9]、多效唑(PP333)[8,10]等。Sharaf等[11]报道在培养基中添加一定浓度的蔗糖能调节渗透压,使植物减少对水分和矿物质的吸收,从而延长保存时间。甘露醇也有增加离体种质存活率的作用,兰伟等[9]研究表明,20g/L的甘露醇保存香青兰试管苗9个月后的存活率可达40%;牛爱国等[10]研究表明10 g/L甘露醇能使樱桃试管苗保存7.5个月的存活率达到62%;马铃薯培养基中添加甘露醇可显著提高存活率[4]。脱落酸(ABA)有促进衰老、抑制植株生长等生理作用[6],郭延平等[7]研究表明ABA能抑制猕猴桃试管苗的生长,且随着保存时间的延长,丙二醛含量积累,超氧化物歧化酶活性下降;蒋元斌[8]研究表明,低温暗培养条件下ABA最佳处理浓度为1.0 mg/L,试管苗存活率较高。除此之外,李洋等[12]研究表明玉簪试管苗在蔗糖50 g/L+甘露醇20 g/L+脱落酸1 mg/L+矮壮素20 mg/L的培养基中保存6个月后成活率仍为100%,保存材料的细胞膜脂氧化程度降低,延缓了衰老进程;Gabriela 等[13]研究了蔗糖和嘧啶醇对少刺梅洛仙人掌和白梅洛仙人掌离体保存的影响,结果表明75 g/L的蔗糖添加可保存360 d;Koeda等[2]研究表明‘Momotaro’生根植株接种于添加2%蔗糖的MS培养基上,在10 ℃保存时,3个月后仅有27%的不定芽需要转接。矮壮素可显著抑制植物细胞伸长,从而使植物变矮,如培养基中添加30 mg/L矮壮素处理能使文心兰保存12个月的存活率达76.7%~80.0%[14]。
植物生长抑制剂通过阻碍植物顶端分生组织细胞中蛋白质和核酸的生物合成、抑制其伸长和分化,从而导致植物细胞分裂速度减慢、植株变矮。随着离体保存时间的增加,植物会发生不同程度的生理生化改变,添加物浓度不适宜易造成植物细胞内活性氧代谢失调、自由基过度积累,从而导致膜脂过氧化[12],因此需根据不同植物种类及品种对生长抑制剂及延缓剂进行优化筛选。目前关于朱顶红种质资源离体保存的研究报道较少,本研究通过优化朱顶红离体保存过程中培养基添加物的种类和浓度,观察植株离体保存5个月及恢复培养2个月后的生长发育情况,筛选适宜朱顶红植株离体保存的最佳技术方案,为朱顶红属植物种质资源的保存提供技术参考。
1 材料与方法
1.1 试验材料
朱顶红无菌保存材料W17无菌苗来自上海市农业科学院朱顶红种质资源保存中心。将试管苗在MS培养基(MS+3%蔗糖+7.0 g/L琼脂,pH 5.8)中培养,获得直径约1.0 cm的朱顶红鳞球作为本研究中的试验材料。
1.2 试验方法
1.2.1 试管苗离体保存比较 试管苗离体保存以1/2 MS+6-BA 2 mg/L+NAA 0.1 mg/L+7.0 g/L琼脂为基本培养基,pH=5.8,分别添加 15、30、45、60、75 g/L蔗 糖,10、20、30、40、50 g/L的 甘 露 醇,10、20、30、40、50 mg/L CCC和0.5、1.0、2.0、3.0、4.0 mg/L ABA,以不添加生长调节剂的培养基作为对照,每瓶接种3个种球,每处理接种5瓶,培养温度为(15±2)℃,光照时间为10 h,光照强度2500~3000 lx。每月观察统计试管苗枯叶数、成活率,5个月后统计离体保存朱顶红植株的株高、叶片数、叶长、根系数、根长等生长发育指标。
1.2.2 试管苗恢复培养生长发育观测 将保存5个月的植株切去枯叶和根,将种球转入1/2 MS+6-BA 2 mg/L+NAA 0.1 mg/L+7.0 g/L琼脂的培养基上进行恢复培养,培养温度为(23±2)℃,光照时间为12 h,光照强度为2500~3000 lx。每月统计植株的死亡率,2个月后测量统计朱顶红的株高、叶长、叶片数、根数、根长等生长发育指标。
1.3 数据分析
使用SPSS 17.0软件采用单因素方差分析法(ANOVA)进行数据分析,差异显著性为P≤0.05。
2 结果与分析
2.1 不同培养基添加物对朱顶红离体保存的影响
2.1.1 不同浓度蔗糖对朱顶红离体保存的影响 由表1、表2可知,在添加不同浓度蔗糖的培养基中离体保存的朱顶红植株均正常生长发育,随着蔗糖浓度的增加,W17植株生长速度变慢、植株高度降低。叶片从第3个月开始枯萎,到第5个月5种浓度的朱顶红枯叶率均在60%以上,添加75 g/L蔗糖培养基的朱顶红枯叶率达100%。离体保存5个月后,高浓度蔗糖中的植株生长速度较其他浓度植株慢,添加75 g/L蔗糖的朱顶红生长发育缓慢,植株矮,叶片较短,不同浓度蔗糖对朱顶红存活率的影响不大,均为100%(表2、图1)。
2.1.2 不同浓度甘露醇对朱顶红离体保存的影响 由表1可知,在添加不同浓度甘露醇的培养基中,朱顶红生长发育缓慢,只长出少量叶片,且叶片从第2个月开始出现枯萎,枯萎时间早于其他几种添加物;到第5个月时不同浓度的朱顶红枯叶率均达20%以上,添加10 g/L甘露醇培养基的朱顶红枯叶率达80%。不同浓度甘露醇对朱顶红存活率的影响不大,均为100%。离体保存5个月后,在添加甘露醇的培养基中,朱顶红植株长叶片较少,个别植株死亡;1/2 MS培养基中添加10~50 g/L甘露醇能有效抑制朱顶红植株生长,保存5个月后恢复培养成活率达60%以上(表2、图1)。

表1 不同外源添加物对朱顶红W17枯叶率及存活率的影响
2.1.3 不同浓度矮壮素对朱顶红离体保存的影响 由表1、表2可知,在添加不同浓度矮壮素的培养基中,朱顶红生长发育较正常,叶片从第3个月开始枯萎,到第5个月5种不同浓度的朱顶红枯叶率达40%以上,添加20 mg/L矮壮素的培养基枯叶率达100%(表1)。除添加50 mg/L矮壮素的存活率为80%外,其他浓度的存活率均为100%(表1)。随着矮壮素浓度的增加,离体保存5个月后,植株高度呈现下降的趋势,但W17植株高度均大于对照(表2,图1),而且高于其他几种添加物的,叶片数多,叶长、根长等指标也较其他添加物的高,表明10~50 mg/L矮壮素对朱顶红试管苗生长没有起到明显的抑制作用。
2.1.4 不同浓度脱落酸(ABA)对朱顶红离体保存的影响 由表1、表2可知,在添加不同浓度ABA的培养基中,朱顶红很少长叶片,少量长出的叶片从第3个月开始枯萎,到第5个月5种不同浓度的朱顶红枯叶率达20%以上,添加0.5 mg/L ABA的培养基的朱顶红枯叶率达60%。除添加1 mg/L ABA培养基的朱顶红的存活率为80%外,添加其他浓度ABA对朱顶红存活率的影响不大,均为100%(表1)。离体保存5个月后,在添加ABA的培养基中,朱顶红植株高度均低于对照,添加1~4 mg/L ABA的朱顶红不长根(表2,图1)。ABA的添加明显抑制了朱顶红植株的生长发育,且恢复生长后植株死亡率较其他几种添加物高,0.5~4.0 mg/L ABA离体保存5个月后恢复生长培养2个月的死亡率为20%~50%。

图1 不同外源添加物对朱顶红W17离体保存的影响
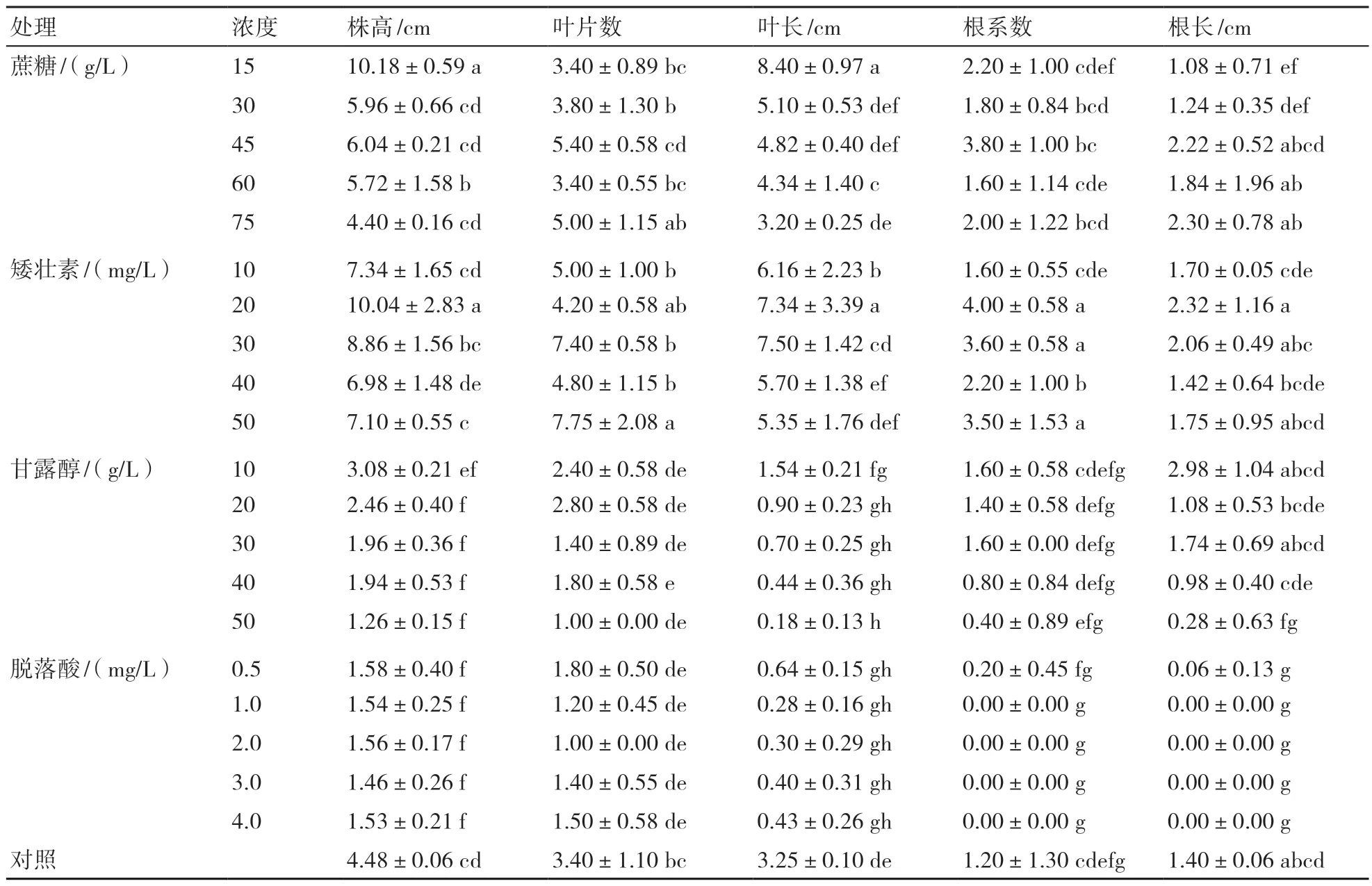
表2 朱顶红W17离体保存5个月的形态指标
2.2 不同培养基添加物对朱顶红恢复生长的影响
2.2.1 不同浓度蔗糖处理对朱顶红恢复生长的影响 恢复生长培养60 d后统计朱顶红死亡率,发现不同蔗糖浓度培养条件下的朱顶红植株死亡率为0,表明添加蔗糖浓度10~75 g/L不会造成朱顶红种球死亡(表3),植株生长发育正常。其中在60 g/L蔗糖中离体保存的朱顶红恢复培养时植株高度最高,为14.60 cm;叶长最长,为12.74 cm;叶片数在添加45 g/L蔗糖培养基中最多,为12.20(表4)。添加75 g/L蔗糖作为离体保存朱顶红的外源添加物效果较好。

表3 不同外源添加物对朱顶红W17离体保存后恢复生长的影响
2.2.2 不同浓度甘露醇处理对朱顶红恢复生长的影响 恢复生长培养60 d后统计朱顶红死亡率,发现添加50 g/L甘露醇离体保存条件下恢复生长时有40%的植株死亡,添加10~40 g/L甘露醇离体保存条件下恢复生长时死亡率为0%(表3),表明太高浓度的甘露醇不适合用于朱顶红离体保存。添加30 g/L甘露醇离体保存条件下恢复生长时植株高度为5.36 cm,添加40 g/L甘露醇离体保存条件的叶片数最多,为14.60(表4),甘露醇较适宜的添加浓度为20~40 g/L。
2.2.3 不同浓度矮壮素处理对朱顶红恢复生长的影响 恢复生长培养60 d后统计朱顶红死亡率,发现不同矮壮素浓度培养条件下的朱顶红植株死亡率为0,表明矮壮素添加浓度10~50 mg/L不会造成朱顶红种球死亡(表3),植株生长发育正常。不同矮壮素浓度离体保存后恢复生长植株高度变化不大,其中在添加50 mg/L矮壮素离体保存的朱顶红恢复培养时植株高度最高,为8.80 cm;在添加30 mg/L矮壮素离体保存的朱顶红恢复培养时叶片数最多,为10.80(表4)。
2.2.4 不同浓度脱落酸(ABA)处理对朱顶红恢复生长的影响 恢复生长培养60 d后统计朱顶红死亡率,发现不同ABA浓度离体保存条件下的朱顶红植株死亡率较高,恢复生长1个月后统计添加不同ABA浓度离体保存下,恢复生长时植株死亡率从20%到25%不等,恢复生长2个月后统计添加不同ABA浓度离体保存下,恢复生长时植株死亡率从20%到50%不等(表3)。添加的ABA浓度越高,恢复生长培养时植株高度越低(表4)。添加ABA作为离体保存朱顶红的外源添加物恢复生长后死亡率较其他几种外源添加物高。

表4 朱顶红W17恢复生长2个月的形态指标
3 讨论
蔗糖、脱落酸、甘露醇及矮壮素等外源添加物用于离体保存在不同植物中均有成功的报道,本研究分析了培养基中单独添加这4种外源添加物对朱顶红种球离体保存的影响,发现离体保存的效果差异较显著。
蔗糖对植物离体培养有双重作用,合适浓度的蔗糖可以为植株生长发育提供碳源,而高浓度的蔗糖则会形成渗透胁迫,从而抑制植物生长发育,有利于植物的离体保存研究[15-16]。如Siberia百合在添加50~90 g/L蔗糖的培养基中能保存试管苗11个月以上[17]。MS培养基中添加90~110 g/L的蔗糖能抑制大花卷丹的生长[18],但蔗糖浓度过高也会对植株产生毒害作用,如王小乐等[19]在菊花中的研究表明,在60 g/L蔗糖处理下,南农橙乒乓和小洋菊保存12个月存活率达70%以上,但植株生长状况差,40~90 g/L蔗糖对蒙娜丽莎黄和橙安娜保存效果不佳,相似的结果也在木薯[20]等植物中报道过,因此,需根据离体保存的材料和品种进行筛选优化。本研究发现朱顶红W17在75 g/L蔗糖离体保存5个月能显著抑制朱顶红植物的生长发育,且恢复生长培养状态良好,这与同为球根植物的百合的研究结果较相近,蔗糖适宜浓度均高于菊花等草本类花卉。
ABA作为生长抑制剂具有促进植物休眠的作用。在培养基中添加1.0~3.0 mg/L的脱落酸能有效延长Siberia百合试管苗的继代培养间隔时间,离体保存9个月时存活率均超过80%[17]。0.2~2.0 mg/L的ABA保存木薯的长势和存活率均较差[21]。本研究中ABA与矮壮素、甘露醇和蔗糖相比,随着培养基中ABA浓度的增加,植株死亡率升高,说明0.5~4.0 mg/L ABA不太适用于朱顶红离体保存。
作为渗透调节物质,甘露醇添加会造成植物养分和水分吸收较困难,导致新陈代谢减弱[22]。王小乐等[19]研究表明,15 g/L的甘露醇使南农橙乒乓和小洋菊试管苗的离体保存达12个月,20 g/L甘露醇能使蒙娜丽莎黄和橙安娜的保存达12个月。陈辉等[17]报道培养基中添加10~50 g/L甘露醇对Siberia百合试管苗生长没有起到明显的限制作用。本研究使用30 g/L甘露醇可使朱顶红W17保存5个月的存活率达100%;当甘露醇浓度达50 g/L时,保存5个月后朱顶红植株存活率降低为60%。朱顶红离体保存中甘露醇浓度均高于菊花、樱桃、香青兰等植物,说明不同种植物对甘露醇渗透胁迫的适应性存在较大的差异,这可能与朱顶红是地下鳞茎类球根花卉,对甘露醇的耐受能力较强有关。
纪伊潮菊在1500~2000 mg/L的矮壮素中保存试管苗12个月存活率达92.86%~96.43%[23]。培养基中添加200 mg/L矮壮素对宝石无核、前项无核和黑比诺3个品种试管苗的生长抑制效果明显[24]。添加10~40 mg/L矮壮素对Siberia试管苗生长没有起到明显的抑制作用[17]。本研究添加10~50 mg/L矮壮素对朱顶红植株离体保存期间的矮化效果并不明显,经矮壮素处理5个月后的植株均能正常生长发育,这与前人在Siberia试管苗中报道的结果一致,今后需提高矮壮素浓度进一步筛选优化。李洋等[12]报道,玉簪试管苗在蔗糖50 g/L+甘露醇20 g/L+脱落酸1 mg/L+矮壮素20 mg/L中保存6个月存活率仍为100%,通过了解单独添加的生长抑制及恢复培养后的效果,今后也可进一步优化几种生长抑制剂共同添加对朱顶红离体保存及恢复培养的影响,为朱顶红种质资源离体保存提供理论依据与技术支撑。
