新化合物LFG-500 诱导人乳腺癌细胞凋亡
2022-08-10蒋海静李成林
王 凡 蒋海静 李成林 *
(1.徐州医科大学江苏省新药研究与临床药学重点实验室,江苏 徐州 221004;2.徐州医科大学附属医院,江苏 徐州 221000)
0 引言
乳腺癌是中国女性中最常见的癌症。 美国2020年癌症统计数据显示, 在确诊癌症的女性患者中,排名前三位的癌症是乳腺癌、肺癌和结直肠癌,共占新确诊病例的50%,其中乳腺癌就占了30%。现有的乳腺癌治疗方法包括化学治疗、放射治疗、靶向治疗、免疫治疗以及术前术后的内分泌治疗。 然而,作为一种恶性肿瘤,乳腺癌具有较高的转移性,手术切除后极易复发,此外,用于化疗的临床药物毒副作用较大,且肿瘤细胞极易产生耐药性。 再加上早期筛查诊断方法的缺乏和高昂的治疗成本,都使乳腺癌的治疗困难重重。 因此,寻找有效的治疗乳腺癌的方法是人类需要不断攻克的难题,而探索高效低毒性的抗癌新药尤为重要。
目前大部分细胞毒性抗癌药物都是通过诱导细胞凋亡发挥作用。 凋亡是一种程序性细胞死亡的过程,机体在正常发育过程中可借助凋亡有效的清除一些无用细胞,控制细胞数量。 因此诱导肿瘤细胞凋亡是研究抗肿瘤药物的一个重要部分。 现代药理学研究表明,天然黄酮类化合物具有抗菌、降血脂、抗病毒、抗肿瘤等多种药理作用。 然而,天然黄酮类化合物溶解度差、首过效应明显、生物利用度极低。 LFG-500(CHNO,见图1)是利用哌嗪基和苄基取代易于发生代谢的羟基,对黄酮母环进行结构修饰后合成的全新化合物。本课题组前期研究发现LFG-500 具有较好的抗肿瘤侵袭转移作用, 可抑制人乳腺癌细胞MDA-MB-231 侵袭,具有较好的抗肿瘤活性。 但是LFG-500 能否诱导人乳腺癌MCF-7 细胞凋亡尚未见报道。 因此,本文主要研究黄酮类新化合物LFG-500对乳腺癌细胞生长的抑制作用,初步探讨其诱导细胞凋亡作用及可能的机制。 相关工作可为乳腺癌的治疗、LFG-500 及黄酮类化合物的抗肿瘤研究与应用提供坚实的实验基础。
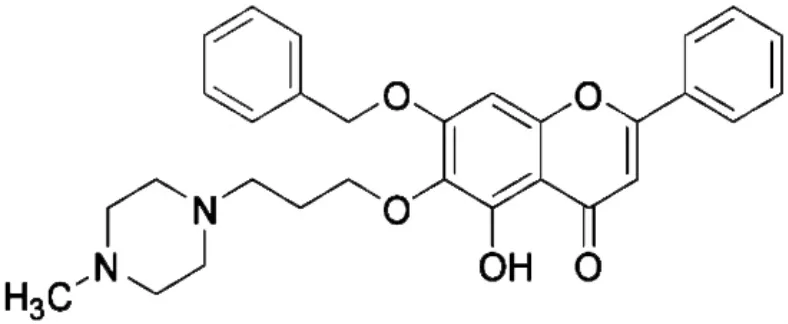
图1 LFG-500(C30H32N2O5)分子结构式
1 材料与方法
1.1 主要试剂与仪器
LFG-500 (中国药科大学江苏省肿瘤发生与干预重点实验室); 人乳腺癌MCF-7 细胞株 (上海细胞库);1640 培养基、胎牛血清(美国Gibco 公司);活性氧检测试剂盒、SDS-PAGE 蛋白上样缓冲液、SDSPAGE 凝胶配制试剂盒、Western 一抗稀释液、Western二抗稀释液 (碧云天生物技术研究所); 胰蛋白酶、MTT、DAPI、Bovine serum albumin(美国Sigma 公司);Annexin V/propidium iodide(PI)凋亡检测试剂盒、JC-1线粒体膜电位检测试剂盒(凯基生物有限公司); BCA蛋白浓度测定试剂盒 (美国Thermo Scientific 公司);PARP、pro-caspase-3/cleaved-caspase-3、pro-caspase-9/cleaved-caspase-9、Bcl-2/Bax 抗体 (美国CST 公司);酶标仪(美国BioTek 公司);恒温CO培养箱(美国Thermo Scientific 公司);超净工作台(苏净集团空气技术公司); 倒置荧光显微镜 (日本OLYMPUS 公司);Tanon 垂直电泳系统(上海天能科技有限公司);流式细胞仪(德国Miltenyi 公司)。
1.2 细胞培养
MCF-7 细胞接种于含10%FBS 和1%青霉素-链霉素溶液的1640 培养基中, 于37℃、5%CO恒温培养箱中培养。 当细胞状态良好,细胞密度达到90%时传代。
1.3 MTT 法
将MCF-7 细胞消化重悬, 按10个/孔加入96 孔板中,培养箱培养24 h,给予不同浓度的LFG-500 继续培养24 h。每孔加入20 μL MTT(5 mg/mL)培养4h,取出96 孔板,弃去上清并加入100 μL/孔的DMSO 以溶解沉淀物,最后使用酶标仪于490 nm 处检测其吸光度。 细胞活力的抑制率计算公式:
抑制率(%)=(A-A)/A×100%。
1.4 Annexin V-FITC/PI 双染细胞凋亡检测实验
取对数生长期的细胞,以0.25%胰酶-EDTA 消化,配制成10个/mL 的单细胞悬液,接种于24 孔板中,每孔接种4×10个细胞,于培养箱中培养,细胞贴壁后,将培养基替换为LFG-500 浓度为10 μM、20 μM、30 μM的1640 培养基,作用24 h。 根据试剂盒说明书,悬浮细胞200 g 离心5 min,收集;贴壁细胞用不含EDTA的胰酶消化收集。 用PBS 洗涤细胞2 次,200 g 离心5 min,收集细胞。 加入500 μL 的Binding Buffer 悬浮细胞,混匀后加入5 μL Annexin V-FITC,混匀后加入5 μl PI,混匀。室温、避光、反应15 min。1h 内使用流式细胞仪进行检测。
1.5 细胞线粒体膜电位检测
取对数生长期的细胞, 以0.25%胰酶-EDTA 消化, 配制成105 个/ml 的单细胞悬液, 接种于6 孔板中,每孔加入2 ml,于培养箱中培养。 细胞贴壁后,将培养基替换为LFG-500 浓度为10 μM、20 μM、30 μM的1640 培养基,作用24 h。收集悬浮细胞,贴壁细胞消化后收集,与收集的悬浮细胞合并,用PBS 洗涤细胞2 次,200 g 离心5 min。 取500 μL 用去离子水稀释的预热至37℃的1×Incubation Buffer,加入1 μL JC-1 染料,涡旋混匀配成JC-1 工作液。 取500 μL JC-1 工作液将细胞均匀悬浮,培养箱中孵育20 min。 室温离心200 g,5 min, 收集细胞,1×Incubation Buffer 洗2 次。吸取500 μL 1×Incubation Buffer 重新悬浮细胞,使用流式细胞仪进行检测。
1.6 细胞内活性氧(reactive oxygen species,ROS)水平检测
分组及给药同1.5。 收集悬浮细胞,并消化收集贴壁细胞, 合并。 按照1∶1000 用无血清的培养基稀释DCFH-DA 染料,使终浓度为10 μM。 每组加入1 mL稀释好的DCFH-DA 染料,在细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3 次,以充分去除未进入细胞的DCFH-DA。最后加入500 μL 的无血清培养基,吹打均匀后,使用流式细胞仪检测。
1.7 Western blot 法检测蛋白相对表达水平
分组及给药同1.5。 消化收集细胞,加入含有蛋白酶抑制剂的RIPA 裂解液充分裂解后,按BCA 蛋白测定试剂盒说明书测定样本中蛋白浓度。 同时测定样品的光密度值,计算蛋白含量,用裂解液将各样品调至相同浓度,加入5×上样缓冲液混合均匀,沸水10 min,使蛋白变性。变性后的蛋白样品于-20°C 储存。样本采用10%~15% SDS-PAGE 进行分离, 将分离的蛋白转移至硝酸纤维膜上,恒压20 V,转膜30 min。将膜用洗膜液洗涤3 次后, 转移至含有封闭液的表面皿中,在脱色摇床上摇动封闭1 h,加入对应的一抗4℃孵育过夜。 次日用洗膜液清洗3 次后,加入对应的二抗室温避光孵育2 h,洗膜液清洗3 次。 随后使用Odyssey 扫描仪扫描, 保存所得图像用Image J 软件进行灰度分析,以目的蛋白与内参蛋白光密度的比值表示目的蛋白的相对表达量。
1.8 统计学分析
数据采用SPSS 16.0 统计软件处理,数据以均数±标准误(Mean±SEM)表示,数据符合方差齐性的采用单因素方差分析(one-way ANOVA),多组间比较LSD检验; 若数据不符合方差齐性, 则采用Dunnett’s T3检验。 假设检验水准按α=0.05 判定。 *P<0.05、**P<0.01 表示差异有统计学意义。
2 结果与分析
2.1 LFG-500 抑制人乳腺癌MCF-7 细胞活力
采用MTT 实验考察不同浓度的LFG-500 对MCF-7 细胞生长的抑制作用。 结果显示, 给予不同浓度的LFG-500 处理MCF-7 细胞24 h 后,LFG-500 对细胞活力的抑制作用随着浓度的升高而逐渐增强(见图2),其IC50 值为34.07±5.81 μM。依据MTT 实验结果,选取10 μM、20 μM 和30 μM 的剂量开展后续研究。
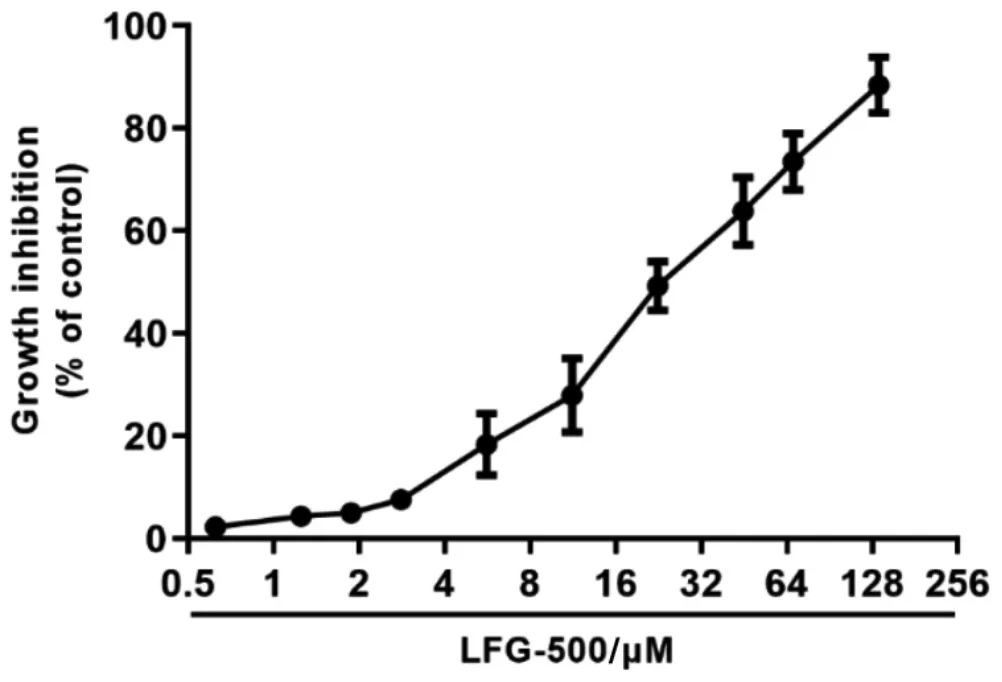
图2 LFG-500 对MCF-7 细胞活力的影响
2.2 LFG-500 对MCF-7 细胞形态的影响
用不同浓度的LFG-500 处理MCF-7 细胞24 h后, 于倒置显微镜下观察细胞形态的变化。 如图3 所示,对照组细胞贴壁生长,细胞轮廓清楚,细胞间结构紧密,细胞生长旺盛;而随着LFG-500 剂量的增加,细胞生长受到抑制,细胞变得分散,部分细胞变圆、漂浮。

图3 不同浓度LFG-500 处理MCF-7 细胞24h 的细胞形态(200×)
2.3 LFG-500 诱导MCF-7 细胞发生凋亡
采用Annexin V-FITC/PI 双染试剂盒, 利用流式细胞仪分析LFG-500 对MCF-7 细胞凋亡的诱导作用。结果如图4 所示,LFG-500 处理MCF-7 细胞24 h后,高剂量组凋亡率达到40.27±3.57%,与对照组相比具有统计学差异(**P<0.01)。上述结果表明,LFG-500可诱导人乳腺癌MCF-7 细胞凋亡,继而抑制其生长。
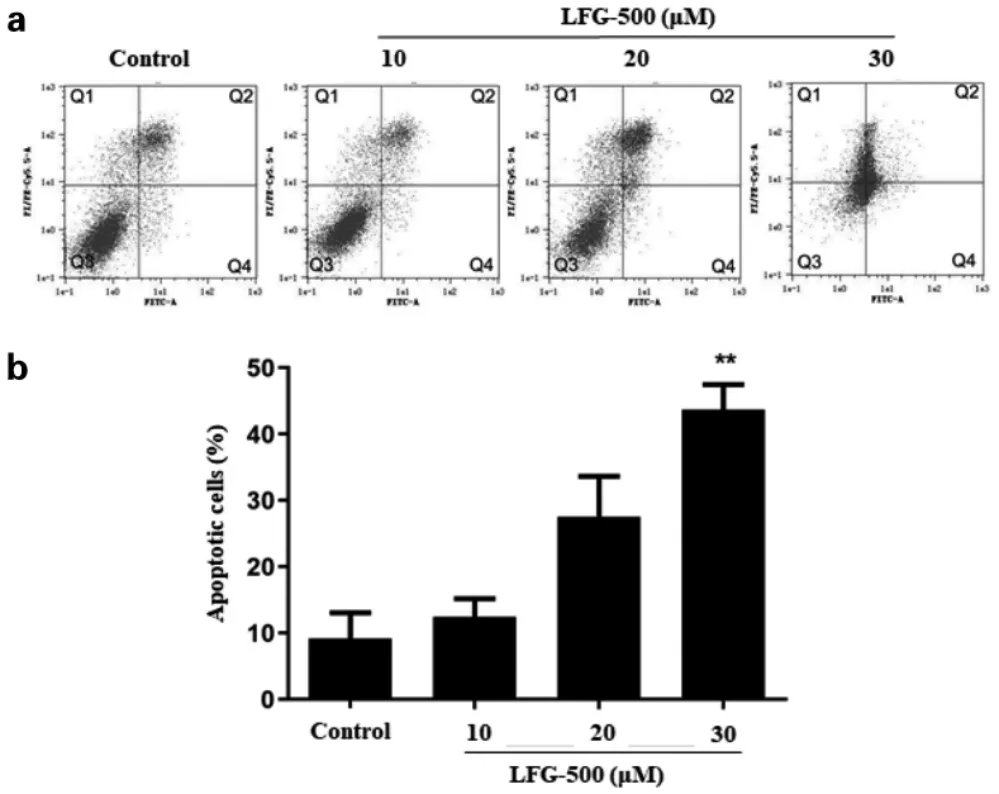
图4 不同浓度LFG-500 处理MCF-7 细胞24h 的细胞凋亡率
2.4 LFG-500 降低MCF-7 细胞线粒体膜电位水平
JC-1 流式细胞术检测结果如图5 所示,与对照组相比,10 μM、20 μM 和30 μM LFG-500 组线粒体膜电位分别降 低了22.33±4.77%、28.85±6.40%、53.52±16.38%, 提示LFG-500 可能通过降低细胞线粒体膜电位,继而激活线粒体凋亡通路诱导细胞凋亡。
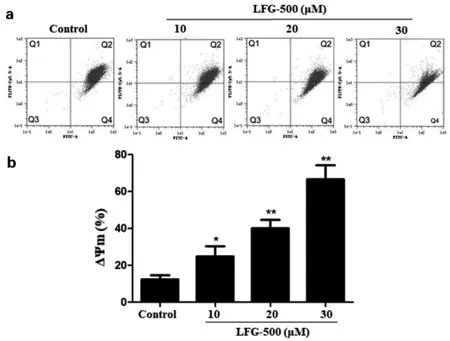
图5 不同浓度LFG-500 对MCF-7 细胞线粒体膜电位的影响
2.5 LFG-500 诱导MCF-7 细胞内ROS 水平升高
ROS 水平检测结果如图6 所示, 与对照组相比,LFG-500 处理MCF-7 细胞24 h, 中高剂量组细胞内ROS 水平显著增高,且该作用具有剂量依赖性。 上述结果提示,LFG-500 促进MCF-7 细胞内ROS 蓄积。
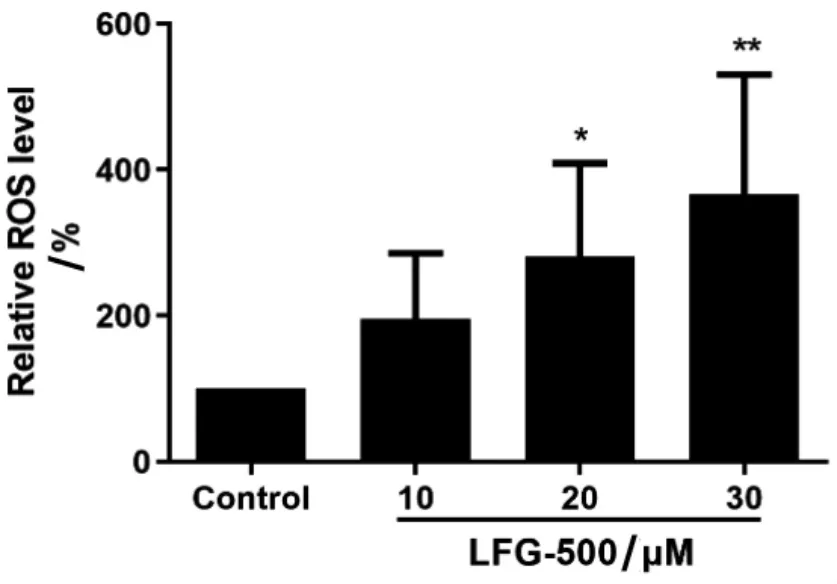
图6 不同浓度LFG-500 对MCF-7 细胞内ROS水平的影响
2.6 LFG-500 对MCF-7 细胞中线粒体凋亡途径相关蛋白的影响
Western blot 实验结果,由图7 可以看出,与对照组相比,LFG-500 给药组随着剂量增大,Bcl-2 蛋白表达逐渐减少,Bax 蛋白表达逐渐增多。 同时,由图8 可以看出, 细胞中pro-caspase-9 和pro-caspase-3 的蛋白水平显著降低, 而cleaved caspase-9 和cleaved caspase-3 蛋白水平明显升高, 说明pro-caspase-9 和pro-caspase-3 分别被LFG-500 活化。 且与对照组相比,LFG-500 可显著降低PARP 的原型表达水平。
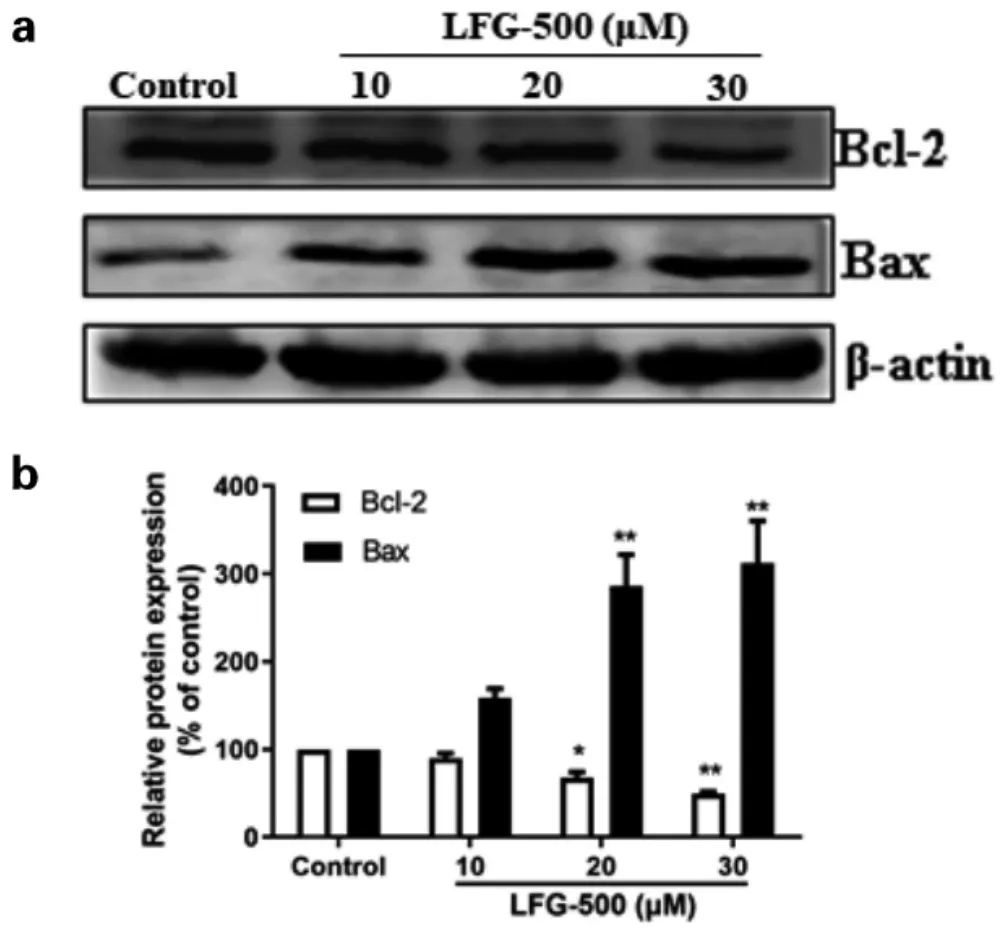
图7 不同浓度LFG-500 对MCF-7 细胞中Bax 和Bcl-2 蛋白表达水平的影响
3 讨论
肿瘤细胞的无限增殖是恶性肿瘤的十大特征之一,而凋亡失调是导致肿瘤细胞无限增殖的重要因素。 细胞凋亡又称程序性的细胞死亡,是指细胞受到某种刺激或接收到某种信号后为了维持机体内环境稳定而发生的由基因调控的细胞自主有序的死亡过程。 细胞凋亡具有独特的形态特征和生化特征, 包括细胞皱缩、细胞膜出芽、染色质凝聚、核仁碎裂、DNA 片段化,接着形成凋亡小体被周围的巨噬细胞吞噬,最后被溶酶体溶解。 肿瘤细胞凋亡在抑制肿瘤发生、发展过程中发挥重要作用。 因此,诱导肿瘤细胞凋亡,并阐明其可能的机制对于寻找新的抗癌药物具有重要的意义。本研究发现,黄酮类新化合物LFG-500 可显著抑制人乳腺癌MCF-7 细胞生长,并呈剂量依赖性(见图2)。光镜观察和Annexin V-FITC/PI 双染结果都表明,LFG-500 能诱导人乳腺癌细胞MCF-7 发生凋亡 (见图3、图4),这提示LFG-500 对细胞生长的抑制作用可能与其诱导细胞凋亡有关。
细胞凋亡包括外源性死亡受体通路和内源性线粒体凋亡通路。 在线粒体凋亡通路中,当细胞受到内部凋亡因子的刺激时,如癌基因激活的DNA 损伤、细胞缺氧以及细胞生长因子的缺失,会导致线粒体膜电位降低, 膜通透性增加, 从而使促凋亡因子Cyt C 和AIF 释放到细胞质中。Cyt C 在细胞内会结合Apaf-1(apoptotic protease activating factor-1) 形成凋亡复合物,继而激活pro-caspase-9 以及下游的pro-caspase-3,pro-caspase-3 被激活后会分解底物,如PARP,最终导致凋亡的发生。因此,本研究在明确LFG-500 诱导MCF-7 细胞凋亡的基础上, 考察LFG-500 诱导细胞凋亡是否与调控线粒体凋亡通路相关。 结果显示,LFG-500 可降低线粒体膜电位(见图5),可抑制procaspase-9 和pro-caspase-3 的 表 达, 促 进cleaved caspase-9 和cleaved caspase-3 的蛋白表达,同时下调PARP 的蛋白表达 (见图8)。 说明LFG-500 可刺激MCF-7 细胞,活化pro-caspase-9 和pro-caspase-3,继而促进PARP 切割,激活线粒体凋亡通路。
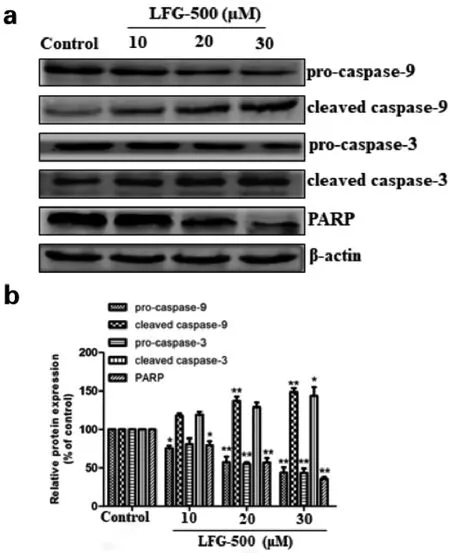
图8 不同浓度LFG-500 对MCF-7 细胞中PARP及caspase 相关蛋白表达水平的影响
ROS 参与多种生物学进程,在细胞信号、生物合成过程和宿主防御方面都发挥重要作用。 在肿瘤细胞内,ROS 水平的升高和降低作为一种轻度氧化应激反应,参与多种致癌途径的激活。 但是,持续的ROS 蓄积,特别是ROS 自由基的蓄积,会对DNA、脂质和蛋白质造成损伤,影响细胞正常生长。ROS 水平升高, 会刺激线粒体膜电位降低, 促使线粒体将ROS 释放至细胞质中,引起过度氧化应激反应,而这种过度氧化应激反应又会刺激周围线粒体释放更多的ROS,最终导致细胞死亡。 此外,Bcl-2 蛋白家族也参与到线粒体凋亡通路中,Bax/Bcl-2 的比例决定了细胞内线粒体凋亡通路是否被激活。 通过实验发现,MCF-7 细胞经过LFG-500 处理后,细胞内ROS 水平明显升高(见图6),同时,LFG-500 可上调促凋亡蛋白Bax 的表达,下调抗凋亡蛋白Bcl-2 的表达,即增加Bax/Bcl-2 的比值(见图8)。 提示LFG-500 可能是通过促进细胞内ROS 积聚、线粒体膜电位扩散,激活线粒体凋亡通路,诱导细胞凋亡,发挥抑制MCF-7 细胞生长的作用。
4 结语
综合以上研究结果可知, 当MCF-7 细胞受到LFG-500 干预后,引起细胞内ROS 水平显著升高,过量的ROS 诱导MCF-7 细胞线粒体膜电位降低, 激活了线粒体凋亡通路, 最终导致细胞凋亡。 本实验为LFG-500 的抗癌作用研究提供了理论基础,希望能为乳腺癌药物治疗提供新的思路。
