球形颗粒Li4SiO4吸附CO2反应动力学研究
2022-08-09袁伟洋秦昌雷陈淑珍冉景煜
袁伟洋,秦昌雷,陈 结,陈淑珍,冉景煜
(1.重庆大学 低品位能源利用技术及系统教育部重点实验室,重庆 400044;2.重庆大学 煤矿灾害动力学与控制国家重点实验室,重庆 400044)
0 引 言
温室气体特别是CO2大量排放引起的全球气候变化问题对于社会、经济和环境的协调可持续发展产生了严重影响。截至2021年,大气中有CO2浓度已经达到415×10-6,较1980年增加20%以上[1],且仍在快速增加,这将导致全球平均气温的进一步升高。因此,减少人为CO2的大量排放已经迫在眉睫。
高温CO2吸附是一种极具潜力的碳捕集技术[2]。相较于吸收法等捕集技术,高温CO2吸附的CO2捕集容量与反应动力学特性更优、综合能耗更低、且对设备无腐蚀,因此可以更为高效、低成本地减少CO2排放。该技术通过高温吸附剂在吸附和脱附反应器内对CO2的吸附和脱附过程来实现碳捕集。因此,吸附剂是CO2捕集过程连续运行的核心,其性能会极大地影响CO2的捕集效率。目前,较为常见的高温CO2吸附剂主要有CaO基吸附剂[3-6]和Li4SiO4基吸附剂[7-10]。相比较而言,Li4SiO4基吸附剂的长效稳定CO2吸附量为0.2~0.3 g/g,优于CaO基吸附剂,且其脱附温度与能耗更低,因而近些年开始逐渐受到广泛关注。
Li4SiO4基吸附剂主要通过固相反应法、溶胶-凝胶法、沉淀法等进行制备[11-12],并通过掺杂碱金属碳酸盐(K2CO3,Na2CO3等)或金属元素(Fe,Al等)、以及改善材料孔隙结构(球磨、酸洗)等方法强化其CO2吸附性能[13-14]。反应过程的宏观动力学特性则主要是基于收缩核模型、Jander模型等来研究Li4SiO4的吸脱附速率常数、活化能等动力学参数[15-16]。此外,也有少量工作关注于CO2捕集应用环境中典型杂质的影响特性与作用机制等。ESSAKI等[17-18]研究了工业烟气中水蒸气对Li4SiO4吸附性能的影响,发现水蒸气通过在Li4SiO4形成预吸附表面来促进CO2吸附;YUAN等[19-20]则研究了工业烟气中SO2对Li4SiO4吸附性能的影响,发现SO2通过与Li4SiO4反应生成Li2SO4或Li2SO3来抑制CO2的吸附过程。
对于高温CO2吸附技术,吸附与脱附反应器普遍采用各种类型的流化床反应器[21-22]来实现高效的气固反应与物料循环。目前,大多数研究都集中在粉末形态的Li4SiO4基吸附剂上,但粉末状吸附剂无法满足流化床稳定运行的基本要求,因此采用Li4SiO4基吸附剂捕集CO2前还需进一步对其造粒。目前已有少量工作[10,23-24]研究了不同前驱体和造粒方法对于成型后Li4SiO4吸附性能、循环性能、机械性能等的影响规律,但是对于Li4SiO4颗粒的反应动力学研究则十分缺乏。基于此,通过挤出-滚圆法制备了Li4SiO4吸附颗粒,并采用聚乙烯(PE)、NH4HCO3、葡萄糖(C6H12O6)作为造孔剂以提升成型颗粒的吸附性能;进一步基于吸附性能最优的颗粒进行了吸附反应动力学的试验测试与分析,可为Li4SiO4吸附颗粒的工业应用提供参考。
1 Li4SO4颗粒吸附CO2试验研究方法
1.1 Li4SiO4吸附颗粒制备
Li4SiO4粉末合成:由于掺杂K2CO3后的Li4SiO4吸附剂(简写为K-Li4SiO4)具有更好的CO2吸附量和吸附动力学特性,因此选择K-Li4SiO4进行造粒。以Li2CO3粉末(纯度>99.0%,阿拉丁)、纳米SiO2(纯度>99.0%,阿拉丁)、K2CO3粉末(纯度>99.0%,阿拉丁)为原料,采用固相反应法合成K-Li4SiO4,Li、Si、K最佳物质的量之比为4.1∶1∶0.2。基本合成过程为:将Li2CO3、SiO2和K2CO3以最佳比例混合,并在球磨机中球磨1 h。球磨后的材料在马弗炉中750 ℃条件下煅烧6 h,制得样品研磨筛分至100~187.5 μm。
挤出滚圆造粒、按吸附剂、造孔剂质量比为1∶0.2将K-Li4SiO4粉末分别与PE、NH4HCO3或C6H12O6混合,随后加入一定量的去离子水形成湿粉末。将湿粉末加入挤出机(E-26)挤成直径1 mm的长圆柱体,空气中干燥10 min后将长圆柱切成短圆柱并放入滚圆机(R-120)中进行滚圆处理。滚圆后的颗粒在马弗炉中700 ℃温度下煅烧30 min使得造孔剂充分分解燃烧,从而得到3种Li4SiO4球形颗粒。为简化起见,基于PE、C6H12O6及NH4HCO3三种造孔剂制备的Li4SiO4吸附颗粒分别简写为P颗粒、C颗粒、N颗粒。
1.2 热重分析方法
在热重分析仪(NETZSCH,TG209 F3)中测试Li4SiO4颗粒的CO2吸脱附循环性能。每次测试取5 mg的Li4SiO4颗粒装入坩埚中,随后将坩埚放入热重支架上,在85 mL/min的N2气氛下以15 ℃/min速率升温至625 ℃并通入15 mL/min的CO2维持20 min,随后关闭CO2并升温至700 ℃脱附20 min,完成1次吸脱附循环。上述循环过程重复15次,以评价Li4SiO4颗粒的CO2吸附性能稳定性。
为研究Li4SiO4颗粒的CO2吸附动力学,使用热重分析仪测试了不同吸附温度、不同CO2浓度以及不同颗粒粒径条件下Li4SiO4颗粒的CO2吸附过程。对于不同吸附温度下的热重测试,固定CO2体积分数为15%,粒径为750~1 250 μm,每次测试取5 mg的Li4SiO4颗粒,在85 mL/min N2气氛下以15 ℃/min的速率升温至吸附温度(550、575、600、625 ℃)并通入15 mL/min的CO2吸附20 min,随后关闭CO2并升温至700 ℃脱附20 min;对于不同CO2浓度下的热重测试,固定吸附温度为625 ℃,吸附颗粒粒径为750~1 250 μm,吸附时的CO2体积分数分别控制为15%、25%、50%,其他条件不变。对于不同粒径下的热重测试,固定吸附温度为625 ℃,CO2体积分数为15%,粒径分别控制为75~100、250~750、750~1 250 μm,其他条件不变。
此外,还对3种造孔剂进行了恒定升温速率条件下的热重测试,以了解其分解燃烧失重特性。每次测试取5 mg造孔剂,在100 mL/min空气中以5 ℃/min的速率由30 ℃升温至700 ℃。
1.3 抗压强度及孔结构测试
采用精度为0.1 N的数字测力仪(SHIMPO FGP-10)测试Li4SiO4吸附颗粒的抗压强度。测试时,测力仪的压头对单个颗粒缓慢加压至颗粒破碎,此时的压力为颗粒所能承受的最大压力。每种吸附颗粒测量10次后取平均压力除以吸附颗粒的平均横截面积即可得到其抗压强度,计算式如下[24]:
(1)
式中:Pm为抗压强度,MPa;Fi为第i个颗粒所能承受的最大压力,N;r1为粒径范围中较小的粒径,mm;r2为粒径范围中较大的粒径,mm,如0.75~1.25 mm,则r1=0.75 mm,r2=1.25 mm。
采用物理吸附仪(TriStar II 3020)进行N2等温吸脱附试验,并通过BET-BJH方法得到3种颗粒的比表面积和孔径分布。
2 结果与讨论
2.1 Li4SiO4吸附颗粒基础特性
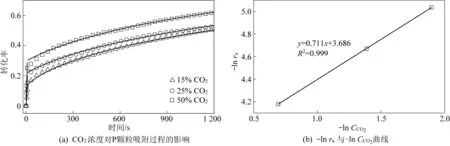
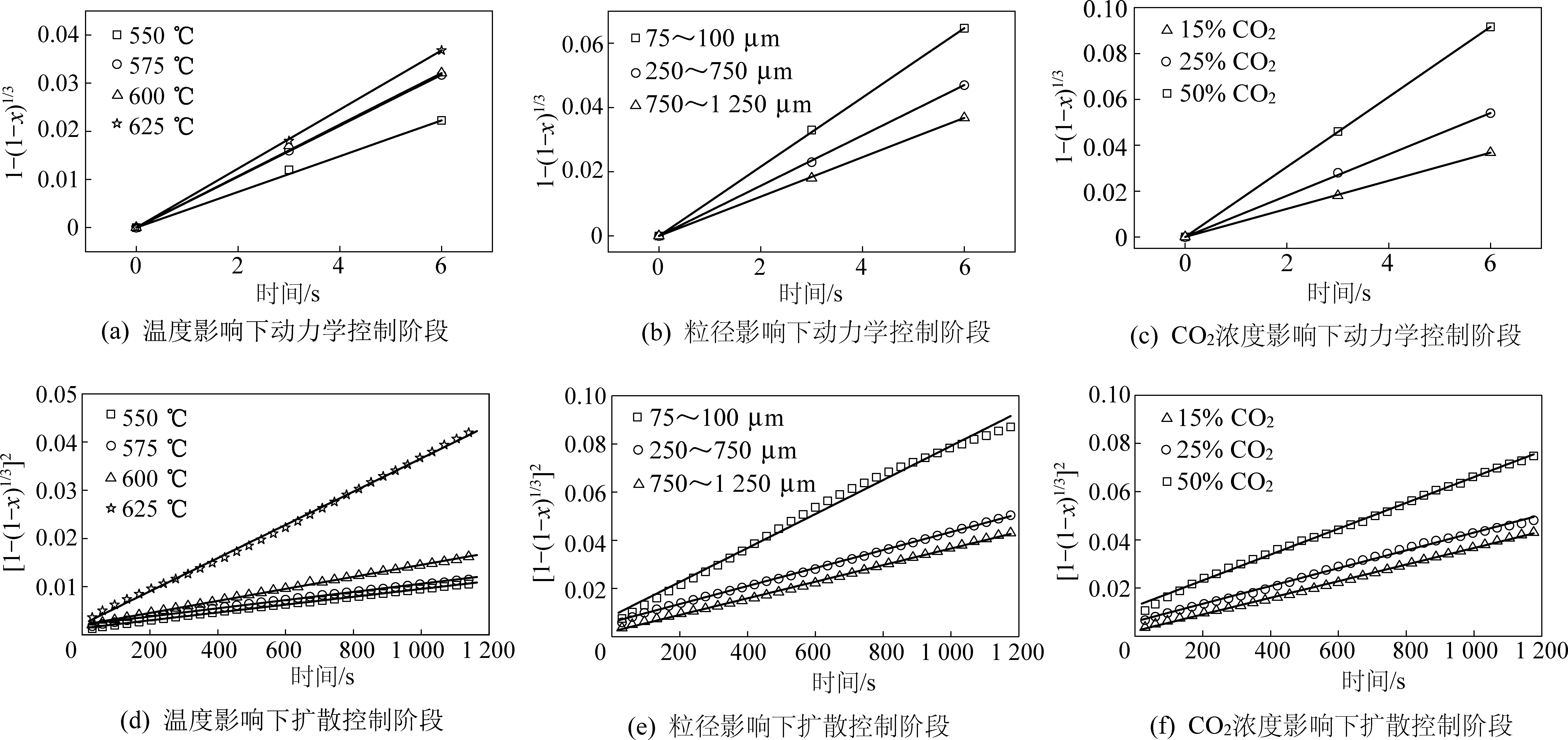
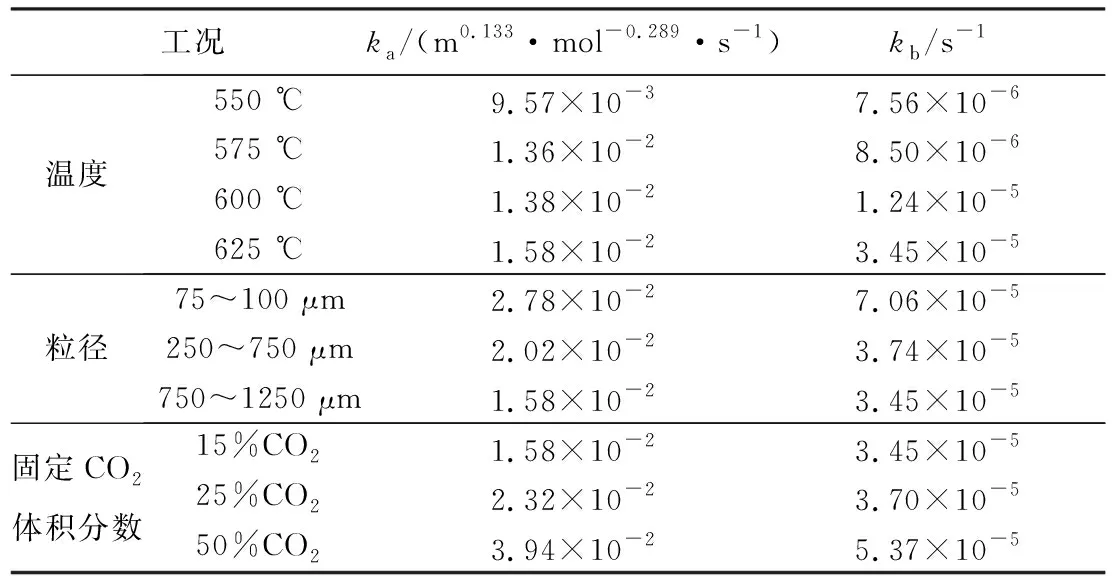
为确认造孔剂能否完全分解燃烧,对PE、NH4HCO3、C6H12O6三种造孔剂在空气中进行了恒定升温速率条件下的热重测试,结果如图1a所示。可以看出,PE在235 ℃时开始分解,390 ℃时分解速率加快;C6H12O6在60 ℃时开始分解,180 ℃时加速分解;NH4HCO3在常温下即可分解,60 ℃时剧烈分解;3种造孔剂均能完全分解燃烧,因此不会残留杂质对Li4SiO4颗粒造成负面影响。随后,对3种吸附颗粒在完成造粒以及15次吸脱附循环后进行了抗压强度测试,结果如图1b所示。造粒后P颗粒、C颗粒、N颗粒的抗压强度分别为4.5、11.4、20.3 MPa,其抗压强度排序为P颗粒 进一步,为评价吸附颗粒的吸附性能及循环稳定性,对颗粒进行了15次CO2吸脱附循环测试,结果如图2所示。从图2a可以发现,P颗粒的吸附性能最佳,在第一次吸附过程中质量增加(即CO2吸附量)达到20 g/g;而C颗粒约为13%,N颗粒约为10%,未造孔颗粒最差,为1%。图2b给出了Li4SiO4吸附CO2过程中转化率随循环次数的变化曲线,可以看出,10次循环后,4种颗粒的转化率基本保持稳定,15次循环后的转化率:P颗粒>C颗粒>N颗粒>未造孔颗粒,即在稳定的CO2吸附量方面:P颗粒>C颗粒>N颗粒>未造孔颗粒,与抗压强度测试所得结论一致。 为了解3种颗粒吸附性能和抗压强度存在差别的原因,对吸附颗粒进行了N2等温吸脱附实验,得到了3种颗粒的比表面积、孔容和孔径分布曲线,如图3所示。从图3a中可以发现,P颗粒的比表面积和孔容最大,C颗粒其次,N颗粒最差;而图3b则可以看出,孔结构发达程度方面:P颗粒>C颗粒>N颗粒。因此,P颗粒由于具有最为发达的孔隙结构,使得其抗压强度最差,但吸附性能最优。 图3 颗粒孔隙结构Fig.3 Pore structure of particles 考虑到P颗粒的CO2吸附性能最优,因此选择P颗粒进行吸附反应动力学相关研究。为了得到P颗粒吸附CO2的反应级数,测试了在不同CO2浓度下P颗粒的吸附曲线,如图4a所示。可以看出,曲线存在转折点,即吸附反应存在动力学控制和扩散控制2个典型阶段。随CO2浓度升高,P颗粒的转化率升高。通过质量作用定律,可以求得动力学控制阶段的反应级数,其计算公式[25]为: (2) -lnra=-nlnCCO2-lnk (3) 式中:ra为反应速率;k为反应速率常数;CCO2为CO2浓度;n为反应级数;在动力学控制阶段ra可按下式计算: (4) 式中:Δx为Δt时间内转化率的变化量;MCO2为CO2的摩尔质量,即44 g/mol;MLi4SiO4为Li4SiO4的摩尔质量,即120 g/mol。 通过图4a可以得到不同CO2浓度下的反应速率ra,进而得到-lnra与-lnCCO2之间的关系如图4b所示。拟合后得到直线的斜率,即反应级数n为0.711。 图4 P颗粒CO2吸附反应的CO2浓度依赖性Fig.4 CO2 concentration dependence of CO2 adsorption by P-Li4SiO4 particles 为了进一步研究温度和颗粒粒径对吸附过程的影响,测试了不同温度和不同粒径条件下P颗粒的CO2吸附曲线,如图5a,图5b所示。可以发现,吸附20 min后,550、575、600以及625 ℃反应温度下的转化率分别为0.27、0.29、0.34、0.50,随温度升高,吸附速率加快,转化率上升;而吸附20 min后,粒径为75~100 μm、250~750 μm、750~1 250 μm吸附颗粒的转化率分别为0.65、0.54、0.50,随粒径增大,吸附速率降低,转化率下降。 图5 P颗粒CO2吸附反应的温度和粒径依赖性Fig.5 Temperature dependence and particle diameter dependence of CO2 adsorption by P-Li4SiO4 particles 为得到P颗粒吸附CO2过程的动力学关键参数,采用晶粒模型[26]分析动力学控制阶段,其方程如式(5)所示: (5) 其中:x为P颗粒的转化率;t为时间,s;b为P颗粒在吸附CO2反应中的化学计量数,即b=1;ka为动力控制阶段的反应速率常数,(m3n-2·moln-1·s-1),n为动力学控制阶段的反应级数,根据前文计算结果取0.711;CAS为P颗粒表面CO2浓度,mol/m-3;ρs为P颗粒的摩尔密度,mol/m3;Ag为P颗粒表面积,m2;Vg为P颗粒体积,m3;Fg为颗粒的形状因子,对于球形颗粒,形状因子取3。代入已知数值后,得到转化率与时间的关系式为 (6) 采用Jander模型[16]分析扩散控制阶段,其转化率与时间的关系式为: (7) 式中:x为P颗粒的转化率;t为时间,s;kb为扩散控制阶段的反应速率常数,s-1。 图6 动力学模型拟合P颗粒CO2吸附反应Fig.6 Fitting of CO2 adsorption by P-Li4SiO4 particles using kinetic models 从表1可以看出,随温度升高、CO2浓度升高以及粒径降低,反应速率常数增大。此外,我们还将拟合得到的转化率曲线与实验曲线对比,发现拟合曲线与实验曲线吻合度较高,如图4a、图5a,图5b所示。 表1 不同工况下的反应速率常数Table 1 Reaction rate constants under different conditions 进一步,通过温度与反应速率常数的关系,得到了动力学控制阶段和扩散控制阶段的阿累尼乌斯曲线,如图7所示。通过阿累尼乌斯公式,得到动力控制阶段活化能为41.61 kJ/mol,指前因子为4.20 m0.133·mol-0.289·s-1;扩散控制阶段的活化能和指前因子分别为114.81 kJ·mol-1和131.92 s-1。 图7 阿累尼乌斯曲线Fig.7 Arrhenius plot 需要注意,虽然基于热重法探究了Li4SiO4颗粒在堆积状态下的CO2吸附反应动力学特性,但是与其流化床实际应用状态还存在一定差异。因此,还需要进一步研究Li4SiO4颗粒处于流态化运动状态时的CO2吸附反应动力学,比如流化风速与颗粒粒径等条件对于Li4SiO4颗粒CO2吸附过程的影响规律,以为工业应用提供更为直接的指导。 1)通过热重测试和抗压强度测试,获得了3种造孔剂造孔后Li4SiO4吸附颗粒的基础特性,即抗压强度:P颗粒(4.5 MPa) 2)采用晶粒模型和Jander模型能较好地拟合P颗粒的转化率曲线,可以用于分析P颗粒吸附CO2过程的动力学参数。拟合后得到的反应速率常数随温度升高、CO2浓度升高以及粒径降低而增大。 3)同时,拟合也得到了动力控制阶段活化能为41.61 kJ/mol,指前因子为4.20 m0.133·mol-0.289·s-1;扩散控制阶段的活化能和指前因子分别为1 14.81 kJ/mol和131.92 s-1。
2.2 Li4SiO4颗粒吸附反应动力学



3 结 论
