索拉非尼在HepG2与LO2细胞的摄取动力学
2022-08-09温金华南昌大学第一附属医院GCP南昌330006
温金华(南昌大学第一附属医院GCP,南昌 330006)
肝癌是我国常见的恶性肿瘤,全球有一半以上的肝癌发生在我国,病死率在恶性肿瘤中居第二位。尽管肝癌的诊疗技术已取得很大进展,但仍有大约80%的病例发现时已是中晚期,且多数合并肝硬化,并伴有肝功能异常,无法接受根治性手术治疗[1]。作为肝癌综合治疗的重要手段,药物治疗在临床上发挥着不可代替的作用,其中分子靶向治疗药物由于具有高选择性、高敏感性及高效性的特点,逐渐成为肝癌传统治疗外一种重要的治疗手段,如多靶点激酶抑制剂(TKIs,包括索拉非尼、尼洛替尼、凡德他尼、卡奈替尼等)[2]。其中,索拉非尼作为晚期肝癌的有效治疗用药,具有抑制肿瘤细胞增殖和肿瘤血管生成的作用,可显著延长晚期肝细胞癌(HCC)患者的生存时间[3-4]。索拉非尼作用的靶器官是肝脏,由于病理状态下,肝脏的功能及药物在其中的分布均可能发生变化,从而影响药物的药动学及药效学特性。本文研究索拉非尼在肝癌细胞(HepG2)与正常肝细胞(LO2)中的摄取动力学特性,从而比较HepG2 与LO2 细胞对药物的摄取变化,这对病理状态下探索索拉非尼的药物代谢动力学特性具有一定的临床意义。
1 材料
高效液相色谱系统(日本岛津shimadzu 20AT);Discovery 色谱柱ODS C18column (150 mm×4.6 mm,5 µm); 保护柱为Agilent ODS C18column (12.5 mm×4.6 mm,5 µm);DHG-9070 电热恒温鼓风干燥箱(上海精宏实验设备有限公司);MIKRO 22R 高速离心机(德国Hettich)。3111 型二氧化碳培养箱、细胞培养皿(美国Thermo Fisher Scientific 公司);ECLIPSE Ti-S倒置相差显微镜(日本Nikon 公司);SpectraMax Plus 384 全波长酶标仪(美国MD);TDZ4-WS低速自动平衡离心机(湖南湘仪)。
HepG2 与LO2 细胞(杭州赫贝公司);HepG2细胞培养基(Gibco DMEM basic);LO2 细胞培养基(Gibco RPMI Medium 1640);胎牛血清(FBS,Gibco 公司,货号10099-141);索拉菲尼对照品[纯度>99%,中科华检(北京)科技有限公司];甲醇、乙腈(色谱纯,SIGMA-ALORICH);三氟乙酸(分析纯,杭州米克化工有限公司)。
2 方法
2.1 细胞培养
HepG2 细胞株培养条件:含10% FBS 和1×青链霉素的DMEM 培养基;LO2 细胞株培养条件:含10% FBS 和1×青链霉素的RPMI-1640培养基。将HepG2 或LO2 细胞在对应的培养基中,于37℃、5% CO2、饱和湿度培养箱中培养。
2.2 细胞处理
取正常培养的处于对数期的两种细胞株,用0.25%Typsin 消化,1000 r·min-1离心5 min,计数板下计数,铺6 孔板,每种细胞4 个孔,每孔均加入5×105个细胞,放入培养箱中静置2 d。吸取培养液,加入10 μL 浓度分别为0.25×10-3、0.5×10-3、0.75×10-3、1.0×10-3、1.25×10-3、2.0×10-3mmol·L-1的索拉非尼,培养液终浓度达到5、10、15、20、25、40 μmol·L-1,加入至对应的HepG2 及LO2 细胞中,10 min 后处理细胞,吸去含药培养基,1×PBS 洗3 遍后,加入0.5 mL 无菌水于-80 ℃冰箱反复冻溶3 次,收集细胞裂解液,用于索拉非尼浓度检测。采用同样的方法,加入索拉非尼使其培养液终浓度为10 μmol·L-1,经过5、10、20、40 min 孵育后处理细胞,用于药物浓度检测。
2.3 样品的处理与制备
从超低温冰箱中取出不同处理组细胞裂解液样本,溶解后准确吸取0.2 mL 于5 mL 具塞离心管中,准确加入2 mL 乙酸乙酯,振荡10 s,于4℃环境下5000 r·min-1离心5 min。取有机相于尖底玻璃管中,剩余细胞裂解液残渣用2 mL乙酸乙酯重复萃取一次,离心后合并两次有机相,于50 ℃水浴中氮气流吹干,残渣用0.1 mL甲醇复溶,超声15 s,漩涡混匀1 min,18 000 r·min-1离心5 min,取上清液20 µL 进高效液相色谱系统分析。
2.4 细胞总蛋白提取
将各组细胞样品收集到1.5 mL EP 管中,每管中加入200 μL Western blot 及IP 裂解液[使用前加入苯甲基磺酰氟(PMSF),终浓度1 mmol·L-1],混匀后4℃裂解30 min,同温条件12 000 r·min-1离心处理样品,分别取上清液储存。BCA 法测定蛋白浓度:将0.5 mg·mL-1标准牛血清蛋白按0、1、2、4、8、12、16、20 μL 加到96 孔板的标准品孔中,加标准品稀释液补足到20 μL。样品用对照品稀释液稀释一定浓度后加20 μL 到96 孔板中。按50 倍体积BCA 试剂A 加1 倍体积BCA 试剂B(50∶1)配制适量BCA 工作液,充分混匀,各孔加入200 μL BCA 工作液,37℃放置30 min。测定562 nm 处的吸光度值,根据标准曲线计算样品的蛋白浓度。
2.5 色谱条件
色谱柱:Discovery 色谱柱ODS C18柱(150 mm×4.6 mm,5 μm),柱温35 ℃,流动相为乙腈-水-0.1%三氟乙酸=45∶35∶20(V/V),流速1.0 mL·min-1,检测波长266 nm,进样量20 μL。采用该条件进行了索拉非尼HPLC 检测方法的精密度、准确度和稳定性等方法学考察,结果均符合要求。
2.6 数据处理
根据米氏方程:V=Vmax[S]/(Km+[S])计算摄取动力学参数,V(pmol·mg protein-1·min-1)为摄取速率,Vmax为最大摄取速率,Km为米氏常数,[S]为底物浓度。
3 结果
3.1 细胞培养及索拉非尼细胞裂解液中浓度检测方法
按培养条件完成HepG2 与LO2 的细胞培养(见图1),成功建立了索拉非尼的液相色谱检测方法(见图2),在本试验提取方法和色谱条件下,索拉非尼在0.5 ~10.0 µg·mL-1吸光度线性关系良好,标准曲线方程为Y=3.172×104X-2.966×103(r=0.9999)。方法学验证显示精密度、准确度和不同条件下的稳定性均达到相关要求(见表1 和表2)。
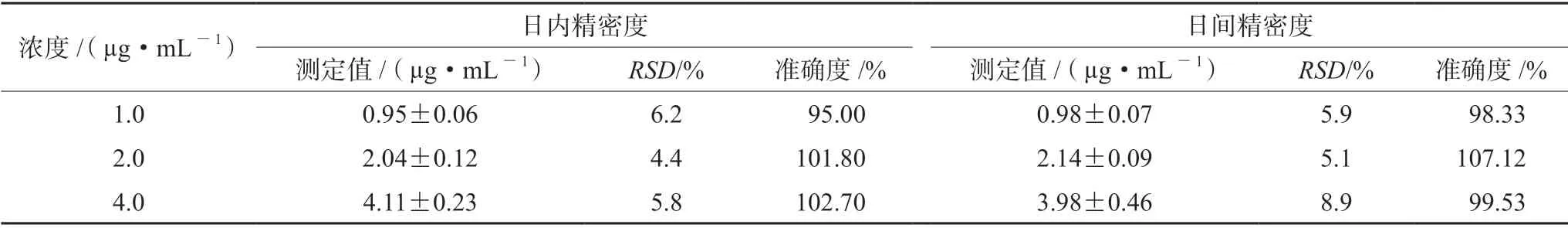
表1 索拉非尼检测方法的精密度与准确度(n =5)Tab 1 Precision and accuracy of sorafenib (n =5)

表2 索拉非尼检测方法的稳定性考察(n =5,%)Tab 2 Stability of sorafenib (n =5,%)

图1 HepG2 与LO2 细胞贴壁图Fig 1 Attachment diagram of HepG2 and LO2 cells
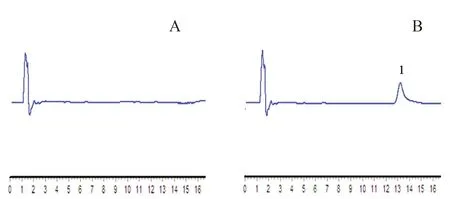
图2 索拉非尼色谱图Fig 2 Chromatogram of sorafenib
3.2 索拉非尼的摄取动力学
HepG2 细胞对索拉非尼的摄取随着索拉非尼浓度的增加而增加,在浓度为20 µmol·L-1时摄取趋于饱和;而LO2 细胞对索拉非尼的摄取亦随着索拉非尼浓度的增加而增加,在浓度为15µmol·L-1时摄取趋于饱和;但与LO2 细胞相比较,HepG2 细胞对索拉非尼的摄取量明显增加(见图3)。当加入10 µmol·L-1的索拉非尼,HepG2 与LO2 细胞对索拉非尼的摄取随着时间的增加而增加,均在20 min 时趋于饱和。HepG2 细胞的Vmax为(684.14±78.19)pmol·mg protein-1·min-1,Km为(93.3±17.56)µmol·L-1;LO2 细胞的Vmax为(335.61±69.73)pmol·mg protein-1·min-1,Km为(135.68±29.34)µmol·L-1; 结果显示HepG2 细胞对索拉非尼的摄取速率明显高于LO2细胞的摄取速率(见图4)。
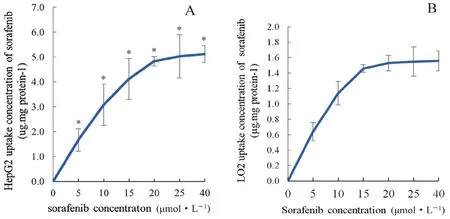
图3 索拉非尼(5 ~40 μmol·L-1)在HepG2(A)与LO2(B)细胞中的摄取Fig 3 Uptake of sorafenib (5 ~40 μmol·L- 1)in HepG2(A)and LO2(B)cells

图4 索拉非尼(10 μmol·L-1)在HepG2(A)与LO2(B)细胞中孵育(5 ~40 min)后的摄取Fig 4 Uptake of sorafenib (10 μmol·L-1)after the incubation(5 ~40 min)in HepG2(A)and LO2(B)
4 讨论
索拉非尼是美国食品药品监督管理局批准的治疗HCC 的一线小分子靶向药物,为多靶点激酶抑制剂,可通过抑制丝氨酸/苏氨酸激酶、血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF)受体酪氨酸激酶的活性,从而抑制肿瘤血管生成和增殖[5]。目前针对索拉非尼的药理学作用机制及耐药机制的研究较多,但对其在肿瘤中的药物代谢动力学包括针对在肝癌细胞中的摄取动力学研究的报道较少[6]。本研究通过观察索拉非尼在肝癌细胞及正常肝细胞中的摄取动力学特性,发现索拉非尼在肝癌细胞(HepG2)中摄取量及摄取速率明显高于正常肝细胞(LO2)。HepG2 细胞对索拉非尼的摄取速率Vmax显著高于LO2 细胞。因此索拉非尼对肝癌细胞具有一定的靶向性,这种摄取靶向性有利于提高治疗效果并降低不良反应发生率。
有研究显示,一些代谢酶如CYP3A5、CYP3A4、CYP2C19、CYP2D6 及药物转运体如P-糖蛋白、有机阳离子在介导索拉菲尼与其他药物的体内相互作用过程中扮演了重要的角色[7-8],因此,这些代谢酶及药物转运体在肝癌细胞中介导索拉非尼的摄取中可能也起着重要作用,如CYP3A5*3基因型患者中索拉非尼代谢水平极低,可能导致严重的肝和肾损害[9]。围绕这些代谢酶及转运体对索拉非尼的药物代谢动力学及药效学影响,需进一步开展相关的研究。
